适用于猪场沼液处理的好氧反硝化菌筛选及其脱氮特性评价
孙 宏,吴逸飞,张 恒,2,沈 琦,姚晓红,王 新,汤江武*,葛向阳
(1.浙江省农业科学院植物保护与微生物研究所,浙江杭州 310021;2.华中农业大学农业微生物国家重点实验室,湖北武汉 430030)
近年来,随着畜禽规模化养殖程度提高,养殖污染问题日益突出,成为限制畜牧业发展的重要瓶颈。沼液是畜禽污水经过厌氧沼气工程处理后的产物,其含有较多的有机物及氮、磷等污染物,无法直接排放,需进一步处理才能避免对环境的影响[1]。目前较为常见的沼液处理工艺包括物理、化学和生物等多种手段[2-3],其中微生物处理沼液技术由于占地面积小、成本较低等优势在沼液净化中发挥了重要作用[3]。但经过微生物处理后沼液中氨氮含量有较大程度降解,而总氮(TN)去除率仍偏低,特别是生化处理出水中仍含有大量硝酸盐氮,具有潜在的环境风险[4-5]。
传统硝酸盐氮的去除需要严格厌氧环境,且较易受到氧气或亚硝酸盐的抑制。好氧反硝化途径的发现为硝酸盐氮在好氧条件下的去除提供了新思路[6]。近年来,国内外研究陆续从生活污水处理厂活性污泥[7-9]、海湾沉积物[10]、农用肥土壤[11]等多种来源筛选获得好氧反硝化菌株,均对去除硝酸盐氮和TN 有良好效果。虽然目前在好氧反硝化菌的筛选方面开展了一些研究,但从处理猪场沼液系统的好氧污泥中有针对性地筛选适合其脱氮处理菌株的研究仍较少,特别是在处理沼液实际应用时合适菌剂添加量方面的报道。
因此,本研究尝试从畜禽污水处理厂的活性污泥中筛选好氧反硝化菌,并对其在不同氮源下的脱氮特性进行研究,探讨不同好氧反硝化菌添加量对沼液污染物的去除效果,为利用好氧反硝化菌处理沼液实现高效脱氮提供理论依据。
1 材料与方法
1.1 污泥来源与沼液水质指标 污泥来自运行稳定良好的浙江安吉吉成牧业养殖场处理沼液的缺氧-好氧污水处理系统的曝气池。沼液取自浙江金帆生态养殖有限公司黑膜厌氧发酵池,化学需氧量(COD)、氨氮、硝酸盐氮、亚硝酸盐氮、TN 和pH 等水质指标见表1。

表1 猪场沼液污染物指标
1.2 培养基 反硝化富集培养基:Na3C6H5O7·2H2O 6 g/L、KNO31 g/L、KH2PO41.5 g/L、Na2HPO40.42 g/L、MgSO4·7H2O 1.0 g/L、CuSO4·5H2O 4.0 mg/L、FeSO4·7H2O 0.7 mg/L、FeCl3·6H2O 7.0 mg/L、CoCl3·6H2O 0.2 mg/L、Na2MO4·2H2O 3.4 mg/L、CaCl2·2H2O 2.0 g/L,pH 7.2。
溴百里酚蓝(BTB)鉴定培养基[12]:Na3C6H5O7·2H2O 6 g/L、KNO31.0 g/L、FeSO4·7H2O 0.05 g/L、CaCl2·2H2O 0.2 g/L、MgSO4·7H2O 1.0 g/L、1% BTB 1.0 mL/L,pH 6.8。
反硝化性能测定培养基:Na3C6H5O7·2H2O 6.0 g/L、KNO31.0 g/L、KH2PO40.75 g/L、MgSO4·7H2O 0.4 g/L,pH 7.2。
氨氮降解性能测定培养基:NH4Cl 0.382 g/L、CH3CO ONa 3.5 g/L、MgSO4·7H2O 0.05 g/L、K2HPO40.2 g/L、NaCl 0.12 g/L、MnSO4·4H2O 0.01 g/L、FeSO40.01 g/L,pH 7.2。
亚硝酸盐氮降解性能测定培养基:NaNO20.15 g/L、CH3COONa 1.5 g/L、MgSO4·7H2O 0.05 g/L、K2HPO40.2 g/L、NaCl 0.12 g/L、MnSO4·4H2O 0.01 g/L、FeSO40.01 g/L,pH 7.2。
上述平板培养基配制时需加入1.5%~2.0%琼脂粉。
1.3 好氧反硝化菌的初筛 取新鲜活性污泥1 g 采用5 mL无菌0.9% 生理盐水离心重悬2 次后,取1 mL 重悬液接种至100 mL 反硝化富集培养基中(300 mL 三角瓶),在30℃、160 r/min 下恒温振荡培养。每隔1 d 按1%(v/v)接种量转接至新的反硝化富集培养基中,连续富集4 次后,采用10 倍梯度稀释在BTB 鉴定平板上涂布。挑取平板上具有蓝色晕圈的单菌落进行连续划线纯化,将纯化后的单菌落在LB 斜面4℃保存。
1.4 好氧反硝化菌的复筛 活化初筛菌株,接种到反硝化性能测定培养基上,在30℃、160 r/min 恒温振荡培养箱中培养2 d,进行TN、硝酸盐氮、亚硝酸盐氮等指标的检测。根据TN 和硝酸盐氮去除率筛选出最优菌株。
1.5 菌种形态观察及测序鉴定 将纯化后的优选菌株在BTB 固体培养基上涂布,观察菌株的菌落形态。用细菌基因组提取试剂盒提取总DNA。分别进行筛选菌株的反硝化功能基因nirS 和nosZ 检测和16S rDNA 鉴定,nirS 基因检测所用上下游引物为Flacd:5´-TA(C/T)CACCC(C/G)GA(A/G)CCG C -3'和R3cd:5´-GA(C/G)TTCGG(A/G)TG(C/G)GTCTTG A -3´[13];nosZ 基因检测引物为nosZ-F:5´-CG(C/T)TGTTC(A/C)TCGACA GCC AG-3´ 和nosZ-1622R:5´-CG(C/G)ACCTT(C/G)TTGCC(C/G)T(C/T)GCG -3´[14];菌株的16S rDNA 检测采用通用引物为27F 和1492R[8]。
PCR 体系:10×transtaq Buffer 5 μL(含有15 mmoL/L的Mg2+),dNTP(2.5 mmoL/L)4 μL,上、下游引物(10 μmmoL/L)各0.8 μL,DNA 模板2 μL(约30 ng),Taq 酶0.4 μL,ddH2O 补至50 μL。PCR 程序:94℃预变性4 min;94℃变性1 min,55℃退火1 min,72℃延伸1 min,31 个循环;72℃延伸5 min。扩增产物经1.5%(w/v)琼脂糖凝胶电泳检测后,送交生工生物工程(上海)有限责任公司测序,用Bioedit 7.0 软件进行测序后DNA 序列分析和拼接。测序结果递交NCBI 数据库经过Blast 程序对比后,选取同源性高的序列采用MEGA 7.0软件中Neighbor-Joining 算法进行系统发育树的构建。
1.6 好氧反硝化菌的脱氮性能测试 挑取单菌落分别接种于反硝化性能测定培养基、亚硝酸盐降解性能测定培养基和氨氮降解性能测定培养基,30℃、160 r/min 条件下恒温振荡培养1 d,制得相应种子液。
分别取上述菌液按照1%(v/v)接种至装有100 mL反硝化性能测定培养基、亚硝酸盐降解性能测定培养基和氨氮降解性能测定培养基的250 mL 三角瓶中,每个处理设3 个重复,于30℃、160 r/min 条件下恒温振荡培养。其中反硝化性能测定培养基、亚硝酸盐降解性能测定培养基每隔6 h 取样,氨氮降解性能测定培养基每隔4 h 取样,分别检测OD600、TN、硝酸盐氮、亚硝酸盐氮或氨氮等含量,直至各指标趋于稳定。
1.7 好氧反硝化菌对灭菌沼液的脱氮效果评价 接种菌株至含有200 mL 灭菌沼液的500 mL 三角瓶中至菌终浓度分别为105、106、107、108CFU/mL,以不接菌的灭菌沼液为对照组,在30℃、160 r/min 下恒温振荡培养,每隔12 h 取样10 mL 沼液,检测硝酸盐氮、亚硝酸盐氮、氨氮和COD 的变化情况。每组试验包含3 个重复,试验周期为2 d。
1.8 水质指标检测方法 水质检测均采用国标方法,其中氨氮检测方法采用《水质氨氮的测定-水杨酸分光光度法》(GB 7481-87);硝酸盐氮含量检测采用《水质硝酸盐氮的测定-紫外分光光度法》(HZ-HJ-SZ-0138);TN 检测方法采用《水质总氮的测定-碱性过硫酸钾消解紫外分光光度法》(GB-11894-89);亚硝酸盐氮的测定采用《水质亚硝酸盐氮的测定-分光光度法》(GB 7493-87);COD 检测方法采用《水质化学需氧量的测定-重铬酸盐法》(GB 11914-89)。降解速率公式:
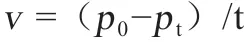
式中,v 为t 时间内的平均污染物降解速率,单位为mg/(L·h);p0为初始氨氮、硝酸盐或亚硝酸盐浓度,单位为mg/L;pt为培养t 时间后对应氨氮、硝酸盐或亚硝酸盐浓度,单位为mg/L;t 为培养或处理时间[7,11]。
1.9 统计分析 数据处理采用Excel 软件进行,除初筛结果外,均以平均值± 标准差表示。采用SPSS 13.0进行单因子方差分析,多重比较采用Duncan's 检验,P<0.05 代表差异显著。
2 结果与分析
2.1 菌株的分离筛选 经过富集培养后,从BTB 鉴定平板中共挑取到16 株菌落形态有明显差异且周围有蓝色晕圈的菌株,分别命名为ZH-1 至ZH-16。反硝化性能鉴定培养基的摇瓶复筛结果见表2。相较于其余菌株,菌株ZH-14 的TN 和硝酸盐氮的去除效果均最好,分别达到50.73%和99.99%,并在培养后仅有0.031 mg/L 的亚硝酸盐氮积累。因而选取菌株ZH-14 进行后续鉴定和脱氮能力检测。
2.2 菌株ZH-14 的形态观察、测序鉴定和分类 BTB平板鉴定结果显示,ZH-14 能够在以硝酸钾为唯一氮源的固体平板上进行反硝化产碱作用,提高培养基中的pH,使BTB 由绿变蓝(图1)。菌株ZH-14 在BTB平板上单菌落形态前期呈圆形、淡黄色、表面光滑、不透明、有凸起、易挑起;生长后期表面生成淡黄色褶皱,菌落表面积变大。
由图2 可知,nirS 和nosZ 2 种功能基因的扩增跑胶鉴定均呈阳性,序列长度在500 bp 左右,测序经过Blast 对比后发现,序列分别与施氏假单胞菌(Pseudomonas stutzeri,P. stutzeri)LYS-86 亚硝酸盐还原酶基因(登录号:GU474546)和施氏假单胞菌Gr50 的NosZ 基因(登录号:HE814034)相似度最高,均达到99%,进一步证明菌株ZH-14 具有反硝化脱氮能力。同时,挑选9 株与其16S rDNA 的同源性相似度达到99%以上的典型菌株进行多重序列对比并构建系统发育树(图3),结果表明菌株ZH-14 属于施氏假单胞菌。
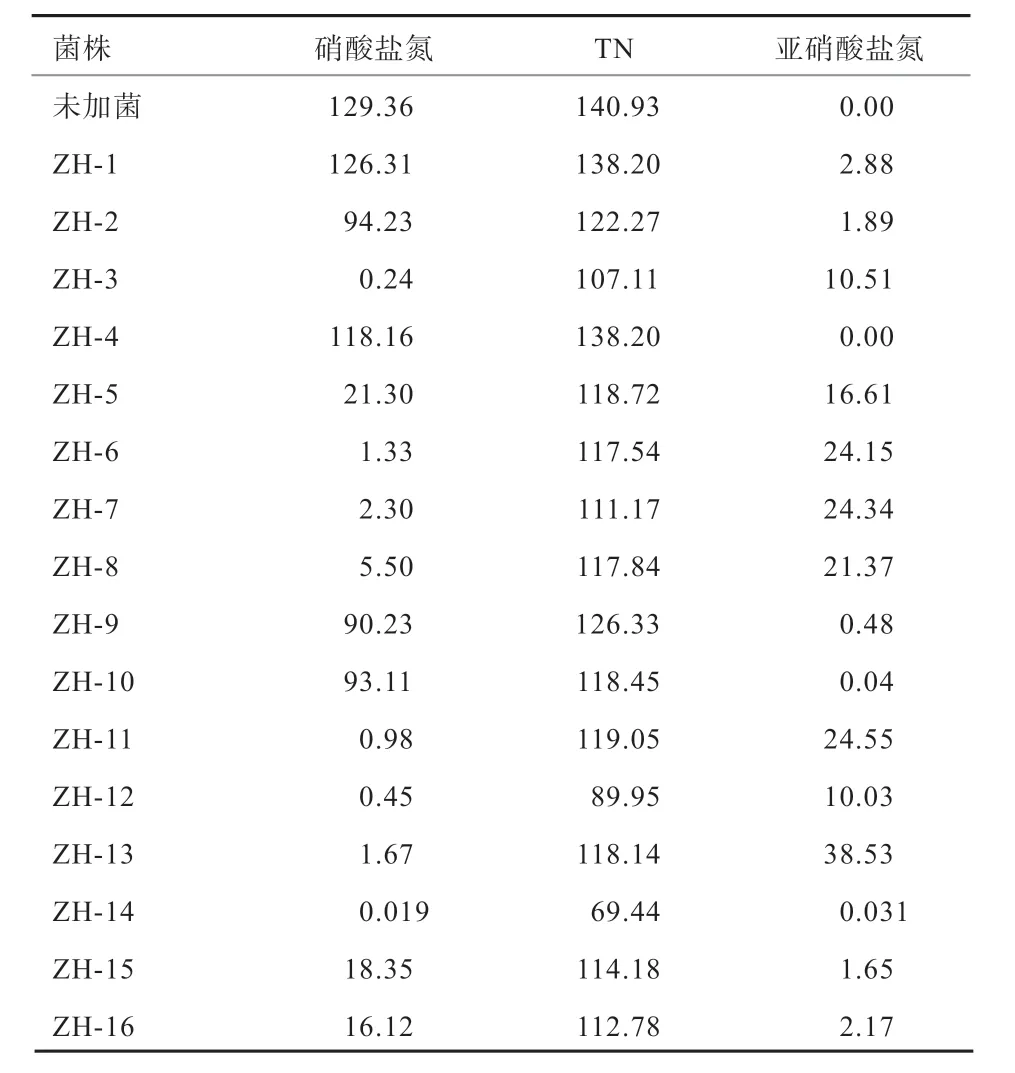
表2 好氧反硝化菌的初筛 mg/L
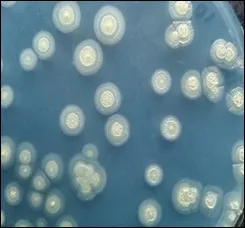
图1 菌株ZH-14 在BTB 鉴定平板上的菌落形态
2.3 菌株ZH-14 对不同氮素脱氮能力的分析 由图4-A可知,当菌株ZH-14 以硝酸钾为唯一氮源生长时,在24 h 进入对数生长期,48 h 时菌体浓度OD600为0.89。培养36 h 后硝酸盐氮基本降解完毕,48 h 时硝酸盐氮与TN 的降解率分别为100%和41.76%,降解速率分别达到2.85 mg 硝酸盐氮/(L·h)和0.95 mg TN/(L·h)。与0 h 相比,在培养30 h 时亚硝酸盐氮有微弱积累,达到12.47 mg/L(P<0.05),随后完全降解;氨氮含量则全过程均低于1.0 mg/L,各时间点无明显积累(P>0.05)。

图2 菌株ZH-14 的16S rDNA(A)、nirS(B)和nosZ 基因(C)的PCR 扩增电泳图
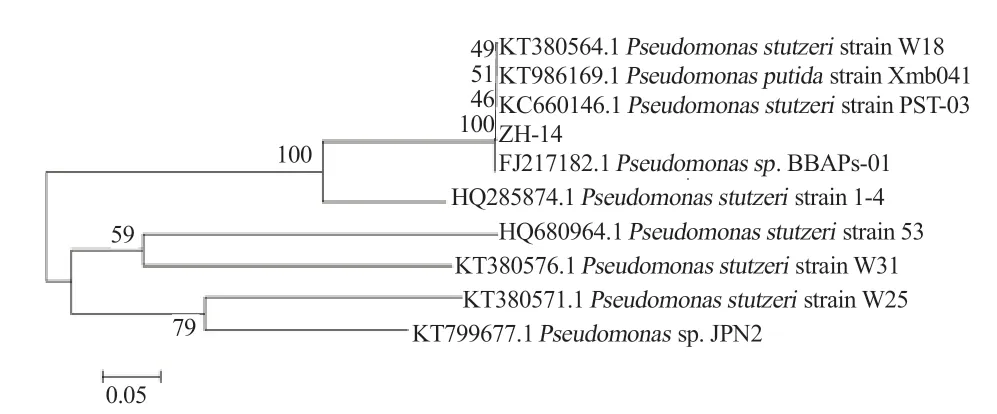
图3 菌株ZH-14 的系统发育树构建
由图4-B 可知,当菌株ZH-14 以亚硝酸钠为唯一氮源培养时,与初始相比,菌株生长12 h 进入对数生长期,最高OD600达到0.23(P<0.05)。亚硝酸盐氮在24 h内基本降解完毕,仅为0.21 mg/L,降解率为99.24%(P<0.05)。TN 含量先降后升,最终达21.61 mg/L,降解率为19.0%(P<0.05);同时氨氮在培养过程中有少量积累,培养30 h 时浓度最高,为1.63 mg/L。
目前分离出的大多数好氧反硝化菌都具有异养硝化特性,为验证菌株ZH-14 是否具有异养硝化特性,本研究以氨氮为唯一氮源,考察不同培养时间内菌株ZH-14 的生长情况及对不同氮素的降解情况。
由图4-C 可知,菌株ZH-14 在以氨氮为唯一氮源培养时,8 h 进入对数生长期,20 h 时达到最大吸光度(OD600)0.881,显著高于初始值,随后进入稳定期。在菌株生长过程中,氨氮的降解在培养24 h 后趋于稳定,剩余6.64 mg/L,降解率达94.1%(P<0.05);TN 含量从初始102.4 mg/L 下降到97.2 mg/L,降解率为5.08%(P>0.05);同时硝酸盐氮和亚硝酸盐氮含量在全过程均低于0.2 mg/L,无明显积累。
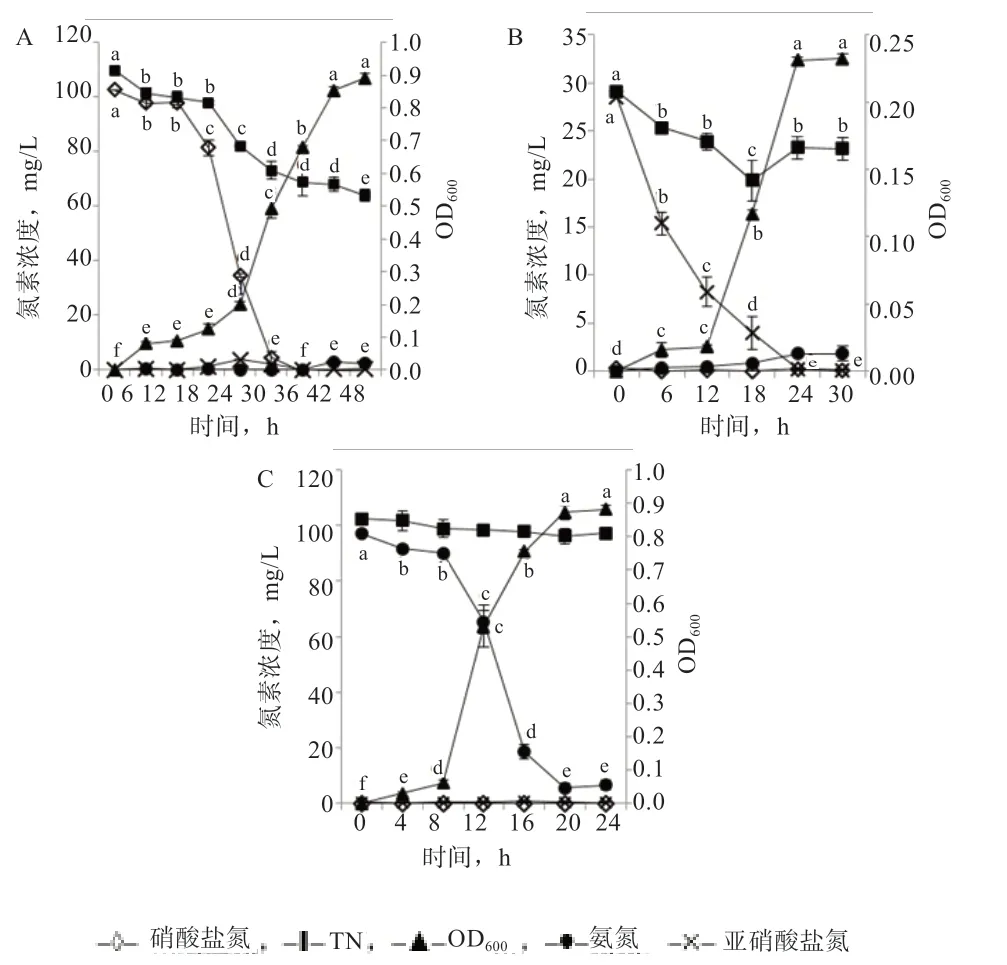
图4 菌株ZH-14 在硝酸钾(A)、亚硝酸钠(B)和氨氮(C)为唯一氮源培养基中的生长曲线及对不同氮素含量的影响
2.4 不同浓度的菌株ZH-14 对沼液污染物含量的影响 在氨氮去除方面(图5-A),与不投菌组相比,105CFU/mL 投菌组的氨氮降解速率最慢,106CFU/mL 投菌组的氨氮降解速率在24 h 前与107CFU/mL 和108CFU/mL 投菌组无显著差异( P>0.05)。在培养48 h 后,107CFU/mL 和108CFU/mL 投菌组的氨氮降解率显著高于其余组(P <0.05),分别为55.4% 和54.48%。在硝酸盐氮去除方面(图5-B),与其他组相比,107CFU/mL 投菌组的硝酸盐氮去除率最高(P<0.05),为97.7%。在COD 去除方面(图5-C),105CFU/mL投菌组在培养早期对COD 的降解效率显著低于其他投菌组(P<0.05),但随着培养时间延长, 48 h 时4 个投菌组对COD 降解差异不明显(P>0.05)。在亚硝酸盐氮方面(图5-D),与对照组相比,4 个试验组在前24 h均有不同程度的亚硝酸盐氮积累,其中106CFU/mL 投菌组积累情况最为明显,最高达到9.95 mg/L(P<0.05)。随着培养时间延长,亚硝酸盐氮含量逐渐下降,与对照相比,其中以107CFU/mL 投菌组最低,为1.49 mg/L(P<0.05)。

图5 投加不同终浓度的菌株ZH-14 处理沼液后对其污染物指标的影响
3 讨 论
3.1 好氧反硝化菌的筛选及对不同氮素的利用特性 本研究经过活性污泥原位富集筛选的方式获得1 株施氏假单胞菌ZH-14,该菌株表现出了较好的好氧反硝化能力和脱氮能力。目前筛选的反硝化菌主要包括14 个属37 个种,其中以假单胞菌属(Pseudomonas sp.)、不动杆菌属(Acinetobacter sp.)和产碱杆菌属(Alcaligenes sp.)最为常见,施氏假单胞菌也占有较大比例[15]。Yao 等[16]通过低温运行好氧反硝化工艺对原位富集到的反硝化功能菌群进行分析后发现,假单胞菌属菌株在培养后数量占比显著增加,并占主导地位,表明该类微生物较适宜反硝化的运行环境。
本研究表明,菌株ZH-14 在以硝酸盐为唯一氮源时,硝酸盐氮和TN 均随菌体生长而显著降低。由于本试验测定的TN 包含菌体细胞内氮含量,因此可推测该菌株主要通过好氧反硝化作用实现脱氮,这与许涛等[17]的研究一致。本研究中,硝酸盐氮的降解速率为2.85 mg 硝酸盐氮/(L·h),高于信欣等[18]采用不动杆菌属(Acinetobacter sp.)细菌降解硝酸盐氮的速率,但低于王田野等[11]报道的5.48 mg/L·h 的速率,可见不同菌株的脱氮效率有差异。本研究中,菌株ZH-14 具有好氧反硝化功能,且其反硝化过程包含了极低含量的亚硝酸盐氮积累,该结果与Sun 等[19]所报道的施氏假单胞菌T13 的脱氮性能一致,符合传统反硝化过程中硝酸盐先还原成亚硝酸盐,随后亚硝酸盐浓度再降低的过程。此外,由于ZH-14 菌株同时具有NosZ 和NirS 2 种反硝化基因,可实现亚硝酸盐氮的快速降解,因而试验并未发现好氧反硝化过程中有大量亚硝酸盐氮积累[20]。
本研究尝试以氨氮为唯一氮源来探讨菌株ZH-14是否具有异养硝化作用,发现氨氮去除率最高可达94.1%,低于Chen 等[21]所报道的红球菌(Rhodococcus sp.)CPZ24 在氨氮浓度为50 mg/L 条件下测得的100%去除率。考虑到本研究中培养基的初始氨氮浓度高达96.97 mg/L,可能影响了菌株最终对氨氮的去除效果。本研究在氨氮降解过程中并未检测到亚硝酸盐氮和硝酸盐氮有明显的积累,这与白洁等[10]有关脱氮卓贝尔菌(Zobellella denitrificans)的异养硝化报道一致。王秀杰等[7]采用氨氮为唯一氮源的培养基研究不动杆菌(Acinetobacter sp.)JQ1004 的脱氮性能时,同样只检测到微量的硝酸盐氮积累,并推测这可能与氨氮在氧化过程中中间产物迅速转化有关。一般认为,氨氮的异养硝化作用在没有亚硝酸盐氮和硝酸盐氮积累的情况下,主要遵循从羟胺直接转化为一氧化氮和氮气进而实现脱氮的过程[22]。但由于本研究中的TN 降解率仅为5.08%,远低于前人在异养硝化过程中所报道的92.5%[11]和93.53%[18]的TN 降解率,说明菌株ZH-14 对氨氮的去除可能主要为同化作用,少量则通过异养硝化-好氧反硝化作用实现TN 的去除。目前,有较多筛选获得的好氧反硝化菌被发现可同时以氨氮为唯一氮源生长,并具有潜在的异养硝化功能[18,23]。但由于异养硝化作用的具体机制尚未完全明确,因而还无法从分子角度对筛选菌株的异养硝化功能直接验证[24]。
本研究结果表明,菌株ZH-14 可直接利用亚硝酸盐进行生长代谢,但当菌株ZH-14 以亚硝酸盐氮为唯一氮源时,其生长速率低于仅含有硝酸盐氮和氨氮的培养基。信欣等[18]在氮源为亚硝酸盐氮的反硝化培养基上培养不动杆菌时同样发现,菌株的生长速率远低于以氨氮为唯一氮源的培养基。上述生长差异可能受到培养基中碳源含量及碳氮比的影响[7]。菌株脱氮有最佳的碳氮比,在一定范围内,脱氮效率随碳源浓度提高而增强,超过或低于最佳范围将影响菌株生长[10]。本研究中TN的降解率为19%且呈先升后降的趋势,这可能与菌株在生长后期所进行的内源性呼吸作用将菌体内源氮分解为氨氮有关[11]。同样培养后期氨氮含量的积累也可受到亚硝酸盐代谢中的同化性还原作用影响。如张培玉等[23]报道,好氧反硝化体系中可发生亚硝酸盐氮转化为羟胺再变为氨氮的过程。结合研究中较低的TN 降解率,也证明菌株ZH-14 对亚硝酸盐的降解可能包含了部分同化作用。一般认为,水中的亚硝酸盐积累将影响微生物的生长和代谢活动并对水生动物产生危害[25]。本研究中,菌株ZH-14 在利用氨氮、亚硝酸盐氮或硝酸盐氮为唯一氮源时,均未发现有亚硝酸盐的大量积累,且在以亚硝酸盐为唯一氮源的体系中生长良好,表明其具有亚硝酸盐氮耐受能力及实际应用潜力。
3.2 不同终浓度的菌株ZH-14 对沼液污染物含量的影响 本试验中,经过2 d 的培养,投菌组氨氮、硝酸盐氮和COD 的去除率分别最高达到54.48%、97.7% 和77.9%。王田野等[11]采用不动杆菌处理猪场沼液后发现,废水中氨氮、亚硝态氮和TN 的去除率分别可达97.8%、48.7% 和73.2%,略高于本研究结果。接种菌株ZH-14 后可实现COD 和氨氮的同步去除,较好弥补传统生化处理在氧化氨氮时对高有机负荷不耐受的缺点,有利于沼液污染物的去除[12]。值得注意的是,当投加不同终浓度的菌株ZH-14 处理灭菌沼液时,亚硝酸盐含量在前24 h 均有不同程度的积累,且积累量高于其在合成培养基上的含量。研究表明,碳源是菌种反硝化功能正常运行的限制性因素;当碳源不足时,无法为反硝化作用提供足够能量,可能导致中间产物,如亚硝酸盐的积累[26]。本研究中沼液的COD/TN 为6:1,仅略高于田雪雪等[8]报道的好氧反硝化菌的碳氮比极限值(COD/TN>4)。而王兆阳等[27]报道,假单胞菌属细菌对碳源的需求较高,当碳氮比低于12 时,假单胞菌属细菌的生长和反硝化能力均会受到影响。因而亚硝酸盐氮积累和氨氮降解不完全,均可能与碳源在培养后期不足有关。同时,白洁等[10]在利用Z. denitrificans菌处理混合氮源的研究中发现,硝酸盐氮可有效提高氨氮的去除效率,并推测该机制与硝酸盐氮诱导氨氮的异养硝化作用有关。赵丹等[28]研究了不同氮源的混合脱氮体系中氮素的变化情况后发现,少量硝酸盐氮会促进氨氮的去除。本研究中添加不同终浓度的菌株ZH-14 后,硝酸盐氮含量均快速下降并最终无积累,可能也对沼液中氨氮的去除造成了影响。该结果符合国外学者所提出的当脱氮系统内同时存在硝酸盐氮和氨氮时,微生物会优先利用硝酸盐氮的观点[29-30]。因此,后续研究可尝试通过在沼液中继续投加硝酸盐氮来提高其对氨氮的降解效果。
合适的添加量对微生物发挥代谢功能十分重要。接种量过低无法实现沼液污染物的有效去除,而接种量过高则造成了资源浪费,也会引起微生物的竞争性死亡[11]。韩永和等[31]报道,好氧反硝化菌的反硝化效率与其投加量直接相关。目前,对净水微生物在沼液处理中合适的添加量尚未有定论。信欣等[18]处理高氨氮猪场废水时投加的不动杆菌数为废水体积的5%。黄廷林等[32]研究表明,当反硝化不动杆菌的投菌量为5% 时,硝酸盐氮的去除率最高,达到86.62%。在本研究选取的添加范围内,不同的投菌终浓度对污染物的去除效果相近,但初始投菌终浓度越高,降解速率越快。菌株ZH-14的合适终浓度在107CFU/mL 时,即可实现对沼液中COD、氨氮等污染物快速降解。需要注意的是,与前人采用的方法不同[18],本研究为了排除外源微生物的影响而采用灭菌沼液作为试验原料对ZH-14 进行评价,不能完整说明该菌在实际条件即未灭菌沼液中的应用效果。因此,下一步有必要采用未灭菌沼液对其脱氮功能进行进一步研究,并综合考虑如连续进水情况下对其脱氮效果的影响,以完整揭示该菌作为反硝化脱氮和/或辅助同化氨氮的功能菌在沼液实际处理中的应用前景和效果。
4 结 论
本试验从养殖污水污泥中分离筛选出1 株好氧反硝化菌ZH-14,经16S rDNA 序列鉴定为施氏假单胞菌。在本试验条件下,该菌在污水中具有较好的好氧反硝化效果,36 h 即可实现硝酸盐氮的完全降解;同时该菌在不同氮源中均生长良好,在氨氮和亚硝酸盐氮的降解能力测定中氨氮和亚硝酸盐氮的最大去除率可分别达94.1% 和99.24%。菌株ZH-14 对猪场沼液的处理效果较好,其较为合适的投菌量为终浓度107CFU/mL。

