新西兰兔肌内和皮下前体脂肪细胞原代培养与诱导分化的研究
陈 涛,马立霞,李志鑫,曾勇庆*,陈 伟*
(1.山东农业大学动物科技学院,山东泰安 271018;2.山东省动物生物工程与疾病防治重点实验室,山东泰安 271018)
脂肪组织主要由脂肪细胞组成,是哺乳动物机体中发育最晚的组织。皮下脂肪位于肌肉和真皮之间,肌内脂肪位于肌束和肌纤维之间,两者生长发育环境不同,因此探究肌内脂肪和皮下脂肪形成的规律和机制可以增加对脂肪沉积机制的认识[1]。前体脂肪细胞在经历细胞形态学和顺序激活C/EBPα、C/EBPβ 和PPARγ 等基因后,最终分化为成熟脂肪细胞,始终存在于动物体内,负责脂肪的生成。
前体脂肪细胞是研究脂类代谢调节及多种疾病的基础,还可作为脂肪沉积的重要研究对象[2]。但是目前成熟的细胞系只有3T3-L1、3T3-F442A 及ob17 等。在大多数物种上都没有细胞系,只能通过原代培养的方法获取,而且一般只能在传代十代以内可以诱导分化为成熟脂肪细胞。目前,在国内外对于前体脂肪细胞的研究中,已在人、大鼠、猪及牛等动物上建立了比较成熟的细胞培养及诱导体系。因此,前体脂肪细胞相比其他细胞系而言,相对较难于培养。
新西兰兔是重要的模式动物,其前体脂肪细胞可作为人类肥胖、胰岛素抵抗以及众多心血管疾病的发病机理研究的基础[3]。因此,本研究拟建立新西兰兔的肌内和皮下脂肪的前体脂肪细胞培养体系,并且探讨其诱导分化的规律,为研究新西兰兔脂肪形成以及脂质沉积的机理奠定基础。
1 材料方法
1.1 实验材料 8 只1 日龄新西兰兔购于泰山种兔场(中国泰安)。
1.2 实验试剂 DMEM/F12 培养基、PBS、0.25%胰酶、胎牛血清(Fetal Bovine Serum,FBS)均购于Gibco 公司(美国)。青链霉素混合液、红细胞裂解液、胰岛素(Insulin,INS)、地塞米松(Dexamethasone,Dex)、3-异丁基-1- 甲基黄嘌呤(3-Isobutyl-1-Methylxanthine,IBMX)、油红O 染料、二甲基亚砜(Dimethyl Sulfoxide,DMSO)、胶原酶Ⅰ和胶原酶Ⅱ均购于北京索莱宝科技有限公司(中国北京)。反转录试剂盒PrimeScript™RT reagent Kit with gDNA Eraser(Perfect Real Time)和荧光定量试剂盒TB Green™ Premix Ex Taq™(Tli RNaseH Plus)购于TaKaRa(日本)。Cell Counting Kit-8 购于碧云天生物技术有限公司(中国上海)。RNAE.Z.N.A.®DNA/RNA Isolation Kit 提取试剂盒购于Omega Bio-Tek(美国)。
1.3 培养基及主要试剂的配制 高浓度的青链霉素混合液:1.5 mL 青链霉素混合液加入到50 mL PBS 中配成青链霉素(300 IU/mL)。胶原酶Ⅰ和胶原酶Ⅱ分别用100 mL PBS 配制成1 mg/mL。完全培养液:10%胎牛血清+100 IU/mL 青链霉素+DMEM/F12;诱导分化培养基:1 μmol/L DEX+5 mg/mL INS+0.5 mmol/L IBMX+DMEM/F12+10% FBS+100 IU/mL 青链霉素。维持分化培养基:5 mg/L INS+DMEM/F12+10% FBS+100 IU/mL 青链霉素。油红O 染色液:1 g 油红O 加入100 mL 异丙醇,使用时以油红O 饱和液加2 份蒸馏水。上述所有溶液均经过0.22 μm 微孔滤膜过滤。
1.4 实验方法
1.4.1 前体脂肪细胞的原代培养 将1 日龄新西兰兔断颈法处死,放入加满酒精的大烧杯中消毒,带入细胞间放在超净台中解剖,分别获取背最长肌和皮下脂肪并放入提前配好的高浓度的青链霉素混合液中。用眼科剪将组织剪成体积约1 mm3的组织块,转移到15 mL 离心管中,肌肉中加入3~10 倍体积的胶原酶Ⅱ,脂肪中加入3~10 倍体积的胶原酶Ⅰ[4]。将离心管置于37℃培养箱70~100 min,每隔10 min 晃动1 次离心管促进组织解离。然后,用100 μm 滤网膜分别过滤离心管内的液体,然后200 ×g 离心10 min,弃上清液后加入等体积的红细胞裂解液,室温下放置15~20 min,再经200 ×g 离心10 min,去除上清液,通过台盼蓝计数后以1×105个/mL 的细胞密度接种到25 cm2的培养瓶中。以37℃、5% 的CO2的条件下开始启动前体脂肪细胞的原代培养。24 h 后换液去除未贴壁的细胞,之后每2 d 换1 次培养基。
1.4.2 绘制细胞生长曲线 将第2 代生长良好的2 种前体脂肪细胞分别以3×104个/mL 的密度接种到96 板,每孔加入100 μL 完全培养基。分别从第0 天到第12 天,每孔加入10 μL CCK8 试剂,37℃下培养2 h,然后分别用酶标仪(Promega,美国)检测细胞在450 nm 下的OD 值,计算平均值,通过所得到的值得出2 种组织分离出来的前体脂肪细胞的生长曲线。
1.4.3 前体脂肪细胞的诱导分化 细胞生长至80%~90%时,加入分化诱导培养基进行培养,培养72 h 后,再更换分化维持培养基进行培养,2 d 换1 次培养基,培养到第8 天形成明显脂滴,通过油红O 染色,显微镜下观察,验证是否诱导成功。
1.4.4 油红O 染色法检测细胞内的脂质含量 将2 种细胞接种到96 孔板,分别在2、4、6、8、10、12 d,油红O 染色后拍照,然后通过油红O 染色提取法,通过异丙醇将细胞内的油红O 重新萃取出来,然后分别用酶标仪检测细胞在510 nm 下的OD 值,计算平均值,做出2 种细胞的脂肪含量积累曲线。
1.4.5 细胞RNA 提取以及荧光定量PCR 将2 种细胞接种到6 孔板诱导分化,分别在0、2、4、6 d 提取细胞的总RNA,并反转录成cDNA。用Primier 5.0 设计PPARγ、LPL、CEBPα、FAS 和GAPDH 的荧光定量引物(表1),并由生工生物工程股份有限公司合成(中国上海),其中GAPDH 持家基因作为内参。反应体系20 μL:2× TB Green Premix Ex Taq 10 μL 终 浓 度 为1× TB Green Premix Ex Taq,上、下游引物各0.4 μL,终浓度为0.2 μ moL/L,cDNA 模板2 μL 终浓度为5 ng/μL ,ddH2O 7.2 μL。利用LightCycler®96 实时荧光定量PCR 系统,检测2 种前体脂肪细胞分化过程中相关基因的表达情况;采用2-ΔΔCt的方法计算基因的相对表达量。
1.5 统计分析 所有实验均设置3 次重复,所有数据均以平均值±标准差表示,采用SPSS 20 统计分析软件中的One-way ANOVA 进行方差分析,通过Duncan's 方法进行多重比较,显著性水平设为P<0.05。

表1 荧光定量PCR 引物序列
2 结 果
2.1 原代培养的形态学观察 肌内和皮下前体脂肪细胞在分离后的2 h 已经贴壁;24 h 时细胞呈现出短梭形和不规则的三角形的细胞形态(图1-A 和E);第2 天细胞变成长梭形(图1-B 和F);在第6 天培养瓶内出现一些成熟的脂肪细胞(图1-C 和G);原代培养第8 天,细胞长满培养瓶,甚至出现重叠生长,有一些细胞脱落浮于培养基上(图1-D 和H)。
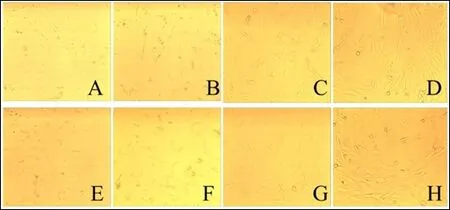
图1 肌内和皮下前体脂肪细胞的原代细养
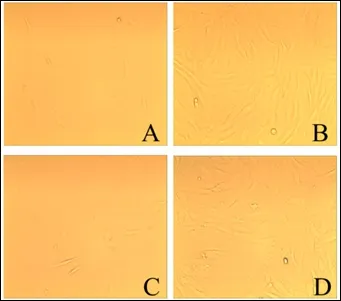
图2 肌内和皮下前体脂肪细胞的传代培养
肌内和皮下前体脂肪细胞传代后生长良好,在传代后1 d 细胞就已经变成长梭形(图2-A 和C);相比于原代培养到8 d 的状态,传代第8 天细胞长满培养瓶,其排列更加有序,没有出现重叠生长的现象(图2-B和D)。
2.2 前体脂肪细胞的生长曲线 经CCK-8 试剂盒检测,肌内与皮下前体脂肪细胞的生长曲线均呈S 型(图3),符合细胞的体外生长规律。肌内和皮下前体脂肪细胞均在3~8 d 为对数生长期,6~7 d 左右细胞密度达到80%左右,达到8 d 之后为平台期。但肌内前体脂肪细胞的生长速度在第2~4 天高于皮下前体脂肪细胞(P<0.05)。
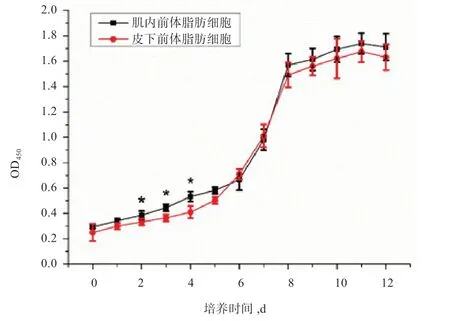
图3 前体脂肪细胞的增殖曲线
2.3 诱导分化和油红O 染色 在诱导分化前对细胞进行油红O 染色,结果表明细胞内具有少量脂质,且较为分散(图4-A 和C)。随着诱导分化培养基和维持分化培养基的加入,脂滴逐渐增多,并由分散的小脂滴逐渐变成大脂滴,脂滴占细胞的比例增大(图4-B 和D)。分化前后的细胞经油红O 染色后差异显著。

图4 肌内和皮下前体脂肪细胞油红O 染色
图5 表明,在诱导分化第2 天皮下前体脂肪细胞脂质含量高于肌内前体脂肪细胞(P<0.05),在第12 天脂质积累达到最大值。
2.4 分化相关基因的表达检测 荧光定量结果表明(图6),无论在肌内还是皮下前体脂肪细胞,PPARγ、CEBPα 基因的表达量均在第2 天达到最大值,显著高于0、4、6 d 的表达量(P<0.05)。皮下前体脂肪细胞在诱导分化LPL 基因在第2 天表达显著上调(P<0.05);而肌内前体脂肪细胞LPL 基因的表达在诱导分化的前2 d差异不显著,但两者在诱导分化过程中总体呈现表达量逐渐升高的趋势。肌内前体脂肪细胞中FAS 基因的表达量在诱导分化的第6 天显著上调(P<0.05);而在皮下前体脂肪细胞中FAS 基因在第2 天显著升高(P<0.05)。

图5 肌内和皮下前体脂肪细胞的脂质含量变化曲线
3 讨 论
本研究利用胶原酶消化方法[5]成功获得了新西兰兔肌内和皮下脂肪的前体脂肪细胞,并进行了原代和传代培养以及前体脂肪细胞诱导分化为成熟脂肪细胞,油红O 染色结果证明了诱导分化成功[6]。同时,肌内和皮下脂肪的前体脂肪细胞的诱导分化过程中脂质积累存在着差异[7],表明皮下前体脂肪细胞可能在诱导分化的前期脂质累积快于肌内前体脂肪细胞。本研究通过CCK-8 试剂绘制了细胞生长曲线,结果表明分离培养的2 种前体脂肪细胞均符合细胞的增殖规律[8],其增殖曲线均符合S 形曲线[9],说明细胞生长状态正常。

图6 肌内和皮下前体脂肪细胞分化过程中PPARγ、C/EBPα、LPL、FAS 基因表达
前体脂肪细胞分化为成熟脂肪细胞的过程中涉及转录因子PPARs、C/EBPs 等调控。PPARs 分为3 种亚型,即α、β 和γ[10]。通过下调 PPARγ,小鼠3T3-L1 前脂肪细胞向脂肪细胞分化受到明显的抑制,PPARγ 是前体脂肪细胞分化的重要标志基因,对前体脂肪细胞的分化具有正调控作用[11]。PPARγ 基因在在肌内和皮下前体脂肪细胞中的表达量均在诱导48 h 时达到最大值[12],之后表达量慢慢降低,符合前体脂肪细胞PPARγ 基因的表达规律,但对比肌内和皮下前体脂肪细胞PPARγ 基因在诱导分化后期表达趋势上的差异,说明肌内前体脂肪细胞在后期还处于分化过程中,可能是因为其分化晚于皮下前体脂肪细胞[13]。C/EBPs 家族包括C/EBPα、C/EBPβ 和C/EBPδ 等成员[14]。C/EBPα 在前体脂肪细胞分化中具有重要作用,C/EBPα 与 PPARγ 通过协调作用来影响脂肪细胞分化,对前体脂肪细胞分化具有正向调控作用,C/EBPα 基因的表达量在诱导分化的第2 天达到最大,随后表达量下降[15],与本研究结果一致。本实验中,C/EBPα 基因在肌内和皮下前体脂肪细胞中表达趋势相同。LPL 是调控脂质分解的关键基因,其生理功能是催化乳糜微粒(CM)和极低密度脂蛋白(VLDL)核心的甘油三酯(TG)分解为脂肪酸和单酸甘油酯,以供组织氧化供能和贮存,属于脂解的关键酶[16]。本实验中,肌内和皮下前体脂肪细胞LPL 基因在诱导分化前期表达趋势的差异表明,在细胞诱导分化前期肌内前体脂肪细胞的脂肪酸含量低于皮下前体脂肪细胞,意味着皮下前体脂肪细胞脂肪酸合成高于肌内前体脂肪细胞。FAS 基因编码脂肪酸合成酶,脂肪酸合成酶是一种脂肪生成酶,在脂肪酸的合成中发挥重要作用[17-18]。本实验中肌内和皮下前体脂肪细胞FAS 基因的表达趋势在诱导分化前中期呈现出差异,也表明了皮下前体脂肪细胞脂质积累快于肌内前体脂肪细胞。根据细胞的脂质积累曲线,并且结合脂质合成与分解以及分化相关基因FAS、LPL、PPARγ 在诱导分化过程中表现出的差异,分析原因在于皮下前体脂肪细胞的细胞分化和脂质积累早于肌内前体脂肪细胞。
4结 论
本研究通过胶原酶消化的方法,成功构建了新西兰兔肌内和皮下前体脂肪细胞的体外培养和诱导分化模型,且肌内和皮下前体脂肪细胞脂质积累以及PPARγ、LPL 和FAS 基因的表达趋势的差异表明皮下前体脂肪细胞分化早于肌内前体脂肪细胞。

