吐温-80增敏同步荧光法检测蔬菜中二甲菌核利残留
陈 欣,刘美欧,戴珊珊,侯瑞兰,王 琦,李月秋,杨 磊
吐温-80增敏同步荧光法检测蔬菜中二甲菌核利残留
陈 欣1,刘美欧1,戴珊珊2,侯瑞兰1,王 琦1,李月秋3,杨 磊4
(1. 河北大学 公共卫生学院,河北 保定 071000;2. 河北大学 医学院,河北 保定 071000;3. 河北大学 医学综合实验中心,河北 保定 071000;4. 保定疾病预防控制中心 理化科,河北 保定 071000)
基于表面活性剂可增强二甲菌核利荧光强度,建立同步荧光分光光度法测定蔬菜中二甲菌核利残留量。对波长差进行了优化;讨论了溶剂种类、缓冲液的种类、用量及pH值等因素对二甲菌核利荧光强度的影响;应用正交实验对提取剂种类、用量、超声时间进行优化。选择甲醇做溶剂和提取剂,质量浓度为4.29 g·L-1吐温-80做表面活性剂。在0.14~3.00 μg·mL-1范围内,二甲菌核利浓度与荧光强度线性关系良好,检出限为0.105 6 mg·kg-1,回收率为82.63~99.77%,RSD为0.16~0.61%。
二甲菌核利;吐温-80;残留;同步荧光分光光度法
杀菌剂具有杀死病菌孢子、菌丝体或抑制其发育、生长的作用[1]。二甲菌核利(Pythium)属于新型低毒杀菌剂,主要用于果蔬灰霉病的防治[2,3]。国标规定黄瓜、西红柿和韭菜中二甲菌核利最大残留限量分别为2.00 mg·kg-1和0.20 mg·kg-1[4]。
蔬菜中二甲菌核利残留量国标检测法为气相色谱-质谱联用(GC-MS)技术[5]。近年来,国内外报道的蔬菜中二甲菌核利残留量的检测方法主要有联用技术[2,5-10],高效液相色谱法(HPLC)[11]、气相色谱法(GC)[12]、电化学法[13]、近红外光谱法[3]、毛细管电泳法[9,10]、酶联免疫法[14]等。这些方法存在前处理过程繁琐,对操作人员技术要求高,易造成环境污染等问题。
荧光分析法灵敏度较紫外分光光度法高2~4个数量级[15]。同步荧光具有灵敏度高、共存组分干扰小等优点。目前,国内外鲜见增敏同步荧光法检测蔬菜中二甲菌核利残留量的报道。本研究将以探讨应用表面活性剂对二甲菌核利增敏为开端,应用正交试验对提取剂种类、用量,超声时间等因素进行筛选,建立回收率高、灵敏度好的快速同步荧光法对蔬菜中二甲菌核利残留量进行测定。
1 材料与方法
1.1 仪器与试剂
荧光分光光度计(日本岛津,RF-5301PC);超纯化水机(法国默克密理博公司Milli-Q Advantage A10);组织捣碎匀浆机(江苏金坛,JJ-2);快速混匀器(常州国华电器有限公司,SK-1);高速台式离心机(上海安亭科学仪器厂,TGL-20B);电子天平(日本岛津,AUW120D);超声波清洗器(昆山市超声仪器有限公司,RQ5200E);氮气吹干仪(中国雷尔达仪表有限公司,YQD-37A);电热恒温水浴锅(江苏省金坛市荣华仪器制造有限公司,HDM-3000B)。
80%二甲菌核利可湿性粉剂(山东海迅生物化学有限公司);磷酸氢二钠、柠檬酸、磷酸二氢钠、磷酸二氢钾、柠檬酸钠、醋酸、醋酸钠、碳酸钠、碳酸氢钠、氢氧化钠均为分析纯,购自天津科密欧化学试剂有限公司;十二烷基硫酸钠(SDS)、溴代十六烷基吡啶、吐温-20、吐温-80均为分析纯,均购自上海麦克林生化科技有限公司;实验用水为二次去离子水。
1.2 试验方法
1.2.1 二甲菌核利标准储备液制备
准确称取0.062 5 g 80%的二甲菌核利可湿性粉剂溶于甲醇,定容至50 mL,配成1.00 mg·mL-1二甲菌核利标准溶液,继而稀释成1.00 μg·mL-1,用0.45 μm微孔滤膜过滤,置于冰箱中冷藏保存备用。
1.2.2 样品预处理
将2.00 g样品捣碎匀浆,抽滤,得样品溶液,用0.45 μm微孔滤膜过滤,置于10 mL离心管中,加入1.00 g氯化钠,6 mL甲醇,漩涡混匀,超声10 min,5 000 r·min-1离心10 min,氮吹仪浓缩干燥至1 mL。向甲醇浓缩液中加入1 mL 吐温-80溶液(10.00 g·L-1),1 mL磷酸氢二钠-柠檬酸缓冲液(pH=6),漩涡混匀,室温反应10 min。
1.2.3 样品测定
以1 cm石英比色皿作吸收池,起始激发波长(λx)为283 nm,发射波长(λm)为343 nm,Δλ为60 nm,激发、发射狭缝宽度为3 nm条件下同步扫描测定1.2.2节中制备的样品溶液的荧光强度。
2 结果与分析
2.1 荧光测定条件选择
2.1.1 溶剂选择
分别配制10.00 μg·mL-1的二甲菌核利水溶液、5.00 μg·mL-1的二甲菌核利甲醇溶液以及50.00 μg·mL-1的二甲菌核利丙酮溶液,于283 nm激发波长处测定荧光强度。实验测得荧光强度分别为416、590、157,表明5.00 μg·mL-1二甲菌核利甲醇溶液荧光强度最大。由于二甲菌核利甲醇溶液中二甲菌核利浓度最小,而荧光强度最大,因此选择甲醇为二甲菌核利的溶剂。
2.1.2 同步荧光分光光度法条件选择
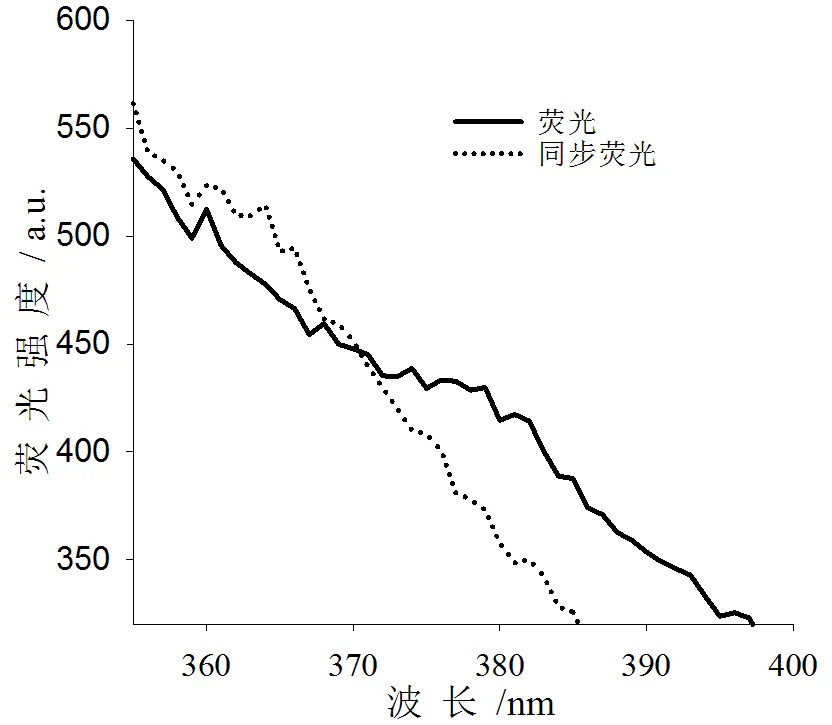
图1 荧光与同步荧光光谱图
固定其他条件,设定起始激发和发射波长,在波长差Δλ分别为30、40、50、60、70、80、90 nm的条件下测定二甲菌核利荧光强度。由测定结果可知,随着波长差Δλ增加,荧光强度呈现先增加后减弱趋势,在Δλ=60 nm时,荧光强度达到最大值,因此选择Δλ=60 nm。荧光扫描和同步荧光扫描光谱图(见图1),由图可知,同步荧光扫描可以使二甲菌核利溶液荧光强度增强,使峰形变窄,可减少共存物质干扰,提高灵敏度。
2.1.3 pH选择
在其他条件一定情况下,讨论了不同pH值磷酸氢二钠˗柠檬酸缓冲溶液(pH=2.20、3.40、4.00、5.00、6.00、7.00、8.00、9.40、10.83)对质量浓度为5.00 μg·mL-1二甲菌核利甲醇溶液荧光强度的影响。结果表明:在pH=6.00时,二甲菌核利甲醇溶液荧光强度最高(见图2),故选择pH=6.00的磷酸氢二钠-柠檬酸缓冲溶液。
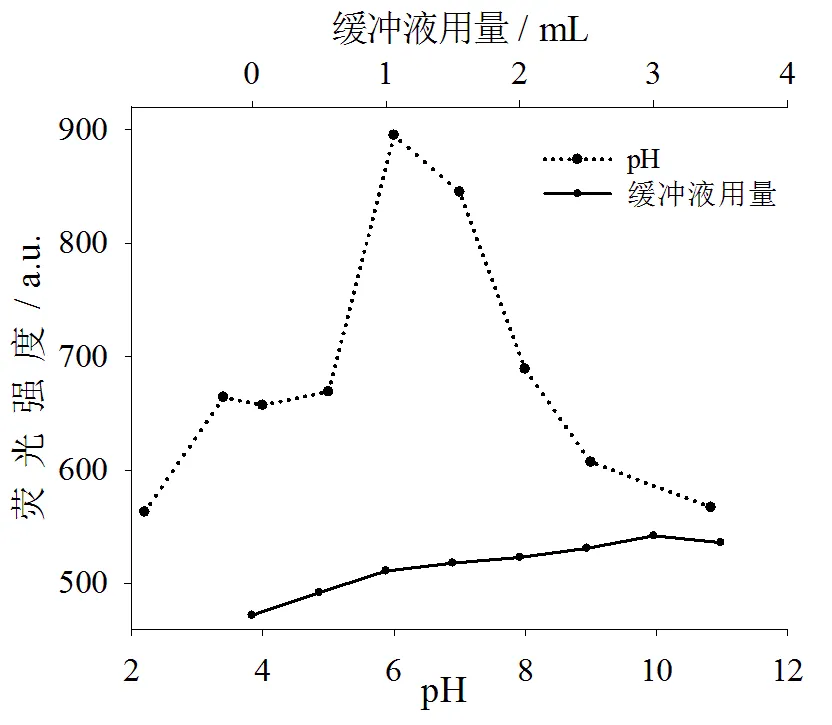
图2 pH和缓冲液用量对二甲菌核利荧光强度影响
2.1.4 缓冲液种类选择
在其他条件一定的情况下,讨论不同种类缓冲溶液(pH=6.00)即磷酸氢二钠-柠檬酸,磷酸氢二钠-磷酸二氢钠,磷酸氢二钠-磷酸二氢钾对5.00 μg·mL-1二甲菌核利甲醇溶液荧光强度影响,实验测得荧光强度分别为632、556、598。结果表明:加入磷酸氢二钠-柠檬酸缓冲溶液时二甲菌核利荧光强度最高,故选择磷酸氢二钠-柠檬酸为缓冲溶液。
2.1.5 缓冲溶液用量选择
其他条件一定,讨论了加入不同量(0.0、0.5、1.0、1.5、2.0、2.5、3.0、3.5 mL)磷酸氢二钠-柠檬酸缓冲液(pH=6.00)对二甲菌核利甲醇溶液荧光强度影响。结果表明:随着缓冲溶液加入量增加,二甲菌核利荧光强度也随之增加(见图2),因此缓冲溶液用量增高可以使增敏效果增加,故实验选择添加3.00 mL磷酸氢二钠-柠檬酸缓冲溶液(pH=6.00)。
2.1.6 表面活性剂选择
选择合适的表面活性剂及其浓度(≥临界胶束浓度)时,可以将被测分子包裹于胶束内,使其避免因碰撞而发生无辐射去激,从而可提高荧光物质的荧光强度。因此,其他实验条件一定的情况下,考察了不同种类表面活性剂(溴代十六烷基吡啶、吐温-80、吐温-20、SDS)对荧光强度影响。结果表明:吐温-80使荧光强度明显增强,SDS、溴代十六烷基吡啶等使荧光强度减弱(见图3)。故实验选择加入吐温-80。
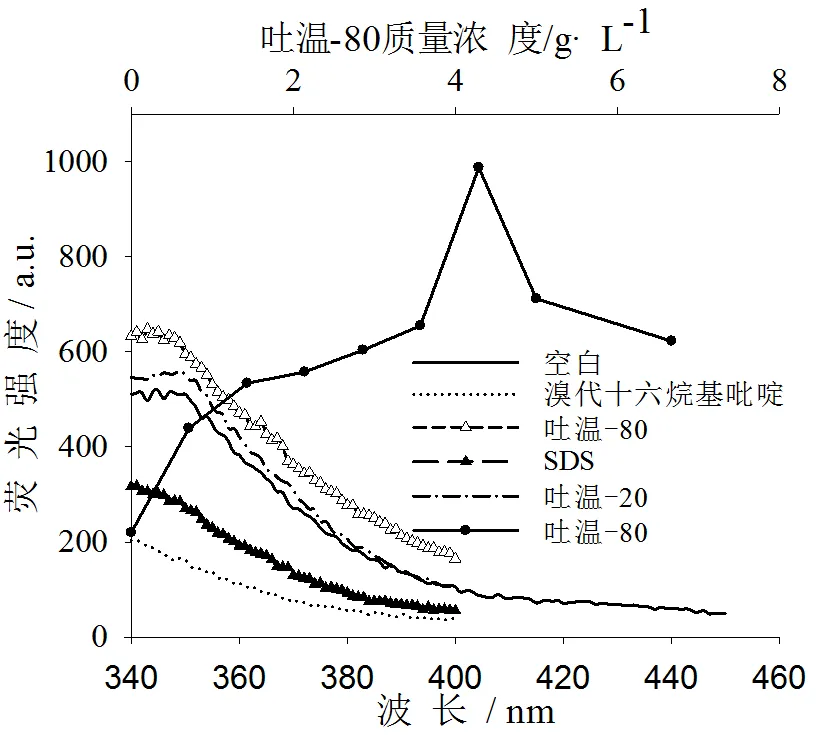
图3 表面活性剂种类及吐温-80质量浓度对荧光强度影响
2.1.7 吐温-80用量选择
表面活性剂对荧光强度的影响与表面活性剂浓度有关。实验中考察了加入不同质量浓度的吐温-80(0.00、0.71、1.43、2.14、2.86、3.57、4.29、5.00、6.67 g·L-1)对二甲菌核利增敏效果影响。随着吐温-80浓度增加,二甲菌核利甲醇溶液荧光强度先逐渐增强后下降,在加入质量浓度为4.29 g·L-1的吐温-80时二甲菌核利荧光强度达到峰值(见图3)。故实验选择加入浓度为4.29 g·L-1的吐温-80溶液。
2.1.8 待测液温度选择
按照实验方法准备好待测溶液,分别处置为不同测定温度(0、20、25、40、50、60 ℃),考察溶液温度对二甲菌核利荧光强度影响。结果表明:温度对二甲菌核利荧光强度影响较小,故选择室温条件下测定。
2.1.9 样品前处理正交试验设计
果蔬样品中二甲菌核利回收率主要受提取剂种类、提取剂用量,超声时间等影响。故实验中,以提取剂种类(A)、提取剂用量(B)、超声时间(C)为影响因素,每个因素设置3个水平,设计正交试验(见表1)。

表1 正交试验因素水平表
本研究需要考虑因素A与B、C之间的交互作用,即A×B、A×C;选择L27(313)交互作用表安排实验方案。使用SPSS19.0对数据进行分析,结果表明提取剂用量和超声时间对提高回收率有统计学意义(p﹤0.05),见表2。
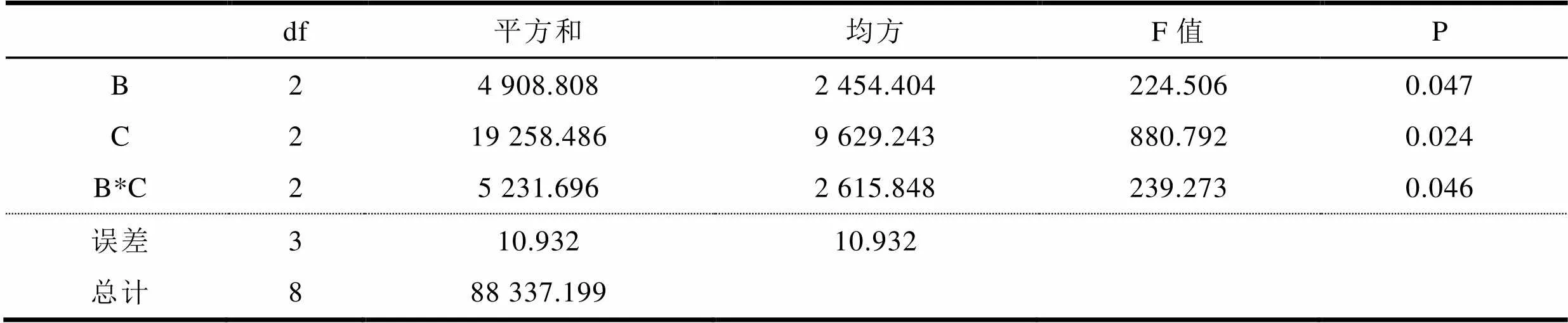
表2 方差分析表
综合分析,最优实验方案为用甲醇作提取剂,用量为6 mL,超声10 min。
2.2 方法学建立
2.2.1 标准曲线及检出限
取标准储备液各一定体积,向其中分别加入1 mL吐温-80溶液(质量浓度10.00 g·L-1),1 mL磷酸氢二钠-柠檬酸缓冲液(pH=6),漩涡混匀,分别定容至一定体积,配制成标准系列溶液,并按照1.2.3中实验方法进行测定。以二甲菌核利浓度为横坐标(),荧光强度为纵坐标(),建立标准曲线。结果表明:在0.14~3.00 μg·mL-1范围内,二甲菌核利浓度与其荧光强度呈良好线性关系。标准曲线回归方程为:
=27.629 0-4.916 6(相关系数r=0.992 0)。
根据IUPAC(3δ)[16]规定,向11份空白溶液中加入1 mL吐温-80溶液(10.00 g·L-1),1 mL磷酸氢二钠-柠檬酸缓冲液(pH=6),漩涡混匀,由=3×δ/(为检出限,为标准曲线斜率,为11份空白溶液荧光强度标准偏差),求出检出限为0.105 6 mg·kg-1。
2.2.2 稳定性
测定静置不同时间(0、0.5、1、2、4、8、12、24 h)二甲菌核利荧光强度变化,经计算RSD=0.60%,表明二甲菌核利在24 h内稳定性良好。
2.2.3 回收率及精密度
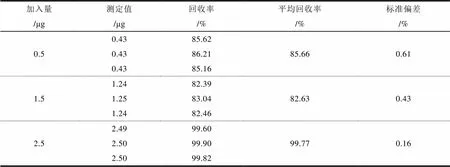
表3 平均回收率及相对标准偏差(n=3)
取市售西红柿匀浆9份,每份2.00 g,等分为三组,每组各加入1 mL浓度为0.50 μg·mL-1、1.50 μg·mL-1、2.50 μg·mL-1二甲菌核利甲醇溶液,按照1.2.2节的方法处理,按照1.2.3的实验条件测定,将测得的结果按下述公式计算回收率:
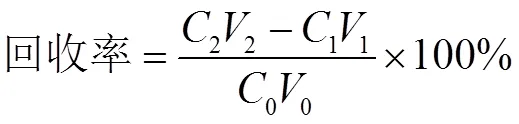
式中,2代表加标样品测试值(μg·mL-1),2代表加标样品体积(mL),1代表未加标样品测试值(μg·mL-1),1代表未加标样品体积(mL),0代表加入标准溶液浓度(μg·mL-1),0代表加入标准溶液体积(mL)。
平均回收率和相对标准偏差见表3。
2.3 样品测定
按照1.2.2样品处理方法,按照1.2.3样品测定方法对保定市菜市场出售的西红柿、黄瓜、韭菜样品分别进行了检测,每个样品重复测定3次。仅黄瓜中测得二甲菌核利残留量为2.10 μg/g(RSD=3.00%),其余蔬菜、水果中均未检测到二甲菌核利残留。
3 结论
本研究探索建立了用吐温-80增敏,蔬菜水果中二甲菌核利残留量同步荧光检测方法,该方法选择性好、精密度高、稳定性好、仪器设备简单;检出限为0.105 6 mg·kg-1,能满足国家标准中规定的水果蔬菜允许的最大残留限量[4]。此方法的缺点是回收率相对较低,可进一步探索建立液液微萃取、离子液体等先进的样品前处理方法以进一步提高回收率。
本研究建立的方法可以作为蔬菜水果中农药残留检测新方法,可推广于有关部门进行日常跟踪检测。
[1] 朱良天.农药(精细化工产品手册)[M].北京:化学工业出版社,2004:233.
[2] 张群,吴南村,张月,等.气相色谱-串联质谱法测定韭菜中的三唑酮和腐霉利残留[J].农药学学报,2016,18(3): 397-401.
[3] 孙通,莫欣欣,李晓珍,等.近红外光谱技术结合变量选择方法定性检测食用植物油中的腐霉利[J].光谱学与光谱分析,2016,36(12):39153919.
[4] 食品中农药最大残留限量(GB2763-2016)[S].北京:中国标准出版社,2017.
[5] 水果和蔬菜中500种农药及相关化学品残留量的测定气相色谱-质谱法(GB23200.8-2016)[S].北京:中国标准出版社,2017.
[6] Araujo E A, Lara M C R, Reis M R D, et al. Deter- mination of Haloxyfop-Methyl, Linuron, and Pro- cymidone Pesticides in Carrot Using SLE-LTP Extraction and GC-MS[J]. Food Anal. Methods, 2016, 9(5): 1344-1352.
[7] Chu S P, Tseng W C, Kong P H, et al. Up-and-Down- Shaker-Assisted Dispersive Liquid-Liquid Micro- extration Coupled with Gas Chromatography-Mass Spectrometry for the Determination of Fungicides in Wine[J]. Food Chemistry, 2015, 185: 377-382.
[8] 胡祥娜,顾亚萍,林慧纯,等.高效液相色谱串联四极杆质谱法同时测定豆芽中7种药物残留[J].食品科学, 2014,35(20):253-257.
[9] Juan-Garcia A, Font G, Pico Y. Quantitative Analysis of Six Pesticides in Fruits by Capillary Electrophoresis Electrospray-Mass Spectrometry[J]. Electrophoresis, 2005, 26(7-8): 1550-1561.
[10] Rodiguez R, Pico Y, Font G, et al. Analysis of Thiabendazole and Procymidone in Fruits and Vegetables by Capillary Electrophoresis-Electrospray Mass Spectrometry[J]. Journal of Chromatography A, 2002, 949(1-2): 359-366.
[11] Tuzimski T, Rejczak T. Determination of Pesticides in Sunflower Seeds by High-Performance Liquid Chromatography Coupled with a Diode Array Detector[J]. J AOAC Int, 2014, 97(4):1012-1020.
[12] Xu Z, Huan Z B, Luo J H, et al. Simultaneous Determination of Eight Pesticide Residues in Cowpeas by GC-ECD[J]. J Chromatogr Sci, 2017, 55(1): 1-6.
[13] Fulgencio A C D C, Saczk A A, Oliveira M F D, et al. New Voltammetry-Based Analytical Method for Indirect Determination of Procymidone in Brazilian Apples[J]. Food Anal Methods, 2014, 7(1): 31-38.
[14] Frenandez-Albaa R, Valverde A, Aguera A, et al. Determination of Procymidone in Vegetables by a Commercial Competitive Inhibition Enzyme Immuno- assay[J]. Analytica Chimica Acta, 1995, 311(3): 371-376.
[15] 刘宇.仪器分析[M].天津:天津大学出版社,2010:137.
[16] 齐畅,刘美欧,杨珊珊,等.分散液相微萃取荧光法测定果蔬中残留吡蚜酮[J].农药,2017,56(6):434-436.
Determination of Pythium Residues in Vegetables by Tween-80 Sensitized Synchronous Fluorescence
CHEN Xin1, LIU Mei-ou1, DAI Shan-shan2, HOU Rui-lan1, WANG Qi1, LI Yue-qiu3, YANG Lei4
(1. School of Public Health, Hebei University, Baoding 071000, China; 2. College of Medicine, Hebei University, Baoding 071000, China; 3. Center of Medical Comprehensive Experiment, Hebei University, Baoding 071000, China; 4. Science and Technology Section, Baoding Center for Disease Control and Prevention, Baoding 071000, China)
Synchronous fluorescence method for determining pythium residues in vegetables based on surfactants sensitization was developed. The wavelength difference (Δλ) was selected. The effect of the solvent type, the type and amount of buffer, pH on the fluorescence intensity was discussed. The type and dosage of the extractant, the ultrasonic time were optimized by orthogonal test. Methanol was used as solvent and extractant. Tween-80 (4.29 g·L-1) was used as the surfactant. In the range of 0.14 to 3.00 μg·mL-1, the linear relationship between the concentration of pythium and its fluorescence intensity was good, and the detection limit was 0.105 6 mg·kg-1. The recovery were 82.63 to 99.77%, RSD was 0.16 to 0.61%. The new method can be used to determine pythium residues in vegetables.
pythium; tween-80; residues; synchronous fluorescence
s-3
A
1009-9115(2019)03-0067-05
10.3969/j.issn.1009-9115.2019.03.019
河北省科技计划自筹经费项目(15275511)
2019-02-18
2019-03-05
陈欣(1997-),女,满族,河北唐山人,本科生,研究方向为检验与检疫。
(责任编辑、校对:琚行松)

