低功率微波对人正常及脂多糖诱导的牙周膜细胞增殖的影响
谢文泵 庄文捷 黄璇叶
【摘要】 目的:探討微波辐照对人牙周膜细胞增殖的影响。方法:运用微波理疗仪(输出功率调节为14 W)以连续波、垂直极化照射方式对人牙周膜细胞行微波辐射(频率2 450 MHz),24、48 h后MTS法检测人牙周膜细胞(hPDLCs)增殖效应。结果:微波辐照对健康hPDLCs增殖效应影响,微波照射24、48 h后,照射40 s组,实验组中吸光度值(OD值)低于对照组(P<0.01);微波辐照对炎症hPDLCs增殖效应影响,微波照射24、48 h后,照射10、20、40 s组,实验组中吸光度值(OD值)都低于对照组(P<0.01)。结论:长时间(40 s)低功率微波辐照健康人牙周膜细胞能明显抑制正常牙周膜增殖,促进细胞凋亡。低功率微波照射10、20、40 s对炎性的人牙周膜细胞的增殖均具有明显抑制作用,随着微波辐射强度的增高对其增殖抑制率也愈大,呈现明显的剂量依赖性。低功率微波照射时间为10~20 s时能抑制炎症人牙周膜细胞过度增殖,又不影响人健康牙周膜细胞的增殖。
【关键词】 低功率微波; 牙周膜细胞; 内毒素脂多糖; 细胞活力测定; 增殖效应
doi:10.14033/j.cnki.cfmr.2019.08.080 文献标识码 B 文章编号 1674-6805(2019)08-0-03
Effects of Low Power Microwave on Proliferation of Human Normal and Lipopolysaccharide Induced Periodontal Ligament Cells/XIE Wenbeng,ZHUANG Wenjie,HUANG Xuanye.//Chinese and Foreign Medical Research,2019,17(8):-167
【Abstract】 Objective:To investigate the effect of microwave irradiation on the proliferation of human periodontal ligament cells.Method:Human periodontal ligament cells were exposed to microwave radiation(frequency 2 450 MHz) with microwave physiotherapeutic apparatus(output power adjusted to 14 W) under continuous wave and vertical polarization.The proliferation of (hPDLCs) in human periodontal ligament cells was detected by MTS method after 24 h or 48 h.
Result:The effects of microwave irradiation on the proliferation of healthy hPDLCs were observed.The absorbance(OD) value of the experimental group for 40 s was lower than that of the control group(P<0.01) after 24 h and 48 h of microwave irradiation.The effects of microwave irradiation on the proliferation of inflammatory hPDLCs were observed.The value of absorbance(OD) in experimental group for 10 s,20 s,40 s were lower than those in the control group(P<0.01).
Conclusion:Human periodontal ligament cells irradiated by low power microwave for a long time(40 s) can significantly inhibit the proliferation of normal periodontal ligament and promote the apoptosis of human periodontal ligament.Low power microwave irradiation for 10 s,20 s,40 s can significantly inhibit the proliferation of inflammatory human periodontal ligament cells.With the increase of microwave radiation intensity,the inhibition rate of the proliferation of periodontal ligament cells is increased in a dose-dependent manner.Low power microwave irradiation for 10-20 s can inhibit the excessive proliferation of inflammatory human periodontal ligament cells without affecting the proliferation of healthy human periodontal ligament cells.
【Key words】 Low-power microwave; Periodontal ligament cells; Lipoplysaccharide; Cell viability assay; Proliferation effect
First-authors address:Peoples Hospital Affiliated to Quanzhou Medical College,Quanzhou 362000,China
牙周病是由多种致病微生物所致的慢性、间歇性非特异性感染性疾病,临床上对牙周病尚无完善的、特效的治疗方案。人牙周膜细胞(human periodontal ligament cells,hPDLCs)是牙周组织中的主要细胞成分,不仅合成、分泌牙周膜基质中胶原纤维和蛋白多糖,还有降解胶原的能力。它是一类具有异质性及分化潜能的细胞,主要细胞成分包括成纤维细胞、未分化的间充质细胞及前体细胞。许多研究都证实在病理状态或受到外界刺激下,细胞可被激活,增殖分化,可分化为成骨细胞和成牙骨质细胞,促进牙周组织的再生和修复[1-2]。研究表明细胞内毒素脂多糖(1ipopolysacchaddes,IJPS)可抑制hPDLCs的增殖,促使牙周膜细胞大量分泌TNF-α、IL-6、IL-8等炎症因子,是导致牙周炎发病的主要致病因素[3-4]。目前,利用人牙周膜细胞建立体外模型[5-6],已成为研究牙周膜组织疾病的重要手段。
近年来,微波技术在医学临床上应用日趋广泛,有学者利用微波局部治疗牙周炎和边缘性龈炎,取得一定疗效[7-8]。低功率微波能改善局部血液循环,增强代谢过程,加强局部组织营养,并且它具有较强的抑菌作用,渗入深度大,能抑制或杀灭患部的细菌。将微波能量集中照射病变部位,被人体组织吸收后,產生微波热效应、生物效应等,使局部组织温度升高,动静脉显著扩张,血流速度和血循环量明显增加,活血化瘀,促进血液循环,增加细胞膜通透性,使局部代谢及营养状态得以良好改善,提高组织再生能力,促进局部炎症消退[9]。本研究通过检测hPDLCs受到低功率微波刺激后MTS法检测hPDLCs增殖效应表达,探索低功率微波对人正常及脂多糖诱导的牙周膜细胞增殖的影响,为微波治疗牙周炎提供理论依据。
1 材料与方法
1.1 主要器材和试剂
低糖DMEM培养基、胎牛血清(FBS)胰蛋白酶(GIBCO,USA),青-链霉素混合液(Hyclone,美国),MTS(Promega,美国),二甲基亚砜(DMSO)、脂多糖(sigma,USA),微波治疗仪(新技术研究所,南京),酶联免疫检测(Biotek POWERWAVE,美国),倒置相差显微镜及摄像系统(NikonTS-100,日本)。
1.2 标本取材及原代培养
征求患者及家长同意,取12~17岁因正畸治疗而拔除的健康前磨牙10例。术前患者用3%过氧化氢漱口,75%的酒精消毒口内及口周,拔牙过程中避免损伤牙周组织,拔牙后立即置于含双抗(青霉素100 U/ml,链霉素100 μg/ml)的无菌PBS液中,在超净台内,用含双抗的PBS液反复冲洗牙根面,除去血污,用手术刀片刮取根中1/3牙门周膜组织,在DMEM培养液浸润条件下用眼科剪将牙周组织剪成1 mm3大小的组织块。取6孔板,在每孔中央滴加少量含200 ml/L的胎牛血清、100 U/ml青霉素和100 μg/ml链霉素的DMEM培养液,用牙科镊子将组织块放入6孔板中的培养液中,每孔含5~6小组织块。将高压灭菌盖玻片缓缓覆盖于组织块上,轻轻加压,使培养液充盈于盖玻片与组织块之间,避免产生气泡,加体积分数为10%的胎牛血清的DMEM培养液3 ml,置5%CO2,100%湿度的37 ℃细胞培养箱培养,每3天换液1次。第2天镜下观察组织块有无细菌污染,细胞培养板要轻拿轻放,前3天尽量避免过多晃动培养板,此后在倒置显微镜下逐日观察细胞游出情况、形态特征及生长状况。
待组织块周围细胞生长密集后,需要进行原孔消化。弃旧培养液用PBS缓冲液轻轻漂洗2遍,无菌镊子小心取出盖玻片,滴加少量2.5 g/L的胰蛋白酶,使其刚好铺满板底。镜下观察细胞消化情况,当细胞质回缩变圆,细胞间隙变大时,弃胰酶,加体积分数为10%胎牛血清的DMEM培养液3 min,终止消化。轻轻吹打,使细胞均匀分布于孔板内,换培养箱继续培养。
1.3 细胞传代培养
原孔消化后,待细胞生长达孔板底部表面积80%~90%时,进行传代培养。
1.4 微波照射方法及分组
将第4代hPDLCs分为两大组,其中健康牙周膜细胞组正常接种,而炎症牙周膜细胞组加入含10 μg/ml的LPS的培养基进行诱导。分别按2×104个/ml的细胞密度接种于96孔板,每板分空白组、对照组和实验组,空白组为不含细胞的DMEM培养液,其余两组接种细胞,每组重复3孔,每孔接种100 μl,微波治疗仪输出模式为治疗模式,输出功率调节为14 W,实验组照射时间分别为10、20、40 s。对照组不进行激光照射,其余条件同实验组,微波照射通过96孔板板盖照射,室温为24 ℃。
照射后放回培养箱中继续培养。
1.5 MTS法检测hPDLCs增殖效应
MTS是一种用比色法来检测细胞增殖和细胞毒实验中的活细胞数量的检测试剂。微波照射24、48 h后,分别取出相应孔板,每孔加MTS 20 μl,继续培养4 h后终止培养,在酶标仪490 nm波长处测定各孔细胞吸光度值(OD值)。
1.6 统计学处理
采用SPSS 13.0统计学软件进行数据处理,计量资料数据以(x±s)表示,组间比较用单因素方差分析,两组间差异用成组t检验,检验水准=0.05,P<0.05为差异有统计学意义。
2 结果
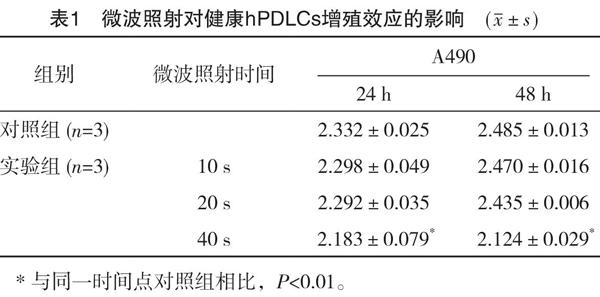
2.1 微波辐照对健康hPDLCs增殖效应影响
微波照射24 h后,实验组中辐照10 s和20 s同对照组相比,OD值差异无统计学意义(P>0.05),而照射40 s组,其OD值明显低于对照组;照射48 h后,实验组中40 s的OD值亦低于对照组,二者比较差异有统计学意义(P<0.01),见表1。
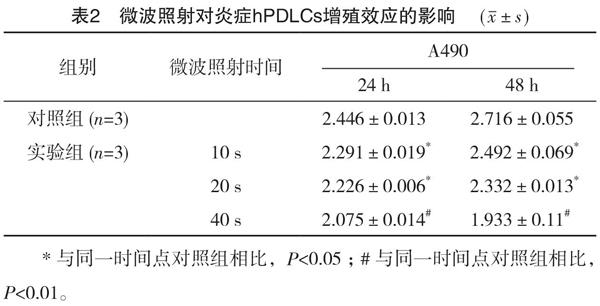
2.2 微波辐照对炎症hPDLCs增殖效应影响
微波照射24 h后,实验组同对照组相比,OD值显著低于对照组(P<0.05),呈剂量依赖性;照射48 h后,实验组OD值低于对照组,二者比较差异有统计学意义(P<0.05);但不同时间点实验组两者间差异无统计学意义(P>0.05),见表2。
3 讨论
微波治疗是将微波能量集中照射作用部位,被人体组织吸收后产生热效应、生物效应等。微波的热效应能够达到杀菌作用且随着功率的增大而杀菌作用增强,但对靶器官和邻近组织、细胞损伤的可能性也随之增大。选择适宜功率的微波照射使其热效应不足以破坏正常的细胞,又能通过其生物效应作用于靶组织使其达到调节功能,促进组织功能恢复的作用是研究的最终目的。本研究选择低功率14 W的微波辐照健康人牙周膜细胞10、20 s,对正常牙周膜细胞增殖没有影响,而辐照时间延长为40 s时就能明显抑制正常牙周膜增殖,这种抑制作用一直延续到48 h仍然存在,提示临床使用微波必须选择好功率和时间,以免过强的热效应损伤正常组织细胞;细菌产生的脂多糖LPS是牙周炎的诱发因素之一[10-12]。本研究根据Jung等[13-14]的实验结果选择10 μg/ml LPS诱导人正常牙周膜细胞模拟炎症状态下的牙周膜细胞,结果显示14 W微波照射10、20、40 s对炎性的人牙周膜细胞的增殖均具有明显抑制作用,随着微波辐射强度的增高对其增殖抑制率也愈大,呈现明显的剂量依赖性。早在20世纪70年代web等[15]对人正常细胞和癌细胞的微波频谱进行研究发现,正常细胞和癌细胞的吸收频谱有差异,微波能通过热效应和非热效应选择性地杀伤肿瘤细胞,引起细胞形态学和功能学改变,导致细胞坏死或者诱导凋亡。因此笔者设想健康的牙周膜细胞和炎症状态的牙周膜细胞对微波的吸收频谱也是有差异的。
总之,本实验结果得出临床上选择14 W低功率微波照射时间为10~20 s时能抑制炎症人牙周膜细胞过度增殖,又不影响人健康牙周膜细胞的增殖。
参考文献
[1] Zheng L,Chen L,Chen Y,et al.The effects of fluid shear stress on proliferation and osteogenesis of huma periodontal ligament cells[J].J Biomech,2016,49(4):572-579.
[2] Heng N H,Zahlten J,Cordes V,et al.Effects of enamel matrix derivative and transforming growth factor—βl on connective tissue growth factor in human periodontal ligament fibroblasts[J].J Periodntol,2015,86(4):569-577.
[3]丁刚,孙婷,魏立梅.脂多糖对牙周膜干细胞生物学特性的影响[J].中华生物医学工程杂志,2014,20(6):418-422.
[4]李晶,周伟,袁伟明,等.不同浓度脂多糖对大鼠肠上皮细胞增殖和白细胞介素-6、白细胞介素-1β及肿瘤坏死因子-α分泌的影响[J].中华实用儿科临床杂志,2015,30(7):490-493.
[5]王冠华.牙周膜干细胞培养及鉴定方法的研究进展[J].医学理论与实践,2014,7(3):869-870,873.
[6]贾凌璐,文勇,徐欣.体外培养环境影响牙周膜干细胞生物学特性的研究进展[J].国际口腔医学杂志,2018,3(6):255-260.
[7]范业惠,孙海军,王永中,等.低功率微波治疗边缘性牙周炎.中国疗养医学,2000,9(2):15-16.
[8]种明嫒.微波治疗牙周炎86例[J].中华理疗杂志,2000,23(3):165.
[9]張利,胥爱文,谢丽娟,等.微波对慢性牙周炎病人龈沟液中天冬氨酸转氨酶的影响[J].北京口腔医学,2009,17(1):42-44.
[10]黄飞,丁洁,张明烨,等.脂多糖对人牙周膜干细胞增殖及炎症因子表达的影响[J].牙体牙髓牙周病学杂志,2017,2(4):86-88,110.
[11]荆冉,郭大伟,廖弈翔,等.人牙周膜成纤维细胞凋亡与体外高糖环境和脂多糖的交互作用[J].中国组织工程研究,2017,4(8):551-558
[12] Chiu H C,Fu M M,Yang T S,et al.Effect of high glucose,Porphyromonas gingivalis lipopoiysaccharide and advanced glycation end-products on production of interleukin-6/-8 by gingival fibroblasts[J].J Periodontal Res,2017,52(2):268-276.
[13] Jung-Chang Lee,Mi-kyung Yu,Rin Lee,et al.Terrein reduces pulpal inflammation in human dental pulp cells[J].J Endod,2008,34(4):433-437.
[14] Jae-Cheol Kim,Young-Hee Lee,Mi-kyung Yu.Anti-inflammatory mechanism of PPARγ on LPS-induced pulp cells:Role of the ROS removal activity[J].Archives of Oral Biology,2012,57(4):392-400.
[15] Web S J,Booth A D.Microwave Absorption by Normal and Tumor Cells[J].Science,1971,174(4004):72-74.

