呼吸道九联检与七联检在500例患者中的检测结果分析
谷 雷,谷 峰,陈璐璐,解燕川,李武威,齐媛媛,李晶晶△
(河南科技大学临床医学院/河南科技大学第一附属医院:1.中心实验室;2.颌面外科;3.检验科,河南洛阳 471000)
呼吸道感染包括上呼吸道和下呼吸道感染,下呼吸道感染多由上呼吸道感染不规范治疗,久治不愈迁延所致。多发于小儿及老年人,严重影响小儿身心健康及成长,给对老年人生活也带来诸多不便。90%以上呼吸道感染由病毒引起,其中甲型流感病毒(IFVA),乙型流感病毒(IFVB),腺病毒(ADV),呼吸道合胞病毒(RSV),副流感病毒1、2、3型(PIVI 、PIV2、PIV3)最为常见[1]。目前,实验室对呼吸道感染的检测方法主要有2种[2]:一是采集静脉血血清中病原体特异性抗体IgM检测(九联检);二是采集鼻咽部分泌物脱落细胞病毒抗原检测(七联检)。2种检测方法均可以同时检测多种病原,快速准确,为临床诊断节省时间,减少没有针对性的盲目用药率。为探讨2种检测方法在临床实验室的实际应用价值,本研究小组对本院500例呼吸道感染患者同时进行九联检与七联检,并对检测结果进行统计分析,现报道如下。
1 资料与方法
1.1一般资料 选取2017年10月至2018年3月于本院就诊的500例呼吸道感染患者为研究对象,分别来自儿科、呼吸内科及血液科。其中男326例,女174例。年龄1~12岁456例,平均(3.96±2.57)岁;13~18岁6例,平均(13.17±2.16)岁;>18岁38例,平均(59.62±5.14)岁。所选患者均具有呼吸道感染的临床症状及体征,由临床医生根据相关诊断标准诊断为呼吸道感染[3]。
1.2研究方法
1.2.1检测方法 同时采用九联检和七联检对患者进行检测,九联检使用间接免疫荧光法(IFA),检测项目包括嗜肺军团菌(LP)、肺炎支原体(MP)、Q热立克次体(COX)、肺炎衣原体(CP)、IFVA、IFVB、ADV、RSV、PIV1、PIV2、PIV3。七联检采用直接免疫荧光法(DFA),检测项目包括IFVA、IFVB、ADV、RSV、PIV1、PIV2、PIV3。
1.2.2标本采集 (1)采用无菌真空干燥采血管采集患者静脉血2 mL。(2)采用专用无菌咽拭子采集鼻咽部分泌物含鼻咽部脱落细胞。
1.2.3标本处理 严格按照试剂盒说明书进行操作。(1)静脉血2 mL,3 500 r/min,离心10 min,用PBS对血清进行1∶1稀释,取透明干燥试管1支,依次加入100 μL PBS缓冲液,100 μL血清,充分混匀。用吸附剂对稀释后的样本进行吸附,取透明干燥试管1支,依次加入150 μL吸附剂,30 μL稀释后的样本血清,充分混匀,3 000 r/min,离心10 min。制片,取1张包被有病原体抗体的载玻片,每孔依次加入15 μL处理过的上清,前9孔依次为LP、MP、COX、CP、ADV、RSV、IFVA、IFVB、PIV1、PIV2和PIV3,第10孔为质控孔。放入湿盒,37 ℃水浴箱孵育90 min。洗片,用PBS缓冲液流水缓慢冲洗孵育后的载玻片,然后用PBS缓冲液浸泡5 min(摇床摇动)。加异硫氰酸荧光素(FITC)结合物,用吸水纸将载玻片四周吸干,自然晾干,每孔依次加入15 μL FITC结合物,放入湿盒,37 ℃水浴箱孵育30 min。用PBS缓冲液缓慢冲洗孵育后的载玻片,然后浸泡5 min(摇床摇动)。封片,用吸水纸将载玻片四周吸干,自然晾干,每孔依次加入封片介质,加盖盖玻片[4]。(2)采集后的咽拭子,加入2 mL标本采集液,采集刷头与采集液充分混匀,漩涡震荡1 min,弃刷头,3 000 r/min,离心10 min,弃上清,加入2 mL细胞保存液,充分混匀,漩涡震荡1 min,3 000 r/min,离心10 min,弃上清,留200 μL于管底,用加样枪吹打混匀,制成细胞悬液。制片,取专用8孔载玻片1张,每孔依次加入25 μL细胞悬液,40 ℃下将玻片风干,4 ℃下丙酮固定5 min,每孔依次加25 μL抗体与FITC的结合物,前7孔依次为IFVA、IFVB、ADV、RSV、PIV1、PIV2和PIV3,第8孔为空白对照孔。放入37 ℃温箱孵育15 min。洗片,用PBS缓冲液流水冲洗2遍,将剩余的FITC结合物洗掉,40 ℃下将玻片风干。封片,每孔依次加入封片介质,加盖盖玻片。
1.2.4荧光显微镜观察结果[5]分别将制好且封片的呼吸道九联检与七九联检的载玻片置于荧光显微镜载物台上,调整荧光显微镜至400×,观察结果。
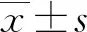
2 结 果
2.1九联检和七联检2种检测方法的结果比较 呼吸道九联检对不同病原体的检测阳性率依次为LP(0.40%),MP(23.60%),COX(0.06%),CP(0.20%),ADV(4.60%),RSV(3.00%),IFVA(15.00%),IFVB(13.00%),PIV1、PIV2、PIV3(7.00%)。七联检对不同病原体的检测阳性率依次为IFVA(26.00%),IFVB(17.00%),ADV(5.20%),RSV(24.60%),PIV1(0.06%),PIV2(5.60%),PIV3(7.60%)。PIV1、PIV2、PIV3的总体阳性率为12.60%。其中九联检和七联检2种检测方法均包含的5类病原微生物的检测阳性率结果比较,见表1。

表1 九联检和七联检对不同病原体的检测阳性率结果比较[n(%)]
注:两组方法同时检测RSV,结果比较χ2=96.245,P<0.05;同时检测IFVA,结果比较χ2=17.892,P<0.05;同时检测PIVI 、PIV2、PIV3,结果比较χ2=8.247,P<0.05
2.2九联检和七联检2种检测方法的阳性符合率 九联检与七联检的检测结果进行比较,其阳性符合率依次为ADV(30.8%),RSV(12.2%),IFVA(57.7%),IFVB(60.0%),PIV1、PIV2、PIV3(23.8%)。九联检与七联检的检测结果总符合率为36.2%。见表2。

表2 九联检和七联检2种检测方法的阳性符合率结果比较
3 讨 论
免疫荧光技术是将已知的抗原或抗体标记上荧光素(荧光标记物),再用其作为分子探针检查细胞内的相应抗原(或抗体),它是建立在免疫学、生物化学和显微镜技术基础发展起来最早的一种标记免疫技术[6-8]。该方法利用抗原抗体反应进行抗原或抗体物质的定位,在荧光显微镜下根据荧光标记复合物发出的荧光,判断被检测物质的来源、性质和部位[9]。
本研究结果显示,九联检部分病原体的检测阳性率明显低于七联检呼吸道病原体的抗原检测,差异有统计学意义(P<0.05)。七联检是检测抗原,九联检是检测抗体,一般来说抗原检测的阳性率会低于抗体检测,但这可能与九联检是对机体因病原体产生的抗体进行检测,而不同患者用药治疗情况、检测时间点不同,或病原体IgM抗体在不同患者血清中表达水平不同有关[10],七联检是直接用咽拭子采集鼻咽部分泌物脱落细胞检测病毒抗原,与抗体在体内表达不同的是其更直接。也有研究表明[11],患者受呼吸道病原体感染后,可在发病后1周左右检测到血清中产生的特异性IgM抗体,且在急性期呈持续升高趋势。因此,检测患者急性期血清特异性IgM抗体对诊断具有非常重要的意义。宋秦伟等[12]的研究显示,急性期血清呼吸道病毒IgM检测的阳性率低于抗原检测阳性率,与本研究结果相似。
九联检和七联检2种检测方法在实际工作中仍存在其各自的优缺点[13],易受标本取样及实验员操作水平等因素的影响,在一定程度上具有互补作用。呼吸道九联检血清标本取样简便,临床易于接受,除脂、溶血外,很少受标本取样因素的影响,但易受抗体表达水平、玻片质量、实验员以及实验本身原理特性等因素的影响,进而造成其阳性检出率的降低[14]。七联检取患者鼻咽部分泌物脱落细胞[15],对其进行抗原检测,其取样方式不易于被临床及患者接受,尤其是儿童,因此,取样标本的合格与否非常重要,如果未取到合格的鼻咽部分泌物脱落细胞,则整个实验很难成功。综上所述,七联检最主要受标本是否合格的影响,其次易受实验员操作水平等因素的影响。在实际工作中,采用2种检测方法同时进行,不仅可以避免因病原体抗体表达的影响,还可以避免因2种实验各自的缺点而产生的影响,以降低漏检率。建议临床对原因未明且有待查病因的呼吸道感染患者同时进行呼吸道九联检及七联检,以帮助临床进一步明确诊断患者病因。
4 结 论
本研究采用免疫荧光法检测患者呼吸道病原体感染情况,结合临床资料进行比较分析显示,血清特异性IgM抗体受血清学局限,九联检检测阳性率在ADV、RSV、IFVA、IFVB及PIVI、PIV2、PIV3中显著低于七联检,但对MP检测仍具有非常重要的意义,其中LP、COX、CP 3项检出率较低,可与其他实验方法联合应用以提高检出率。七联检因人为取样因素对标本质量的影响,具有一定的漏检率,因此,七联检联合应用九联检可提高病原体检出率,对疾病的预防、诊断及治疗均具有非常重要的临床意义,为临床合理选择检测方法,更好地解读检测结果提供依据。

