核小球藻培养液的循环利用
符虹宇,李雁群,3,蔡奇珍,梁皓辉,黎钊坪,胡雪琼
核小球藻培养液的循环利用
符虹宇1,2,李雁群1,2,3,蔡奇珍1,梁皓辉1,2,黎钊坪1,2,胡雪琼1,2
(1. 广东海洋大学食品科技学院 / 2. 广东海洋大学食品科技学院海洋药物研究所 / 3. 广东省水产品加工与安全重点实验室,广东 湛江 524088)
【目的】探讨蛋白核小球藻采收后培养液是否能循环再用于小球藻的培养。【方法】采用小球藻分批培养完成采收细胞后所得培养废液来配制培养基,重新进入下一批次小球藻培养。以藻类BG11培养基配方为基准,按照配方全部或部分补充营养盐,通过测定藻液的光密度值间接反映藻生物量,比较小球藻在循环培养中的生长情况。【结果】在连续循环利用回收水至第4批次培养收获时培养液的光密度(600 nm)为9.9,比生长速率为0.80 d-1,与第1批培养收获时培养液的光密度(600 nm)和比生长速率相比,小球藻细胞产量和生长速率均未受影响。经过4个轮次的循环培养,用水量可减少约75%。在连续循环培养中仅补充N、P、S盐,至第3个循环小球藻收获时的生物量变化在10%以内。【结论】在加糖混养、保持连续光照、按照BG11配方补全营养盐的培养条件下,至少可对蛋白核小球藻进行4个周期的循环培养。按照BG11配方量补充相应的N、P、S盐,减少其他营养盐的投放,在2个循环周期内可以维持蛋白核小球藻的正常生长。利用培养废液实现小球藻循环经济培养和减少生产排放方法可行。
蛋白核小球藻、微藻培养、培养液循环
小球藻(sp.)是一种普生性单细胞淡水绿藻,其适应能力强,繁殖速率高,易于人工培养[1]。小球藻富含蛋白质、维生素、多不饱和脂肪酸、多糖、矿物质等,可作为膳食营养补充剂[2]。目前小球藻已被开发成如小球藻饮料、小球藻面食、小球藻营养片等各种健康食品[3]。有研究表明,小球藻具有良好的医疗保健作用,可帮助改善心血管疾病、高血糖症、癌症和提高免疫力[4];还可生产高价值生物活性物质,在医药方面具有开发利用前景[5];在固定二氧化碳,减少温室气体,生产生物质用于能源、饲料、化工原料等方面,小球藻也有很好的前景[6-8]。但是,目前小球藻的培养成本较高的问题未能有效解决,大规模人工培养的小球藻还主要局限应用于食品、营养品和药品相关的高附加值产品领域。
微藻生产的成本构成主要有培养基营养盐、培养过程的动力能源消耗、藻细胞采收过程的动力能源消耗、藻细胞干燥的能源消耗和藻培养过程的用水和水处理费用等。为降低微藻生产成本,目前已经对藻种选育、培养条件优化、贴壁培养技术等[9-10]不同生产环节开展了大量研究。生产用水虽然单价较低,甚至可以直接从自然水体中抽取,但水在输送、预处理和排放水净化处理等方面的费用却必须投入,而且培养用水量越大成本越高。微藻的培养用水如果能够在一定时间内循环利用,不进行排放和净化,则可以有效简化操作,节约资源和成本。但关于培养废水是否可以直接再利用于微藻培养,以及如何循环利用等方面的研究报道鲜见。本研究以小球藻为对象,通过对培养蛋白核小球藻后的废液进行循环利用,观察循环水对蛋白核小球藻生物量生长的影响,探讨循环培养的可能性以及措施,以期达到降低微藻生产成本,提高微藻生产经济效益的目的。
1 材料与方法
1.1 材料
蛋白核小球藻购自中国科学院淡水藻种库,编号FACHB-5。
1.2 基础培养基配方及培养条件
BG11培养基基础配方中,N盐:NaNO31.5 g/L;P盐:K2HPO40.04 g/L;S盐:MgSO4•7H2O 0.075 g/L;CaCl2•2H2O 0.036 g/L;Na2CO30.02 g/L;A4:C6H8O70.60 mg/L、(NH4)3Fe(C6H5O7)20.60 mg/L、Na2EDTA 0.10 mg/L;A5:H3BO32.86×10-3g/L、MnCl2•4H2O 1.81×10-3g/L、ZnSO4•7H2O 0.22×10-3g/L、Na2MoO4•2H2O 0.39×10-3g/L、CuSO4•5H2O 0.80×10-4g/L、Co(NO3)2•6H2O 0.49×10-4g/L。
用1 mol/L NaOH或HCl调整培养基的pH至6.5,然后将配制好的培养基分装进250 mL锥形瓶,每瓶90 mL,经121 ℃高压蒸汽灭菌30 min,冷却后加入10 mL 40 g/L无菌葡萄糖母液(经过115 ℃灭菌处理20 min)。摇床培养条件为(26 ± 1)℃,2 000 lx连续光照,150 r/min。
1.3 实验设计
以加质量分数0.4%的葡萄糖混养的方法适当提高藻细胞密度,缩短每批次的培养时间。先通过测定小球藻在7 d培养期内的藻细胞密度,绘制生长曲线,寻找分批培养条件下生物量生长处于培养周期平台期的时间,确定每批次培养的藻细胞收获时间。
第1个循环培养(cycle 1)按照常规方法培养,用纯净水配制培养基,一定天数后离心收获藻细胞并收集培养废液用于制备第2个循环培养(cycle 2)培养基的配制用水。同理,第3(cycle 3)、四个(cycle 4)循环培养则各取前一个循环培养采收时离心得到的培养废液来配制培养基。小球藻在循环水培养的探究中,不同循环间除培养基用水不同外,添加的营养盐成分和含量均相同。
小球藻在补加不同营养盐成分和含量的循环培养基中的生长状况的探究中,同一循环不同营养盐组间,添加的营养盐成分和含量均不同。以BG11培养基配方为基础,共划分7个营养组,其分别为:全BG11、全NPS(按BG11配方,仅添加N、P、S盐)、全N半PS(N盐含量与BG11一致,P盐和S盐为BG11配方量的一半)、全N半PS + CaCl2•2H2O、全N半PS + Na2CO3、全N半PS + A4、全N半PS + A5。每组设置3个平行。以纯净水配制的常规培养基作为对照。

图1 循环培养流程
1.4 藻细胞密度测定
液体培养中小球藻干重与培养液的吸光度成一定的线性关系,可通过测定光密度值间接代表小球藻的生物量[11]。将待测藻液用可见分光光度计[WFJ7200,尤尼柯(上海)仪器有限公司]测定其在600 nm处的光密度值(600 nm),以每组未接种的培养基作为该组的空白对照。
1.5 数据处理
藻细胞在第天的比生长速率μ计算公式:
µ=(lnN–ln1)/(- 1),
式中,N是第天时小球藻的生物量,1是小球藻初始培养的生物量。
2 结果与分析
2.1 小球藻在正常培养条件下的生长曲线
在1.2节所述的BG11培养基中批式培养,小球藻的生长曲线如图2所示。由图2可以看出,接种1 d后,小球藻快速生长,培养2 d后的培养液的(600 nm)值是培养1 d后的指数倍数,说明此时处在小球藻对数生长期。培养至3 d,小球藻开始进入稳定期,3 ~ 7 d的光密度值基本保持不变。因此,以4 d为一个批次培养周期的培养时间,培养4 d后收获藻细胞,培养时间不至于太长,生物量已经达到生长周期的平台期,且较稳定。

图2 蛋白核小球藻在混养条件下的生长曲线
2.2 小球藻在循环水培养基中的生长
利用培养废液循环培养小球藻,其生长情况如图3所示。第1个循环即利用纯净水配置的BG11培养基培养小球藻,第2、3、4循环即利用培养废液培养小球藻。在接种后0 ~ 1 d,第2个循环中小球藻的生长速度较其他循环快,可能小球藻对培养废液有短暂适应期。在培养1 ~ 2 d,各个循环中小球藻均迅速增长,但其生长曲线各不相同。培养3 d后,各个循环中小球藻的生长均趋于稳定。由于小球藻干重与培养液的吸光度成一定的线性关系,依据培养4 d后收获时小球藻的光密度值,小球藻的生物量在第2个循环中是高于第1个循环,而在第3、4个循环中,其生物量较第2个循环是下降的,但与第1个循环比较无显著差异。经过4个循环后,小球藻的生物量没有表现出下降趋势,说明通过利用培养废液循环培养小球藻,减少水排放、降低总成本在一定程度上是可行的,并且可以继续循环培养小球藻,进一步探究循环培养的极限。
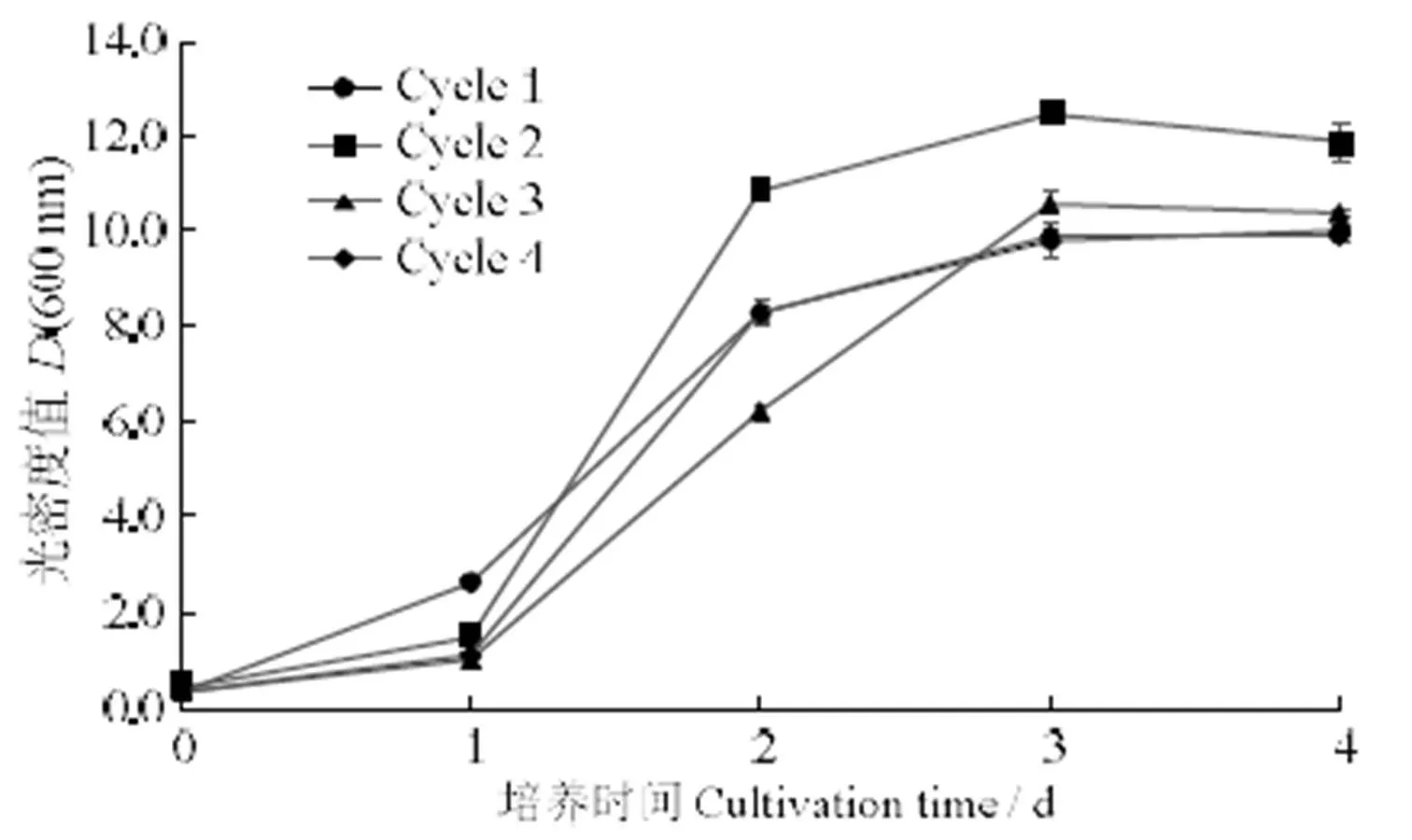
图3 蛋白核小球藻在循环水培养基中的生长
2.3 补充不同含量N、P、S营养盐循环培养中小球藻生物量的变化
为了探讨在循环培养中是否可以减少营养盐的用量,以降低培养成本,本研究按1.2节所述在循环培养废液中补充相应的N、P、S营养盐,而不是添加完整营养盐,观察收获时小球藻生物量的变化。从图4可以看出,仅补充N、P、S营养盐,小球藻收获时的生物量从第3个循环开始下降,到第4个循环时,收获时的生物量较用纯净水培养减少20%。循环培养中,在第2、3循环中仅补充N、P、S营养盐,小球藻收获时的生物量变化在10%以内,可考虑在第4个循环时补全配方中营养盐,维持循环培养中小球藻的生物量。当在循环培养废液中按1.2所述配方补全N盐,而P、S盐减半,其他营养盐不补充时,从第2个循环培养开始,小球藻的生物量产量明显下降(<0.05),第2至4个循环的生物量分别只有正常培养条件下的54%、56%、56%。仅补充全N半PS在1个循环内是无法维持小球藻的正常生物量。仅补充全NPS营养盐,随着循环数的增加,收获时小球藻的生物量随之减少,且减少幅度逐渐增大。但仅补充全N半PS的循环培养中虽然生物量有所减少,但变化幅度不大。
2.4 全N半PS的循环培养液中补充其余营养盐条件下小球藻生物量的变化
为了观察在补全N营养盐同时减少P、S营养盐供给的情况下,单独补充BG11配方中其他营养盐组分是否能使小球藻生物量产量得到一定程度的恢复,根据1.3节所划分的营养盐组分,在循环培养废液中补充相应的营养盐。从图5可以看出,单独补充CaCl2•2H2O、Na2CO3、A4、A5这4个营养盐组分,收获时的小球藻生物量均无显著提高(> 0.05)。

同一循环不同组之间相同字母表示差异不具统计学意义(> 0.05)
The same letter between different groups in the same cycle mean the difference between them has no statistical significance (> 0.05)
图4 补充N、P、S盐对循环培养下小球藻生物量的影响
Fig. 4 The effect of supplementing Nitrogen, Phosphorus and Sulfur salt on biomass ofin cycling culture

同一循环不同组之间相同字母表示差异不具统计学意义(> 0.05)
The same letter between different groups in the same cycle mean the difference between them has no statistical significance (> 0.05)
图5 补充其余营养盐对循环培养下小球藻生物量的影响
Fig. 5 The effect of supplementing other nutrients on the biomass ofin cycle culture
2.5 循环培养液中补充不同营养盐组分条件下小球藻的比增长速率
利用培养基废液,通过添加不同营养盐组分,循环培养小球藻,其比增长速率如表1所示。从表中可以看出,在补加全BG11的条件下,4个循环内,小球藻的比增长率较对照无显著差异(> 0.05)。补加全NPS盐组,其第2循环比生长速率较全BG11组高,第3、4个循环较全BG11组低,但与对照无显著性差异(> 0.05)。在循环培养液中减少其他营养盐的投放,仅补加相应的N、P、S盐,至少在4个循环内可维持小球藻增长速率。
在减少P、S盐投放的条件下,补加CaCl2•2H2O、Na2CO3、A4、A5这4个营养盐组分中的任意一组,小球藻的比增长速率在2个循环内较全N半PS组无显著提高(< 0.05)。而在第4个循环时,任一补加CaCl2•2H2O、Na2CO3、A5这3个营养盐组分中的一组,小球藻的比增长速率在较全N半PS盐组有恢复现象,但不显著(> 0.05)。补加A4营养盐组分, 小球藻的比增长速率虽然较全N半PS盐组有显著提高,但仍显著低于全NPS盐组(<0.05)。在补全N营养盐同时减少P、S营养盐供给的情况下,补加CaCl2•2H2O、Na2CO3、A4、A5这4种营养盐组分中的任意一组,无法使小球藻的比增长速率得到较好的恢复。在循环培养中,可通过补加相应量的N、P、S盐在一定程度上维持小球藻的比生长速率,其他营养盐可在循环一定次数后再按配方补全,达到节约资源、简化操作、延长循环培养时间的目的。
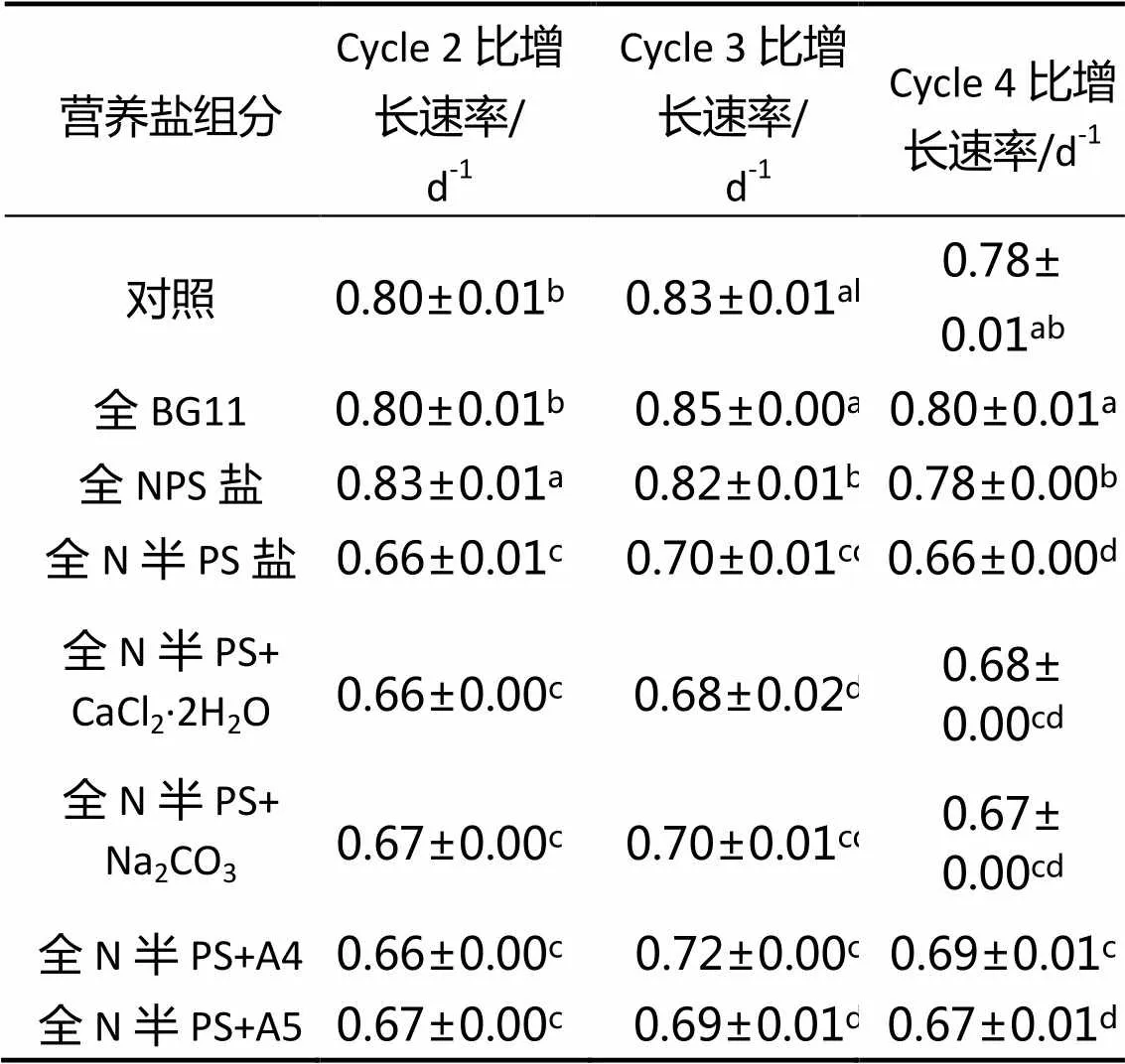
表1 添加不同营养盐条件下小球藻连续循环培养的比增长速率
注:同一循环不同营养盐组分组之间相同字母表示差异无统计学意义(> 0.05)。
Note: The same letter between different groups in the same cycle mean the difference between them has no statistical significance (> 0.05).
3 讨论
微藻对于生产生物质用于能源、化工、饲料、食品、医药都有很好的前景,既可获得生物原料又可改善生态环境的新型高效农业。但是,由于目前微藻生物质生产成本太高,微藻生产应用不够广泛[12]。为降低微藻生产的成本,前人针对微藻主要生产环节展开了研究,从育种[13-14]、培养[15-16]、采收[17-19],到干燥、破碎、油脂提取等后加工[20-21]都有大量的研究报道。微藻培养应以节约用水为原则,但是水的获取、预处理和培养废水的后处理成本消耗很高。就小球藻培养而言,按照开放池培养的一般水平,微藻培养液的藻细胞质量浓度在0.5 ~ 2.0 g/L[22],据估计每生产1 kg小球藻干物质需用1 t水[23]。微藻生产中95%以上的生产用水在收获藻细胞以后被排放而废弃,另外不足5%的生产用水留在藻泥中,在干燥过程中损失。如果利用小球藻生产生物柴油,每生产1 kg生物柴油的耗水量将达到3.726 t[24]。水的消耗因不同的藻种和微藻生产技术而不同,但是水量消耗巨大是共同的特点。
在微藻培养中培养液在回收藻细胞后形成的废水是否可以再次用于微藻培养,需要考虑微藻的代谢产物是否会抑制藻细胞生长。本研究采用加糖混养的方式增大微藻细胞密度,以增加培养液中代谢物的浓度。结果显示,在本研究条件下未出现代谢产物抑制现象。Monte等[25]采用膜过滤技术处理培养废水实现杜氏盐藻()培养基的循环利用,Fret等[26]研究了在实验室规模和中试规模的微拟球藻(sp.)培养基回用,Farooq等[27]研究了不同的藻细胞采收方式对普通小球藻()培养液回用的影响,均发现培养废水回用于微藻循环培养是可能的,笔者的研究结果与上述文献一致。目前,有关培养水的循环利用的研究极其有限,用于循环培养的藻种有节旋藻()[28]、杜氏盐藻[25]、微拟球藻[26]和普通小球藻[27]等,但是未见蛋白核小球藻循环培养的研究报告。本研究用培养废水替代纯净水,实现蛋白核小球藻循环培养,这对于在较低细胞密度的开放池培养蛋白核小球藻并回用培养水更具有可行性和重要的现实意义。
目前循环培养研究中[25-28]有关培养水的回用大多关注采收技术和培养基的补充对循环培养影响,仅做了一次循环培养试验。循环水每回收利用一次,水的耗用量能减少一半,但水的消耗和废水的排放量依然还是巨大的,故能够实现的循环次数越多,排放水量就越少,水消耗量就越少。因此,如果能够实现多次或者无限次循环,就能实现零排放循环培养。笔者通过4个循环的培养,发现小球藻的生物量产量并未受到明显影响,说明在本实验条件下至少可以实现4次循环,经过4个轮次的循环培养,可使水的消耗量减少约75%。是否能实现无限次循环或者需要采用何种技术加以补充可以实现无限次循环还需要进一步实验观察。
对于循环培养,除考虑水的回收利用,还需要关注营养素的回收利用。在工、农业污水用于微藻培养的时候,经过一次培养一般只有部分营养素会被消耗完全,在新一轮培养前需要补充[29],其他未消耗完的营养素可继续利用。本研究是基于食品应用的蛋白核小球藻的培养,在此情形,一般用BG11等配方培养基,有时会加糖混养或添加NaHCO3等增加碳源提高生长速度和生物量产量。食用小球藻生产用的新配培养基成分比较确定,由于食品安全的需要,培养基成分也比较明确。所以,本研究采用以BG11为基础来研究循环培养中的营养素消耗与补充问题。在本研究中,通过分析比较补充完全BG11培养基和补充基于BG11减少某些成分的各培养基配方对小球藻在循环培养中生物量的影响,明确在循环培养中蛋白核小球藻对营养盐的不同需求,从而达到节省营养盐成本的目的。结果表明补充完全BG11或补足BG11中的N、P、S盐都可以在4个循环内维持蛋白核小球藻的生物量和生长速率。本文仅进行了4轮培养,如果在更多轮循环培养时,除N、P、S的其他营养盐分别在经过多少轮循环后需要补充,需要进一步研究。
4 结论
蛋白核小球藻培养废水可以回收用于下一轮培养,此循环培养至少可以进行4次后再排放废水。经过4个轮次的循环培养,可使水的消耗量减少约75%。在以BG11基础培养基的循环培养中,每次循环只要补加N、P、S盐即可维持小球藻的正常生长,其他营养盐成分至少在3个循环内不必补充。利用培养废液实现小球藻循环经济培养和减少生产排放是可行的。
[1] 韦金河, 汪廷, 冯伟民, 等. 小球藻大面积养殖技术[J]. 江苏农业科学, 2004(2): 74-76.
[2] 李师翁, 李虎乾. 植物单细胞蛋白资源——小球藻开发利用研究的现状[J]. 生物技术, 1997(3): 45-48.
[3] 王宝贝, 蔡舒琳, 李丽婷, 等. 小球藻在食品中的应用研究进展[J]. 食品工业科技, 2017, 38(17): 347-352;358.
[4] 张旗, 尚小玉, 王娜, 等. 小球藻营养活性研究进展[J]. 食品研究与开发, 2015, 36(13): 139-143.
[5] PANAHI Y, DARVISHI B, JOWZI N, et al.: A multifunctional dietary supplement with diverse medicinal properties[J]. Current Pharmaceutical Design, 2016, 22(2): 164-173.
[6] MORAIS M G D, COSTA J A V. Carbon dioxide fixation by,,andsp. cultivated in flasks and vertical tubular photobioreactors[J]. Biotechnology Letters, 2007, 29(9): 1349-1352.
[7] XU H, MIAO X L, WU Q Y. High quality biodiesel production from a microalgaby heterotrophic growth in fermenters[J]. Journal of Biotechnology, 2006, 126(4): 499-507.
[8] 常杰. 小球藻在动物营养中的应用研究进展[J]. 饲料研究, 2016(2): 7-10.
[9] 高攀峰, 温小娟, 沈惜坤, 等. 小球藻育藻条件优化及其在高位池对虾养殖中的应用[J]. 福建农业学报, 2018, 33(5): 463-468.
[10] 朱顺妮, 刘芬, 樊均辉, 等. 微藻生物能源研究现状及展望[J]. 新能源进展, 2018, 6(6): 467-474.
[11] 朱晓明, 刘德富, 杨正健, 等. 不同浓度培养液对小球藻生长的影响[J]. 环境科学与技术, 2014, 37(S2): 51-57.
[12] BARSANTI L, GUALTIERI P. Is exploitation of microalgae economically and energetically sustainable?[J]. Algal Research, 2018, 31: 107-115.
[13] LARKUM A W D, ROSS I L, KRUSE O, et al. Selection, breeding and engineering of microalgae for bioenergy and biofuel production[J]. Trends in Biotechnology, 2012, 30(4): 198-205.
[14] WANG Y, LING C, CHEN Y, et al. Microbial engineering for easy downstream processing[J]. Biotechnology Advances, in press. DOI: 10.1016/ j.biotechadv.2019.03.004.
[15] ANTONIA M, FILIPPOS V. Microalgal biofilms: A further step over current microalgal cultivation techniques[J]. Science of The Total Environment, 2019, 651(2): 3187-3201.
[16] ZHUANG L L, YU D, ZHANG J, et al. The characteristics and influencing factors of the attached microalgae cultivation: A review[J]. Renewable and Sustainable Energy Reviews, 2018, 94: 1110-1119.
[17] MENEGAZZO M L, FONSECA G G. Biomass recovery and lipid extraction processes for microalgae biofuels production: A review[J]. Renewable and Sustainable Energy Reviews, 2019, 107: 87-107.
[18] WAN C, ALAM M A, ZHAO X Q, et al. Current progress and future prospect of microalgal biomass harvest using various flocculation technologies[J]. Bioresource Technology, 2015, 184: 251-257.
[19] PRAGYA N, PANDEY K K, SAHOO P K. A review on harvesting, oil extraction and biofuels production technologies from microalgae[J]. Renewable and Sustainable Energy Reviews, 2013, 24: 159-171.
[20] BENNAMOUN L, AFZAL M T, L ONARD A. Drying of alga as a source of bioenergy feedstock and food supplement – A review[J]. Renewable and Sustainable Energy Reviews, 2015, 50: 1203-1212.
[21] 张方, 熊绍专, 何加龙, 等. 用于生物柴油生产的微藻培养技术研究进展[J]. 化学与生物工程, 2018, 35(1): 5-11.
[22] BILAD M R, VANDAMME D, FOUBERT I, et al. Harvesting microalgal biomass using submerged microfiltration membranes[J]. Bioresource Technology, 2012, 111: 343-352.
[23] GUIEYSSE B, B CHET Q, SHILTON A. Variability and uncertainty in water demand and water footprint assessments of fresh algae cultivation based on case studies from five climatic regions[J]. Bioresource Technology, 2013, 128: 317-323.
[24] YANG J, XU M, ZHANG X Z, et al. Life-cycle analysis on biodiesel production from microalgae: Water footprint and nutrients balance[J]. Bioresour Technol, 2011, 102(1): 159-165.
[25] MONTE J, SA M, PARREIRA C, et al. Recycling ofcultivation medium by integrated membrane filtration and advanced oxidation[J]. Algal Research, in press. DOI: 10.1016/j.algal.2019.101460.
[26] FRET J, ROEF L, BLUST R, et al. Reuse of rejuvenated media during laboratory and pilot scale cultivation ofsp.[J]. Algal Research, 2017, 27: 265-273.
[27] FAROOQ W, MOON M, RYU B G, et al. Effect of harvesting methods on the reusability of water for cultivation of, its lipid productivity and biodiesel quality[J]. Algal Research, 2015, 8: 1-7.
[28] DEPRAETERE O, PIERRE G, NOPPE W, et al. Influence of culture medium recycling on the performance ofcultures[J]. Algal Research, 2015, 10: 48-54.
[29] DENG X Y, GAO K, ADDY M, et al. Cultivation ofon anaerobically digested swine manure with daily recycling of the post-harvest culture broth[J]. Bioresource Technology, 2018, 247: 716-723.
A Recycling of Culture Medium of
FU Hong-yu1,2, LI Yan-qun1,2,3, CAI Qi-zhen1, LIANG Hao-hui1,2, LI Zhao-ping1,2, HU Xue-qiong1,2
(1.,/ 2./ 3.,., 524088,)
【Objective】To investigate whether the recycled water after harvestingcould be reused for the algal cultivation.【Method】The cycling medium was prepared with the remaining culture liquid after harvesting algae cells at the end of the last cultivation batch, and then was used to the next batch of cultivation. The total or partial complement of nutrients was based on the recipe BG11 of microalgae. The biomass and the growth ofwas indirectly indicated by the optical density .【Result】At the end of the 4th successive cultivation batch, the optical density(600 nm) of broth was 9.9 and the specific growth rate was 0.80 d-1, which did not show any significant decrease comparing with the biomass concentration and the algal growth rate at the end of the first batch. After 4 successive cultivation batches, the water consumption was reduced about 75%. Only when it was supplemented with the nutrients of nitrogen, phosphorus and sulfur in successive cultivation, the change of biomass ofwas controlled within 10% in two cycles. 【Conclusion】The results showed that under the condition of adding sugar, maintaining continuous illumination and having total complement of nutrients based on the recipe BG11, at least four cultivation batches ofcould be carried out. When it had only complement of nitrogen, phosphorus and sulfur nutrients,the growth ofcould be keep in 2 successive cultivation batches. It is feasible to realize the circulatory economic cultivation ofand reduce production emissions by the recycledwaste water.
, microalgal cultivation, recycle of culture medium
Q949.99
A
1673-9159(2019)04-0049-07
10.3969/j.issn.1673-9159.2019.04.008
2019-03-19
广东省自然科学基金(2015A030313616);广东省国际合作项目(2017A050501038);湛江市科技计划项目(2015A03026)
符虹宇(1991-),女,硕士研究生,研究方向为微藻生物活性物质研究与开发。E-mail:445363248@qq.com
李雁群(1963-),男,博士,教授,研究方向为发酵工程。E-mail:liyq2004@126.com
符虹宇,李雁群,蔡奇珍,等. 蛋白核小球藻培养液的循环利用[J]. 广东海洋大学学报,2019,39(4):49-55.
(责任编辑:刘朏)

