瓦氏雅罗鱼生殖洄游过程中离子调节相关生理变化研究
王瑞芳 刘玉辉 王 俊 齐景伟 孟和平 高玉奎 柳玉海蔺浩宇 安晓萍
(1. 内蒙古农业大学动物科学学院, 呼和浩特 010018; 2. 内蒙古达里湖渔场, 赤峰 024000;3. 内蒙古水产技术推广站, 呼和浩特 010010)
鱼类的生殖洄游对种群适合度有着重要的意义, 因此, 一直以来是鱼类生态学的重要研究内容[1]。鱼类在生殖洄游过程中面临着性腺的不断发育成熟、营养的缺乏, 能量的重新分配等生理变化, 同时也面临着水环境渗透压及离子组成的改变。洄游过程中的鱼类通过多种渗透压调节器官对盐分和水分进行调节而适应不同的盐碱环境[2]。参与鱼类渗透压和离子调节的组织主要是肠上皮细胞、肾脏和鳃组织[3,4]。从低渗环境洄游到高渗环境后,由于体内外渗透差的作用鱼体会丢失水分, 水环境中各种离子也会通过鳃和皮肤被动扩散进入体内,为维持渗透平衡鱼体通过肠道吸收大量水分, 而进入体内的离子通过鳃等渗透调节器官排出体外; 从高渗环境洄游到低渗环境时, 鱼体会丢失盐分, 同时环境中水分扩散进入体内, 因此, 除了从食物中得到盐分外, 鱼体还需要通过鳃从水中主动吸收离子[5]。鱼类的鳃在渗透调节、酸碱调节和离子调节过程中均发挥重要作用, 鳃组织中的细胞主要有线粒体丰富细胞(MR)或氯细胞、扁平细胞和黏液分泌细胞等3种不同类型, 其中氯细胞中含有Na+/K+-ATPase, 它们主要存在于基底膜和细胞质中与许多线粒体相连接的微管系统中[6], 承担在不同渗透环境中将Na+和Cl-从水中转运到体内或者从体内转出到水中的重要任务。因此, 鱼类在降海洄游和溯河回游过程中, 鱼鳃上氯细胞的形态和功能及Na+/K+-ATPase会进行适应性调节, 而这些变化与多种激素如催乳素(PRL)、生长激素(GH)、类胰岛素生长因子-1(IGF-1)的介导密切相关[7], 它们可以刺激新的转运蛋白合成, 从而影响氯细胞的增殖、分化, 改变渗透调节组织对离子和水分的转运能力[8,9]。
达里湖(E116°25′—116°45′, N43°13′—43°23′)是在第三世纪初内蒙古高平原发生沉降时形成的一系列内陆湖盆之一, 湖水的主要来源是贡格尔河、沙里河、耗来河、亮子河, 以及地下水和雨水的补给, 湖水损失主要由水体自然蒸发造成。近年来由于气候干旱, 湖水蒸发大于内流, 径流入湖中盐分在湖内长期积累, 致使湖水含盐量(6.46‰)、碱度(年平均53.57 mmol/L)和pH (年平均9.65)不断增加[10]。极端盐碱环境已严重限制了大多数淡水鱼类的生存和繁殖, 瓦氏雅罗鱼(Leuciscus waleckii)是目前达里湖中仅存的两种经济鱼类之一, 虽然其已进化了一些特殊的生理机制可在高碱度、高pH的达里湖中生存[11,12], 但每年4月底至5月初仍需洄游到淡水河流中进行繁殖, 产卵后亲鱼及仔稚鱼再返回到湖水中摄食和生长。
近年来, 已对瓦氏雅罗鱼耐盐碱生理和分子机制开展了一些研究[13,14], 而对其生殖洄游过程中的离子调节生理了解甚少, 关于其生殖洄游的生理和分子机制尚不清楚。本研究拟比较达里湖和贡格尔河瓦氏雅罗鱼血清离子含量和激素水平、渗透调节组织Na+/K+-ATPase、Ca2+/Mg2+-ATPase活性及鳃组织结构差异, 分析急性河水暴露后达里湖瓦氏雅罗鱼上述离子调节生理参数的变化, 为解析达里湖瓦氏雅罗鱼生殖洄游过程中的离子调节生理机制提供基础数据, 为保护其种群资源奠定科学的理论基础。
1 材料与方法
1.1 试验用鱼
本试验所用瓦氏雅罗鱼于2017年5月7日(生殖洄游期)分别捕于达里湖(43°22′22.63″N, 116°39′57.50″E)和贡格尔河(43°22′33.56″N, 116°42′54.83″E)中。湖鱼使用网箔(俗称迷魂阵)采捕, 河鱼使用手操网捕获于距离达里湖56 km处的贡格尔河瓦氏雅罗鱼人工产卵场, 由内蒙古达里湖渔场工作人员协助获得。在捕捞后选择雌性湖鱼[(118.96±26.33) g,(19.33±1.75) cm]和河鱼[(109.23±11.43) g, (18.95±0.88) cm]各45尾分别放于装有湖水和河水的塑料箱中1h内运回渔场实验室, 用于样品采集及河水暴露试验。同时, 利用多功能水质分析仪测定达里湖和贡格尔河水pH、温度、盐度和溶解氧含量, 另取水样带回实验室测定Na+、Cl-、K+、Ca2+、Mg2+浓度及碳酸盐碱度, 湖水和河水样品各设置3个重复。
1.2 试验方法
急性河水暴露试验设计从捕捞的湖鱼中随机挑选雌鱼12尾, 转入河水中养殖, 在河水中暴露24h后取样, 分析血清含量和激素水平以及鳃、肠和肾组织酶活性。试验在120 L的水族箱中进行,试验过程中不投饵, 持续充氧, 水温保持在(12±1)℃。
样品采集和处理分别选择雌性湖鱼和河鱼各12尾, 用100 mg/L MS-222(间氨基苯甲酸乙酯甲磺酸盐)麻醉, 尾静脉采血, 分离血清, 4℃冰箱中放置6h, 3000 r/min, 离心20min, 取上层血清于-80℃冰箱保存, 用于测定血清离子Na+、K+、Ca2+、Mg2+、Cl-含量和GH、IGF-1、PRL水平。采血后在冰上解剖, 取出鳃、肠道和肾组织用预冷生理盐水清洗, 滤纸吸干后置于2 mL细胞冻存管中, 液氮速冻, 转入-80℃冰箱保存, 用于测定Na+/K+-ATPase和Ca2+/Mg2+-ATPase活性。另每尾鱼取鳃丝放入10%中性甲醛溶液中固定, 用于制作石蜡组织切片。
急性河水暴露试验结束后样品采集方法同上。
血清离子水平测定血清Na+、K+、Ca2+、Mg2+、Cl-含量均采用比色法进行测定, 试剂盒购于南京建成生物工程研究所。根据不同离子的标准曲线计算血清离子浓度, 河水和湖水中阳离子含量采用火焰原子吸收法(Aanalyet 800 原子吸收光谱仪, 美国铂金埃尔默公司)进行测定, 阴离子采用比色法测定, 单位均为mmol/L。
血清激素水平测定GH、IGF-1和PRL均采用定制的鱼ELISA试剂盒进行测定(武汉基因美生物科技有限公司)。根据标准曲线推算血清中激素含量。GH标准曲线为y=0.123x+0.179,R2=0.968, 单位为ng/mL; IGF-1的标准曲线为y=0.175x+0.133,R2=0.982, 单位为g/L; PRL的标准曲线为y=0.0006x+0.195,R2=0.947, 单位为pg/mL。
Na+/K+-ATPase和Ca2+/Mg2+-ATPase活性测定将瓦氏雅罗鱼鳃、肾和肠道组织解冻, 鳃去鳃弓留鳃丝, 称重, 每种组织均加入9倍体积预冷生理盐水(0.86%), 用玻璃组织匀浆器破碎组织, 匀浆液4℃, 1000 r/min, 离心5min。上清液稀释到适宜比例后采用磷钼酸比色法测定Na+/K+-ATPase和Ca2+/Mg2+-ATPase活性。试剂盒购于南京建成生物工程研究所。
酶活力单位定义为: 每小时每毫克组织中ATP酶分解ATP产生1 μmoL无机磷的量为一个ATPase酶活力单位, 即μmol Pi/(mg prot·h)组织中蛋白含量采用BCA法进行测定, 以牛血清蛋白为标准。
鳃组织切片制作瓦氏雅罗鱼鳃组织样品,经梯度酒精脱水, 水杨酸甲酯透明, 制作常规石蜡切片, 切片厚度为5 μm, HE染色, 中性树脂封片后使用蔡司显微镜观察和拍照。
1.3 数据处理
试验所有数据均用平均值±标准误(Mean±SEM)表示, 采用SPSS16.0软件进行统计分析, 达里湖、贡格尔河和急性河水暴露组瓦氏雅罗鱼离子含量、酶活性及激素水平采用单因素方差分析(One-Way ANOVA), 若差异显著再进行多重比较(LSD’s test),P<0.05表示差异显著。
2 结果
2.1 达里湖和贡格尔河水化学参数比较
达里湖水的碱度、pH和盐度远高于贡格尔河水, 溶解氧含量略低于河水, Na+、K+、Cl-、Mg2+含量均高于河水, 而贡格尔河水中Ca2+含量为达里湖水中Ca2+含量的20倍; 与世界河流中平均离子水平相比, 贡格尔河水中Ca2+、Mg2+和Na+含量偏高,Cl-含量相近, 而K+含量偏低(表 1)。
2.2 不同环境中瓦氏雅罗鱼血清离子含量比较
与达里湖中瓦氏雅罗鱼相比, 洄游到贡格尔河后血清Na+含量显著降低(P<0.05), Cl-含量显著升高(P<0.05), K+、Ca2+和Mg2+含量无显著变化。达里湖中瓦氏雅罗鱼转入到贡格尔河水中24h后, 其血清Cl-含量显著升高(P<0.05)、K+含量显著降低(P<0.05), 而Na+、Ca2+和Mg2+含量无显著变化(图 1)。
2.3 不同环境中瓦氏雅罗鱼鳃、肠和肾组织Na+/K+-ATPase与Ca2+/Mg2+-ATPase活性变化
与达里湖中瓦氏雅罗鱼相比, 洄游到贡格尔河后其肾脏和肠道组织中Na+/K+-ATPase活性显著升高(P<0.05), 而鳃组织Na+/K+-ATPase活性无显著变化; 将达里湖瓦氏雅罗鱼转入到贡格尔河水中24h后, 其鳃、肠、肾组织Na+/K+-ATPase活性均显著升高(P<0.05, 图 2)。达里湖中瓦氏雅罗鱼及转入河水中24h后其肠道和鳃组织中Na+/K+-ATPase活性均显著高于肾脏组织(P<0.05), 而当其洄游到贡格尔河后, 肾脏组织中Na+/K+-ATPase活性最高, 肠道次之, 鳃组织中最低(图 2)。
与达里湖中瓦氏雅罗鱼相比, 洄游到贡格尔河后鳃组织Ca2+/Mg2+-ATPase活性无显著变化, 而将达里湖瓦氏雅罗鱼转入到贡格尔河水后24h后, 其鳃组织中Ca2+/Mg2+-ATPase活性显著升高(P<0.05,图 3)。
2.4 不同环境中瓦氏雅罗鱼血清激素水平的变化
与达里湖中瓦氏雅罗鱼相比, 洄游到贡格尔河后其血清中GH、IGF-1和PRL水平均无显著变化;而将达里湖瓦氏雅罗鱼转入贡格尔河水中24h后,其血清IGF-1和PRL水平均显著升高(P<0.05), 而血清GH水平在河水转运后未见显著变化(表 2)。
2.5 瓦氏雅罗鳃组织结构变化
瓦氏雅罗鱼鳃小片整齐的排列在鳃丝两侧, 呈半圆形扁平囊状, 鳃丝上皮由多层上皮细胞组成,可见扁平细胞、泌氯细胞、黏液细胞等。鳃小片上有扁平细胞、柱状细胞以及血管道, 血道内存在血细胞。在达里湖中, 瓦氏雅罗鱼鳃小片基部可见大量黏液细胞, 少量氯细胞(图 4a), 洄游到贡格尔河后黏液细胞数量显著减少, 氯细胞数量无明显变化, 但体积略增大(图 4b)。
3 讨论
3.1 不同环境中瓦氏雅罗鱼血清离子浓度的变化
鱼体液渗透压是由体液中溶质总浓度决定的,主要是无机电解质, 而Na+、Cl-是体液中主要的电解质, 因此, 鱼体调节Na+、Cl-的稳定对于渗透压调节至关重要[15]。本试验测定了不同环境中瓦氏雅罗鱼血清离子浓度, 发现达里湖瓦氏雅罗鱼在湖中和洄游到河中后血清离子水平均在典型鲤科鱼类和其他淡水硬骨鱼类的离子水平范围内[16]。
大多数广盐性硬骨鱼类从半咸水转运到淡水环境后, 由于被动扩散从而引起盐的损失, 最终导致血浆离子水平降低[17,18]。本试验发现洄游到贡格尔河后雅罗鱼血清Na+水平降低, 因河水中Na+、Cl-含量较低, 按照等渗原理, 洄游到河水中后瓦氏雅罗鱼体内Na+流失率增加, 使得血清中Na+水平显著降低, 但这一值仍在大多数鲤科鱼类血清Na+浓度的范围内[16]。与Na+不同, 洄游到贡格尔河后瓦氏雅罗鱼血清Cl-含量显著升高, 这一结果与Wang等[19]的研究中发现洄游到河流中的青海湖裸鲤(Gymnocypris przewalskii)血浆中Cl-含量显著高于其在湖水中的值结果是一致的。Wang等[19]认为,对洄游到河里的青海湖裸鲤而言, 较高的血清离子含量可以提供更适宜的鱼体内部环境, 从而应对其从湖洄游到河后能量的平衡、代谢重新调整和酸碱平衡及离子平衡等生理的挑战, 在生理上是一种优势。另外, 洄游到河水中后瓦氏雅罗鱼生理活动(如出现繁殖行为、摄食水平降低、激素水平改变)的变化也可能引起血清离子浓度发生改变。因此, 血清离子含量的变化是鱼体在低离子水平的河水中主动调节的结果。
瓦氏雅罗鱼洄游到贡格尔河后血清Ca2+和Mg2+浓度维持在稳定水平。相似的结果在Wang等[19]对青海湖裸鲤的研究中也曾报道。大多数鱼类在正常情况下, 通过肠道和鳃的吸收, 之后调动骨骼和软组织中的Mg2+或将Mg2+沉积在骨骼和软组织中, 通过肾的分泌和重吸收作用, 而使细胞外液Mg2+可以稳定维持在较低水平[20], 肾脏的分泌和重吸收作用被认为是维持Mg2+稳态的主要机制。另外, 血浆中Mg2+水平可以很好的调控可能是肾脏通过Na+/Mg2+交换机制严格调控的结果, 通过尿排出过多的Mg2+[21]。
在本试验中将达里湖瓦氏雅罗鱼急性转入河水中后, 血清Cl-浓度升高, 而K+浓度降低, 这与将青海湖裸鲤直接转运到河水中48h后的试验结果一致[20]。Cl-升高和K+降低可能与环境渗透浓度突然降低后大量水分进入体内有关。此外, 达里湖瓦氏雅罗鱼在转入到河水中24h后Na+和Ca2+、Mg2+维持稳定水平, 表明其具有完善的Na+和Ca2+、Mg2+调节机制, 可以快速调节体内外离子转运达到平衡,这可能是将达里湖瓦氏雅罗鱼转入河水中后PRL、IGF-1水平升高, 激素水平的升高可刺激新的Na+/K+-ATPase和鳃Ca2+/Mg2+-ATPase转运蛋白合成, 从而提高鳃、肠和肾组织酶活性的结果。
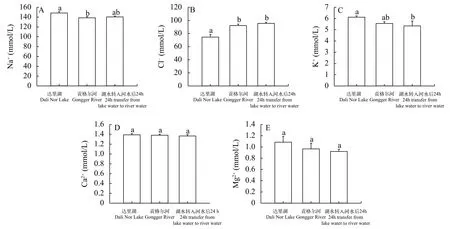
图 1 不同环境中瓦氏雅罗鱼血清Na+ (A)、Cl- (B)、K+ (C)、Ca2+ (D)和Mg2+ (E)含量变化Fig. 1 Concentrations of serum Na+ (A)、Cl- (B)、K+ (C)、Ca2+ (D)和Mg2+ (E) in Leuciscus waleckii collected form Dali Nor Lake,Gongger River and during 24 h transfer form Dali Nor Lake to Gongger River water柱子上方不同小写字母代表存在显著差异, 显著性水平定义为0.05, 下图同Different superscript letters indicate significant differences (P<0.05). The same applies bellow
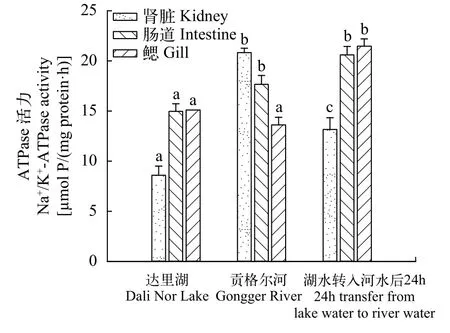
图 2 不同环境中瓦氏雅罗鱼鳃、肠和肾组织Na+/K+-ATPase活性变化Fig. 2 Na+/K+-ATPase activities in gills, intestine and kidney tissues of Leuciscus waleckii collected form Dali Nor Lake,Gongger River and during 24h transfer form Dali Nor Lake to Gongger River water
3.2 不同环境中瓦氏雅罗鱼鳃、肠和肾Na+/K+-ATPase活性变化
鳃是鱼类重要的渗透压调节器官, 渗透环境改变后广盐性鱼类能够通过改变鳃上皮氯细胞的形态和功能来调节离子的吸收或分泌。位于鳃氯细胞基底侧膜及微小管系统中的Na+/K+-ATPase酶为各种离子转运提供最终驱动力, 在鱼类海水和淡水转运过程中起到中心作用[6]。当环境中离子浓度发生改变时, 鳃Na+/K+-ATP通常会进行适应性调整。先前研究显示, 鳃Na+/K+-ATPase活性或氯细胞数量与外部盐度变化存在显著的线性关系[22]。对一些洄游性鱼类的研究发现, Na+/K+-ATPase活性在洄游到淡水中时均降低[23,24]; 而也有一些研究显示,洄游性鱼类在暴露到淡水中后, Na+/K+-ATPase活性增加[19,22,25,26]。本研究结果与后者一致, 发现达里湖瓦氏雅罗鱼转入河水中后24h后其鳃组织Na+/K+-ATPase活性显著升高。Na+/K+-ATPase活性的提高有助于雅罗鱼从淡水环境中主动吸收Na+、Cl-等离子, 使血清离子浓度维持在鱼体生理活动需要的水平, 从而保证生命活动和能量代谢的正常进行。
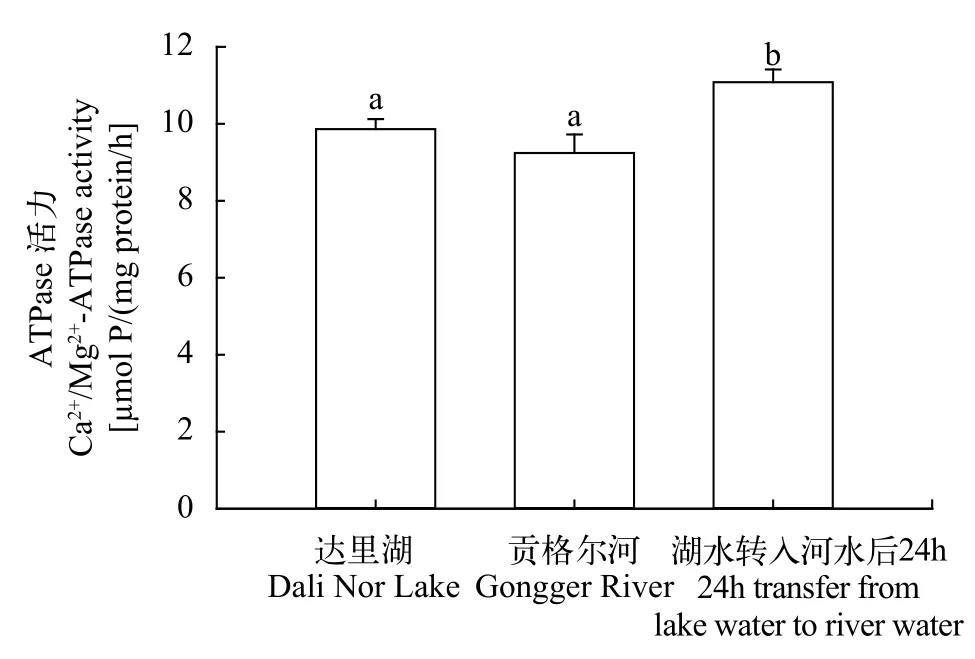
图 3 不同环境中瓦氏雅罗鱼鳃组织Ca2+/Mg2+-ATPase活性变化Fig. 3 Ca2+/Mg2+-ATPase activities in gills tissues of Leuciscus waleckii collected form Dali Nor Lake, Gongger River and during 24h transfer form Dali Nor Lake to Gongger River water
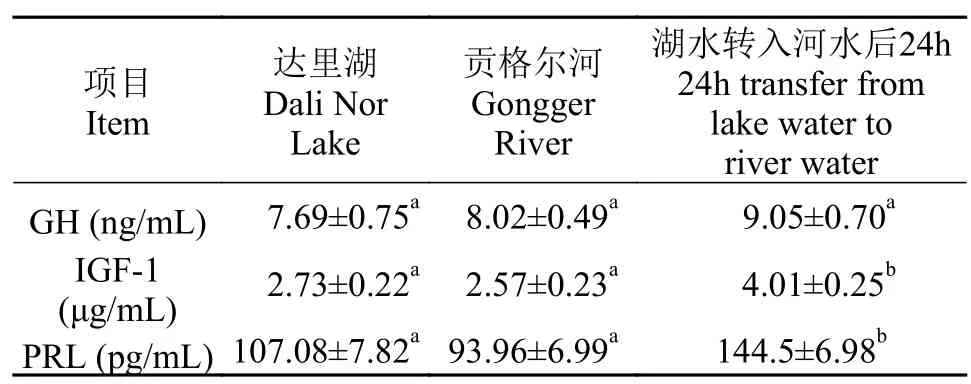
表 2 不同环境中瓦氏雅罗鱼血清生长激素、类胰岛素生长因子-1和催乳素水平变化Tab. 2 Serum GH, IGF-1 and PRL levels of Leuciscus waleckii collected form Dali Nor Lake, Gongger River and during 24h transfer form Dali Nor Lake to Gongger River water
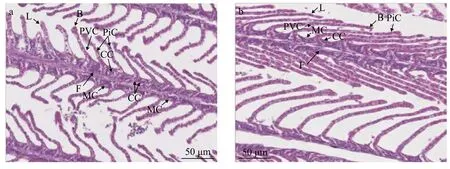
图 4 达里湖(a)和贡格尔河(b)瓦氏雅罗鱼的鳃丝显微图片Fig. 4 Light micrograph of gills in Leuciscus waleckii collected form Dali Nor Lake (a) and Gongger River (b)F. 鳃丝; L. 鳃小片; CC. 泌氯细胞; PVC. 扁平细胞; PiC. 柱状细胞; B. 血管通道; MC. 黏液细胞F. filament; L. lamellae; CC. chloride cells; PVC. pavements cells; PiC. pillar cells; B. blood channel; MC. mucous cells
除了鳃外, 肾脏和肠道组织在不同渗透环境下离子和水分的平衡调节过程中也发挥重要作用[4,27,28]。生活在淡水环境中或由高渗进入低渗环境后鱼类为了维持体内渗透压平衡, 肾小体和肾小球的功能增强, 鱼体会将体内吸收的过多水分不断排出体外,增加了泌尿量并对原尿中离子进行重吸收, 肾脏上的转运蛋白和通道如Na+/K+-ATPase、H+-ATPase和碳酸酐酶(CA)负责离子重吸收和排泄, 也会进行适应性调整。鱼类肠道在低渗环境下也可以对Na+和Cl-进行重吸收, 而在高渗环境下, 通过肠道离子转运蛋白如囊性纤维化跨膜转运调节体(CFTR)排出多余的离子, 进行辅助的离子调节[29,30]。本试验发现, 洄游到贡格尔河后与河水转运后24h后的瓦氏雅罗鱼肾和肠Na+/K+-ATPase活性均显著升高, 表明瓦氏雅罗鱼肠和肾在其适应低渗环境进行离子和水平衡的调节过程中发挥重要作用。这一结果与Wood等[25]对青海湖裸鲤的研究结果一致, 该研究发现青海湖裸鲤从布哈河水到青海湖水转运过程中湖鱼鳃和肾Na+/K+-ATPase活性仅为河水中的30%和70%。因河水中离子浓度低于鱼体, 因此, 鱼体内离子易流失, 雅罗鱼肠道和肾Na+/K+-ATPase活性调高有利于通过肾脏和肠道对离子进行重吸收, 这也可能是瓦氏雅罗鱼在淡水中维持其体内稳定或较高离子水平的一种适应性机制。
另外, 比较本试验中3种渗透调节组织中Na+/K+-ATPase活性, 发现在湖水中雅罗鱼鳃和肠Na+/K+-ATPase活性显著高于肾, 而在河水中肾和肠Na+/K+-ATPase活性高于鳃, 表明在不同水环境中鳃、肠、肾发挥渗透调节作用的重要性可能存在差异。与鳃相比, 目前我们对肾和肠在鱼类渗透调节过程中的作用了解还较少, 特别是对于生活在高盐碱环境中的鱼类, 面临盐度和碱度的双重作用,肠和肾在其适应高盐碱环境过程中如何发挥作用,还需要进一步研究予以探讨。
3.3 不同环境中瓦氏雅罗鱼血清激素水平变化
近年来研究发现, 生长激素、类胰岛素样生长因子-1、催乳素和皮质醇等激素在鱼类离子调节过程中发挥重要作用[31,32]。这些激素可通过刺激机体合成新的蛋白, 从而影响氯细胞的增殖和分化,调节氯细胞中Na+/K+-ATPase的活性, 改变氯细胞对离子和水的运输能力[8,33,34], 以维持机体离子的平衡。本研究发现将达里湖瓦氏雅罗鱼转入河水中后24h后血清PRL水平显著升高。PRL在低渗环境中升高在先前研究中已被证实。如Kakizawa等[35]发现, 在大麻哈鱼(Oncorhynchus keta)生殖洄游过程中, 捕于河中的雌、雄鱼血浆PRL浓度均高于海洋和海湾中鱼的浓度; Miguel等[36]研究也发现远离海岸的河中金头鲷(Sparus aurataL.)垂体PRLmRNA表达水平是海鱼和海湾鱼的3—5倍高; 比较海水适应性和淡水适应性罗非鱼(Oreochromis mossambicus)也发现, 前者鱼鳃中催乳素受体的表达量明显降低, 而后者血浆内催乳素浓度显著上升[37]; 这些研究均证实, 催乳素在广盐性鱼类适应淡水进行离子调节的过程中发挥重要作用, 本研究结果支持这一观点。
IGF-1基因是生长激素主要的目标基因, 生长激素调控IGF-1的表达水平, IGF-1直接作用于靶细胞, 介导生长激素的生物学效应[32]。近来的研究发现, IGF-1除了具有生长促进作用, 似乎也在洄游性鱼类海水适应过程中起重要作用[38]。Cao等[39]对青海湖裸鲤的研究发现湖水组青海湖裸鲤血浆IGF-1显著高于河水组。在金鳟(Oncorhynchus mykiss)、大西洋鲑(Salmo salar)和褐鳟(Salmo trutta)的研究中也显示, 将其转入海水后, 鳃IGF-1 mRNA表达量增加, 抗盐能力显著提高[32]。与上述研究结果不同,本研究中将瓦氏雅罗鱼从湖水转入到河水后其血清IGF-1水平显著升高, 似乎表明IGF-1与PRL一样均为低渗敏感激素。研究显示, IGF-1无论在体内还是体外均能刺激鳃Na+/K+-ATPase活性增加[40],本试验中河水转运后瓦氏雅罗鱼鳃、肠和肾Na+/K+-ATPase活性显著升高是一致的, 这似乎也证实PRL和IGF-1均可通过调控Na+/K+-ATPase的表达而参与低渗环境下离子的调节。但IGF-1和PRL的作用似乎是短暂的, 因为洄游到河水中后瓦氏雅罗鱼3种激素水平与洄游前无显著差异, 表明IGF-1和PRL在瓦氏雅罗鱼从湖到河洄游的早期阶段起到调控作用, 而当体内离子水平达到稳态时, 激素水平也适应性降低。还需要说明的是, 与大麻哈鱼的溯河洄游相似, 瓦氏雅罗鱼从达里湖洄游到贡格尔河的过程中, 不仅渗透环境发生改变, 同时伴随着性腺的发育成熟和饵料的缺乏, 机体需要动员所有能量以维持溯河洄游和产卵行为以及基础代谢对能量的需求。因此, 激素水平的变化也可能是对体内代谢发生改变后的综合响应。
3.4 瓦氏雅罗鱼生殖洄游过程中鳃组织结构变化
鱼类的鳃上皮主要由泌氯细胞和扁平细胞构成, 对鳃生理功能的正常发挥起着重要的作用[2]。氯细胞在盐水环境中主要参与盐的排泄, 而在淡水环境中主要参与离子的吸收[2], 且在不同渗透环境条件下氯细胞的形态结构、分布和数量会发生适应性变化, 但不同种类间存在着一定差异[41]。本研究发现, 瓦氏雅罗鱼鳃氯细胞数量在达里湖和贡格尔河中未见明显差异, 但在河水中氯细胞体积比湖水中略大, 这一结果与Oǧuz[4]对凡湖塔氏卡拉白鱼(Chalcalburnus tarichi)的研究结果相似。氯细胞中含有大量的Na+, K+-ATPase, 是氯细胞进行离子转运的重要能量来源[41], 通常氯细胞数量和形态与Na+, K+-ATPase表达在环境盐度改变后响应一致。在本试验中达里湖瓦氏雅罗鱼鳃氯细胞数量在湖中和洄游到河中后未见明显变化, 这与鳃Na+, K+-ATPase活性无显著改变的结果是一致的, 而肠和肾组织中Na+, K+-ATPase活性显著升高, 表明在湖水中鳃氯细胞可能在Na+、Cl-离子的排泄过程中发挥重要作用, 而洄游到河水中后可能主要是肠和肾组织参与离子的吸收。
黏液细胞是普遍存在于水生动物上皮中的一种腺体细胞, 能分泌黏液于上皮表面, 黏液中含有黏多糖、糖蛋白、免疫球蛋白及各种水解性酶类等多种活性物质[42], 起到润滑、保护和抑制微生物的作用[41]。本试验结果发现, 在达里湖中瓦氏雅罗鱼鳃基底膜上分布着大量的黏液细胞, 而洄游到贡格尔河后仅见少量黏液细胞存在。鳃黏液细胞数量受水环境盐度影响已被报道, 如将大西洋鲑从海水转入淡水中3h后, 鳃黏液细胞数量显著增加[43];将红大麻哈鱼从淡水转入海水中后, 鳃上皮黏液细胞数量增加[44], 但这些研究均指出黏液细胞数量的变化还受到适应盐度和盐度适应过程的影响[43]。因为氯细胞的离子转运功能已被广泛证实, 而研究发现许多氯细胞存在顶隐窝, 而顶隐窝中充满黏液样物质; 另外, 上皮细胞中糖萼类物质也曾被认为可能参与离子调节[45], 这些证据使得较多研究均指出黏液可能在鱼类离子调节过程中发挥重要作用,但到目前为止, 仍没有直接的试验予以证实。因此,达里湖瓦氏雅罗鱼鳃黏液细胞在湖水中是否参与离子调节及其可能机制尚不清楚, 今后仍需进行深入研究。
4 结论
瓦氏雅罗鱼从高离子环境的达里湖洄游到低离子环境的贡格尔河, 在这一过程中其离子调节相关生理功能发生适应性变化以调节体内外的离子平衡, 通过提高血清PRL和IGF-1水平, 进而介导鳃、肠和肾组织中Na+/K+-ATPase活性增加, 从而维持鱼体较高或稳定的血清离子水平。

