‘京白梨’优良单株组织培养高效快繁体系构建
刘 春,高同雨,苏本营,李锦锦,李 晶,武雅娟,王 巍,沈应柏
(1.北京市门头沟区国家生态修复科技综合示范基地,北京 102300;2.淮北师范大学,安徽淮北 235000;3.北京林业大学生物科学与技术学院,北京 100083)
‘京白梨’属于秋子梨(Pyrus ussuriensis)的一个优良品种,是北京市地理标识性水果之一,栽植历史悠久,迄今已有400多年。在北京的栽培区域主要包括门头沟区妙峰山镇、军庄镇和房山区琉璃河镇等,在我国的河北、辽宁、山西等地也有栽培。‘京白梨’果实口味细腻独特,是具有重要价值的水果品种,深受广大消费者喜爱。随着‘京白梨’在市场上供不应求,其市场价格也在逐年提高,给北京‘京白梨’产区带来了良好的经济效益。但是由于病害、栽培管理粗放、不注重保存优良种质资源等原因,目前‘京白梨’品种退化日益严重,出现风味变淡、果形较小、畸形果增多等现象[1],严重制约了其产业化发展,急需通过科学技术手段加快‘京白梨’优良植株繁育。
20世纪30年代,Tukey进行了梨胚胎培养并获得成功[3]。梨及其砧木的繁殖多采用嫁接方法,70年代后关于梨与砧木的组织培养和离体快繁的报道增多,美国和意大利最早使用离体快繁技术对梨及砧木进行商业性生产。1975年,前苏联学者进行洋梨幼胚培养获得植株[3]。David与赵惠祥从茎尖培养中,分别得到试管苗和完整的植株。此外还进行了下胚轴,子叶横切段的培养,都成功获得了不定芽[3]。现阶段梨的组织培养工作主要集中在叶片培养和茎尖培养两个方面。研究结果表明,品种和器官的外植体不同,所采用的培养基种类、植物生长调节剂的比例和浓度、培养条件也不同。不同的培养基条件对梨的组织培养有很大影响,韩继成等[4]通过试验表明,梨的两个品种冀蜜和丰水分别以N6,NN60,MS为培养基,附加相同的条件(TZD1 mg/L+IBA 0.5 mg/L+CH 250 mg/L+S.30 mg/L+A.5 mg/L),结果在NN60培养基上获得了最佳效果,不定芽的诱导率为100%。
目前对‘京白梨’优良单株组织培养快繁技术的研究报道较少,研究‘京白梨’的组织快繁体系,包括消毒方式、外植体筛选以及增殖和生根培养基配比,具有一定的生产实践意义。通过组培快繁技术获得脱毒苗,可以减少梨树自身潜隐病毒带来的危害,为‘京白梨’优良植株种质资源保存和繁育提供理论基础和技术支撑,同时,也可为解决北京地区‘京白梨’品种退化提供有效途径,从而推动‘京白梨’产业化发展。
1 材料和方法
试验于2018年4月至2019年6月在北京市门头沟区科技开发试验基地组培实验室内进行。
1.1 试验材料
植物材料:选用‘京白梨’优良单株‘孟3’为试验材料,外植体选用枝条水培萌发出的幼嫩芽尖和春季树体萌发的幼嫩新梢。
化学药剂及材料:75%酒精、2%次氯酸钠、琼脂糖、MS培养基、NAA、IBA、IAA、GA3、蔗糖、氢氧化钠、盐酸、蒸馏水、抗坏血酸、活性炭、PVP(聚乙烯吡咯烷酮)、蛭石、营养土。
1.2 试验处理与方法
1.2.1 外植体消毒方式筛选
采集‘京白梨’优株‘孟3’枝条,经水培抽芽后,每个瓶内接种3个‘京白梨’花芽和叶芽,5瓶为一个生物学重复,14 d后观察外植体污染结果。采用2%的次氯酸钠和0.1%的升汞溶液进行消毒处理。
1.2.2 组培外植体筛选
外植体采用带芽的越冬枝条以及水培抽出的花芽,接种到相同的培养基中,观察生长情况,统计污染率。
1.2.3 花芽愈伤组织培养基筛选
采用以下MS和1/2 MS两种培养基配制方法,30 d后观察花芽愈伤组织诱导情况。
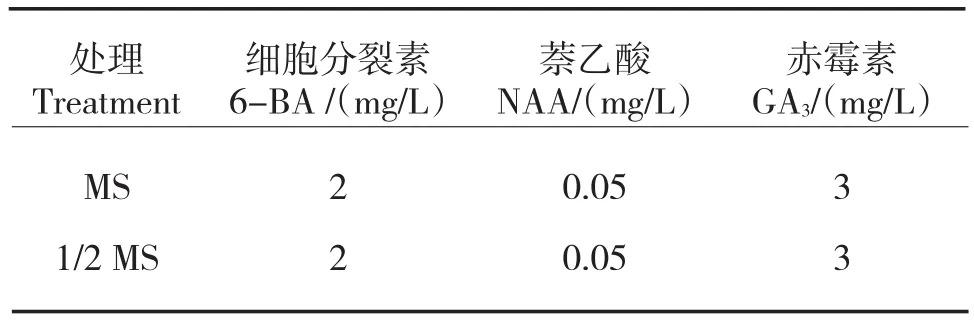
表1 不同培养基花芽愈伤组织诱导处理Tab.1 Treatment of callus induction of flower buds in different mediums
1.2.4 ‘京白梨’组培快繁培养基优化
外植体选用‘京白梨’水培萌动的嫩芽,设计不同条件的培养基,包括MS类型,不同激素及浓度处理,通过观察组培苗增殖生根情况,筛选出最优培养基方案(表2、3)。
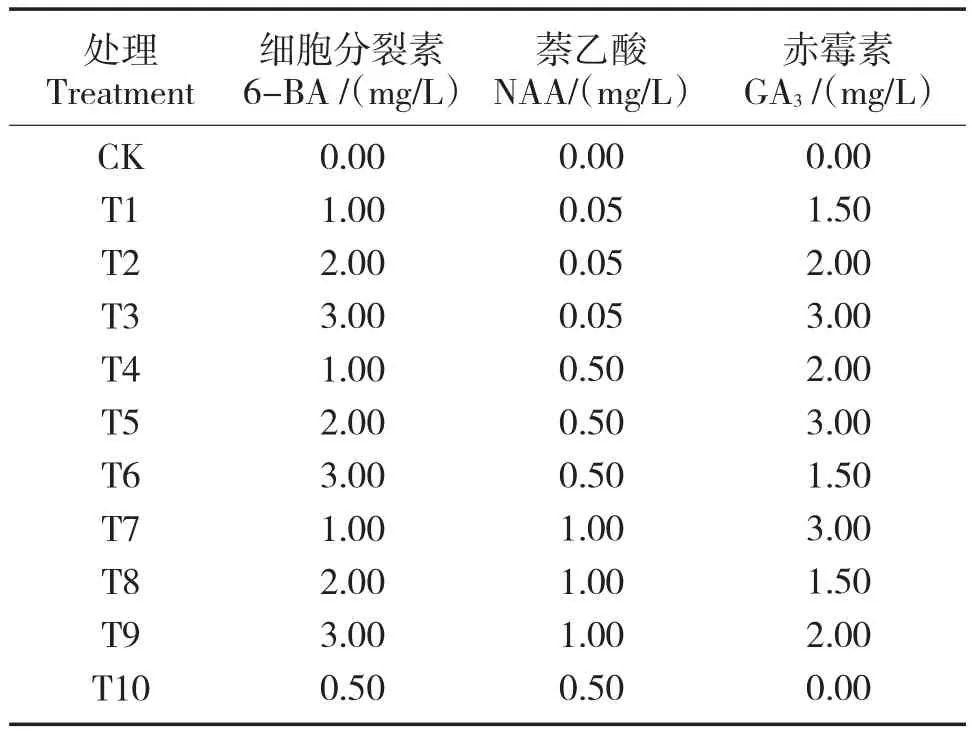
表2 组培苗增殖不同激素处理Tab.2 Different hormone treatments for proliferation of tissue culture seedlings
1.2.5 数据处理方法
通过Excel 2013进行数据的整理计算;采用DPS 7.05统计软件进行方差分析,采用单因素方差分析各处理差异的显著性水平,采用最小显著差数法(P<0.05,LSD)进行不同处理间均值的显著性差异比较。
污染率(%)=(污染外植体/接种外植体总数)×100;分化率(%) =(已分化的外植体数/接种外植体总数)×100;增殖率(%)=(处理后的有效芽数/接种外植体总数)×100。
2 结果与分析
2.1 外植体消毒方式对污染率的影响
外植体接种14 d后观察结果,采用2%浓度次氯酸钠的消毒方式污染率为33%,采用0.1%升汞的消毒方式污染率为18%。

表3 不同激素处理下‘京白梨’组培苗生根的培养基Tab.3 Mediums for rooting of tissue culture seedlings of‘Jingbaili’treated with different hormones
2.2 不同外植体的接种对比分析
外植体直接采用带叶芽及花芽的老枝条,经消毒接种到培养基后污染率达到93.3%;而选用新发的花芽及嫩芽试验,污染率为0。‘京白梨’组培试验中外植体的选择应避免使用老枝条,尽量选用刚萌动的嫩梢和花芽。
2.3 不同培养基对花芽愈伤组织形成的影响
在1/2 MS培养基中的‘京白梨’花芽外植体形成的愈伤组织比MS数量多,MS愈伤组织分化率为33.3%,在1/2 MS培养基中愈伤组织的分化率为60%。但是在1/2 MS中的愈伤组织出芽率较低。
2.4 赤霉素浓度对花芽愈伤组织诱导的影响
30 d后观察外植体生长状况,结果表明花芽在3 mg/L(图1b)和1.5 mg/L(图1c)赤霉素浓度中均能诱导出愈伤组织,其中在1.5 mg/L浓度中生长良好,愈伤组织诱导个数较多,45 d后花芽愈伤组织分化出完整植株(图1a)。

图1 不同浓度赤霉素的‘京白梨’培养情况Fig.1 Culture of‘Jingbaili’with different concentrations of GA3
2.5 组培快繁技术培养基的优化
2.5.1 激素处理浓度对嫩梢外植体愈伤组织增殖的影响
不同处理间组培苗生长情况(表4),愈伤组织个数以T3、T9处理最高,约10个,其次为T6、T4处理,约为9个,与CK相比具有显著性差异;不定芽个数以T6处理最高,约为14个,其次为T3,约为13个,与CK相比具有显著性差异;增殖率以T6、T3处理最高,分别为94%、92%,显著高于CK;芽长度以T2、T4、T5处理最大,均为0.58cm,与CK相比具有显著性差异。
综合以上指标以及组培苗后期生长情况(表5),采用3 mg/L 6-BA+0.5 mg/L NAA+1.5 mg/L GA3培养基最有利于组培苗增殖。
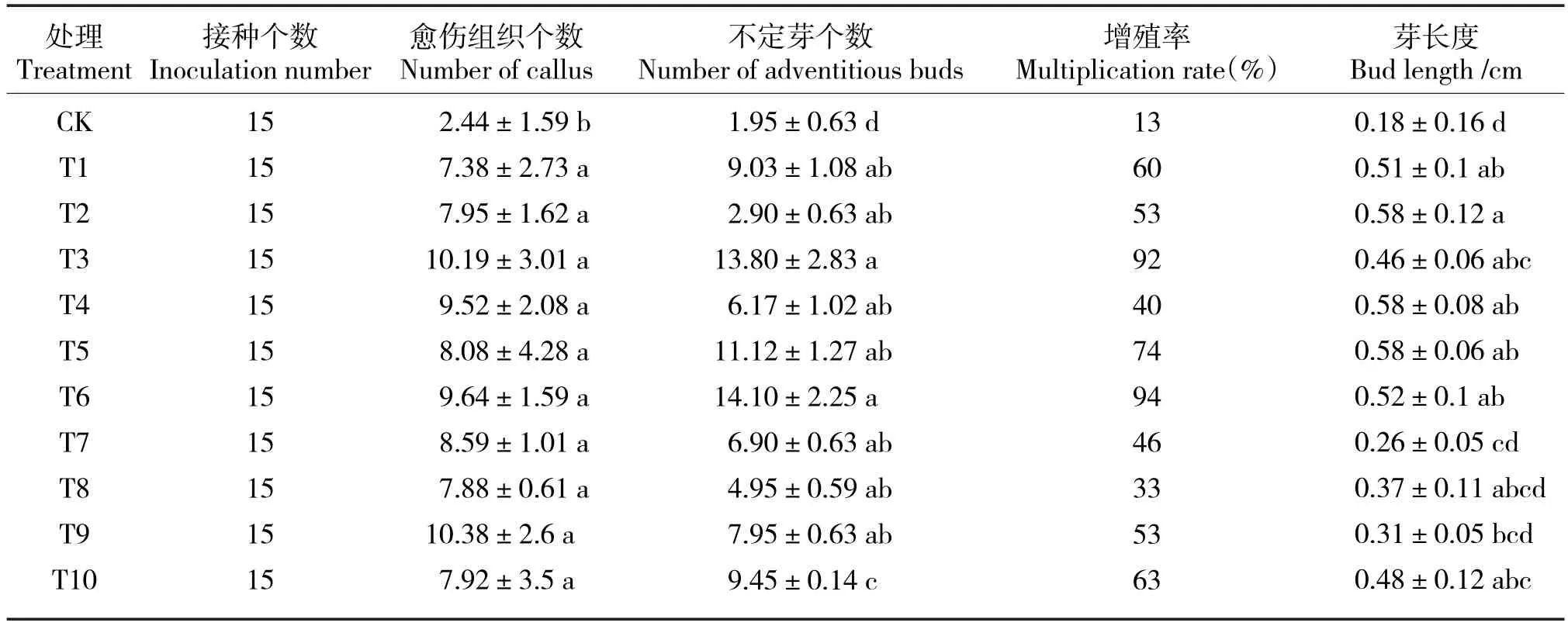
表4 不同激素处理对‘京白梨’外植体组培苗生长影响Tab.4 Effects of different hormone treatments on explants growth of‘Jingbaili’

表5 不同激素处理的‘京白梨’外植体组培苗30 d生长特征Tab.5 Growth characteristics of‘Jingbaili’explants treated with different hormone treatments for 30 days
2.5.2 激素处理浓度对组培苗生根的影响
组培苗生根试验主要是通过NAA、IAA、IBA不同生长激素的浓度处理,以及使用不同类型的MS(MS、1/2 MS、1/4 MS)接种。
S3、S5、S7、S9生根培养基中,在15 d观察期内,发现组培苗基部有根原基形成,但在此期间未诱导形成根。其中1/4 MS培养的‘京白梨’组培苗叶片在生长过程中出现发黄的现象。
45 d观察后(图2),S10、S11培养基中的‘京白梨’组培苗成功诱导生根,NAA激素浓度控制在0.5~1范围内都可以促进根系生成,但形成的根系较脆,移栽时容易断裂。

图2 ‘京白梨’组培苗诱导生根生长情况 (45 d后)Fig.2 Rooting growth of'Jingbaili'tissue culture seedlings(45 days later)
3 讨论
植物不同部位器官发育程度、遗传因素等生理状况存在一定差异性,因此,不同器官组织的外植体增殖系数存在一定差异性,多则可分化5~6个芽,少则分化1~2个芽,甚至无增殖现象。适宜外植体的选择对离体组织培养成功至关重要,王萍等[5]以马铃薯的幼叶、茎段、微型和种薯的块茎为外植体进行诱导愈伤组织和植株再生试验,结果表明马铃薯的分化率在不同外植体间差异较大。本研究发现,选用‘京白梨’优良植株老枝条为外植体进行接种污染率显著高于嫩梢,因此在外植体的选择上应尽量采用‘京白梨’植株幼嫩组织,如花芽或刚萌发的嫩梢。植物不同外植体分化成芽体的时间也存在较大差异,陈桂敏等[6]利用蝴蝶兰的茎尖、根尖、叶片、花、花梗等外植体进行组培繁殖,发现不同外植体的增殖速度和增殖系数各有差异,其中花梗诱导花梗腋芽效果最佳,其它部位不能诱导原球茎。本研究发现,‘京白梨’优良植株花芽愈伤组织分化成芽体的时间与嫩梢相比较晚,且不同器官的外植体增殖部位有差异性,有的从侧芽增殖,有的从基部愈伤组织增殖。
筛选合适的培养基对植物组织培养具有重要意义。不同的培养基对外植体愈伤组织的诱导情况是有所差别的,如MS培养基容易诱导出愈伤组织,而B5培养基只能够形成芽点和根。高疆生等[7]对1/2 MS、MS等几种培养基的梨外植体芽增殖率作了比较,发现MS培养基增殖率为15%~25%,1/2 MS培养基为70%。本试验结果表明采用1/2 MS培养基有利于‘京白梨’花芽愈伤组织的形成,但MS培养基有利于组培苗后期生长,原因可能是前期的愈伤组织对MS大量元素要求不高,但后期组培苗的生长需求MS量加大,以支撑苗株后期生长。
外源激素作为植物主要的生长调节剂,对组培苗的诱导分化、增殖和生根起到关键性的作用。在梨的组培试验中,愈伤组织的形成、芽的分化、增殖系数与外源激素的种类、浓度及各激素间的配比有很大关系[8]。本试验中,发现1.5 mg/L浓度GA3可能对组培苗的生长有一定影响,低浓度的生长调节剂NAA能促进茎干的分支。本试验中6-BA、NAA、GA3不同配比对梨的增殖效果明显,结果表明在6-BA浓度不变的条件下,降低NAA浓度、提高GA3浓度或提高NAA浓度、降低GA3浓度均能促进梨组培苗的增殖。外源激素梯度处理可在今后试验中继续优化,增加其它几种激素的处理,如TDZ等,进一步观察这些激素在不同水平下对组培苗生长的影响。
梨属于难生根植物,只有极少数品种生根容易,绝大部分梨品种生根较难[9]。‘京白梨’诱导生根试验中,S10、S11培养基中的‘京白梨’组培苗成功诱导出根系,证明在0.5~1 mg/L浓度范围内的NAA适合‘京白梨’组培苗根系生长。‘京白梨’组培苗生根培养基S1~S9目前只能形成根原基,尚未成功诱导成根,梨组培苗生根条件比较复杂,与温度、光照、激素水平、碳源等外界条件有关。
本研究构建‘京白梨’优良单株组织培养高效快繁体系,通过研究不同外植体、消毒方式,以及不同激素处理对组培增殖生根的影响,为‘京白梨’的离体培养提供理论基础和科学依据。近阶段,随着基因工程和生物技术的广泛应用,梨的离体培养在基因工程育种中应用逐渐增多[10-14]。梨组培过程中不易生根,很难在生产实践中应用,且不同品种间的梨树基因型的差异性[15-17]增大了梨树离体培养体系构建的难度。因此,在今后的探索研究中,不断改进组培技术,减少试验成本,解决组培实际存在的问题将是今后努力发展的方向。
4 结论
选取水培枝条8~15 d后萌发的新嫩梢和茎尖作为外植体进行接种试验,可有效减少污染率,提高‘京白梨’组培苗脱毒繁育成功率;‘京白梨’花芽愈伤组织在1.5 mg/L浓度赤霉素中生长良好,分化个数较多;采用3 mg/L 6-BA+0.5 mg/L NAA+1.5 mg/L GA3培养基对‘京白梨’组培苗愈伤组织形成、不定芽生长个数、增殖率、芽长度、叶片生长情况均有良好的促进作用,其中T10培养基更有利于新生枝干的萌发;在生根培养过程中,S10、S11培养基中的‘京白梨’组培苗在45 d后成功诱导生根。因此,‘京白梨’优良单株组织培养快速繁育可以通过以植株幼嫩组织作为外植体、以2%的次氯酸钠作为消毒剂、采用3 mg/L 6-BA+0.5 mg/L NAA+1.5 mg/L GA3作为增殖培养基、S10和S11作为生根培养基等来实现。

