玉米肽对乙醇氧化损伤模型小鼠的抗氧化作用研究
李雍,林峰,秦勇,刘伟,周雅琳,李睿珺,于兰兰,许雅君,4,
(1.北京大学公共卫生学院营养与食品卫生学系,北京 100191;2.北京中医药大学中药学院,北京 100029;3.正生营养研究院,新疆 昌吉 830000;4.食品安全毒理学研究与评价北京市重点实验室,北京 100191)
近年来随着我国酒类产量的不断增加,饮酒率及酒精性肝病的发病率也在逐年增长[1],而酒精的过量摄入及长期低剂量摄入对人类身体健康都有极大危害。酒精性肝病(alcoholic liver disease,ALD)是指由于长期大量摄入酒精而导致肝脏损害的一系列病变[2]。该病主要由促进脂肪变性过程的酒精代谢副产物驱动,可导致脂肪性肝炎、纤维化、肝硬化、肝功能衰竭,甚至肝癌[3]。现今,临床上的很多治疗肝损伤的药物所带来的毒副作用不容回避,而充分利用天然植物资源,开发具有保肝作用的植物资源,可以为新型保肝药提供理论基础。
我国玉米资源丰富,生产淀粉一直以来都是其最大的商业开发途径,而生产所得副产物——玉米麸质粉中醇溶蛋白的高憎水性,限制了它在食品中的广泛应用[4],而将玉米蛋白水解制成的玉米肽当前已被证明有着抗氧化、醒酒、降低血清中胆固醇浓度等多种保健食品的优良特性,本研究采用新疆地区特有的粉质型玉米品种,立足于该地区特色植物多肽的功效研究,着力为开发其特色玉米品种的保健应用提供新思路,为该拓宽地区特色玉米的商业用途提供理论基础的同时,也为保肝护肝药资源的开发提供了优质的天然植物资源,拉动了新疆地区农业经济发展并促进该地区维稳工作的进行。
1 材料与方法
1.1 材料与试剂
玉米肽以玉米黄粉为加工原料,经蛋白分离纯化、酶解、纯化、干燥等步骤获得。其相对分子质量<1 000 D,由2~6 个氨基酸构成,可不经消化,直接吸收供组织利用。凝胶色谱图见图1。
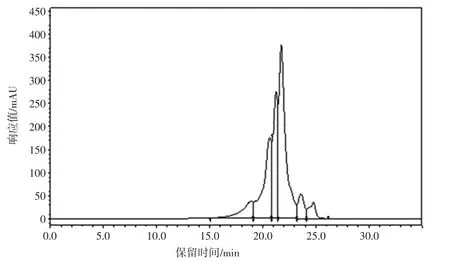
图1 玉米肽凝胶色谱图Fig.1 Corn peptide gel chromatogram
酪蛋白(Sigma C5890):Sigma 公司。
健康成年SPF 级ICR 雄性小鼠50 只,使用许可证号:SCXX(京)2016-0010,体质量(25.0±5.0)g;受试动物由北京大学医学部实验动物科学部提供,动物饲喂于屏障环境中。环境温度为(23±2)℃,湿度50%~60%,明暗交替 12 h ∶12 h。
谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)测试盒、丙二醛(malondialdehyde,MDA)测试盒、谷胱甘肽(glutathione,GSH)测试盒、总超氧化物歧化酶(total superoxide dismutase,T-SOD)测试盒、蛋白质羰基(protein carbonyl,PC)测试盒、蛋白定量测试盒:南京建成生物工程研究所;其他试剂均为分析纯。
1.2 仪器与设备
AR1140 电子分析天平:奥豪斯国际贸易(上海)有限公司;FLUO star Omega 多功能酶标仪:BMG LABTECH Inc.;BFX5-320 型低温自动平衡离心机:白洋离心机厂;Allegra X-30R 台式高速冷冻离心机:BECKMAN COULTERTM;HH·S11-1 电热恒温水浴锅:北京长安科学仪器厂。
1.3 方法
1.3.1 动物分组
50 只雄性ICR 小鼠经1 周适应期后,称重并按体重随机分为5 组,分别为空白组、模型组、玉米肽低、中和高剂量组,每组各10 只。各组均给予维持饲料,自由进食、饮用无菌去离子水。
1.3.2 造模及给药
实验期间每天早上 8:00~10:00 对小鼠灌胃,对各剂量组灌胃给药不同剂量受试样品,其中低剂量组:0.4 g(/kg·bw)、中剂量组:0.8 g(/kg·bw)、高剂量组:1.6 g(/kg·bw),对照组和模型组给予等体积的酪蛋白1.6 g(/kg·bw),以灌胃容量0.1 mL/10 g 连续灌胃30 d,并根据体质量来调整灌胃剂量,灌胃期间自由取食和饮水。实验时间30 d。间隔5 d 称重并记录其体重与摄食量。末次灌胃后除对照组外,其他4 组禁食16 h,然后一次性经口灌胃给予50%乙醇12 mL(/kg·bw)。
1.3.3 测试样品制备及指标检测
模型对照组和实验组灌胃乙醇6 h 后,摘眼球取血处死,血液分全血和血清两部分进行收集,其中一部分采用0.5 mL 离心管收集,3 000 r/min 离心10 min,取上清液备用(用于检测血液T-SOD 和丙二醛含量),另一部分用1.5 mL 抗凝管收集全血备用(用于检测血液 GSH-Px 和 GSH 含量)。
解剖小鼠取肝脏并准确称取4 份0.1 g 的肝脏组织,其中3 份加入9 倍体积的生理盐水(用于测肝脏GSH、T-SOD、GSH-Px、MDA),另外一份加入蛋白质羰基含量测试盒试剂一(用于测肝脏蛋白质羰基含量),制成10%的组织匀浆液后,2 500 r/min 离心10 min,取上清液备用。最后对小鼠的肝组织及血液中的指标采用测试盒说明书要求进行统一测定。
1.4 数据处理
本实验结果均为连续变量,以均数±标准差(Mean±SD)表示。所有数据使用SPSS22.0 软件进行统计分析。组间差异利用单因素方差分析(one-way ANOVA)处理,以p <0.05 作为具有统计学意义的差异判断标准。采用最小显著差数法(least significant difference,LSD)在方差齐时进行两两比较;采用Tamhane’s 法在方差不齐时进行比较。
2 结果与分析
2.1 玉米肽对小鼠体重及食物利用率的影响
实验动物体重在实验开始时均无显著性差异(p>0.05)。其体重及食物利用率在各组的变化结果见图2和图3。
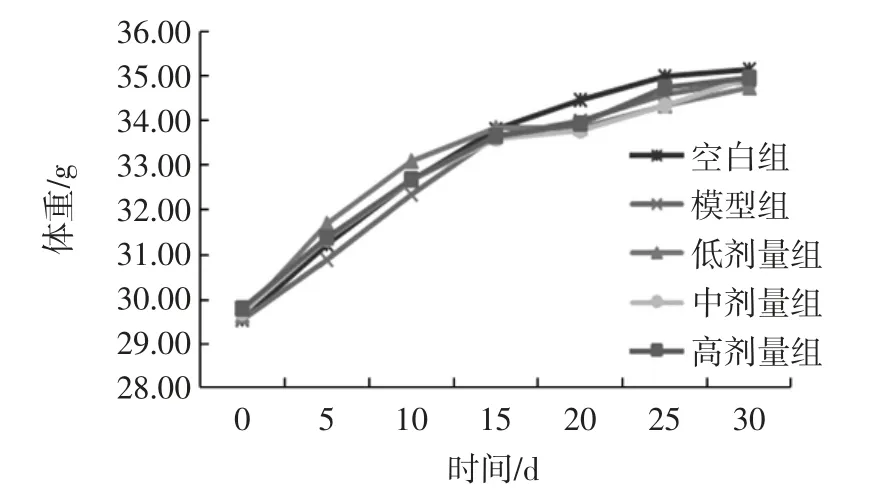
图2 玉米肽对小鼠体重的影响Fig.2 The effect of corn peptide on the weight of mice
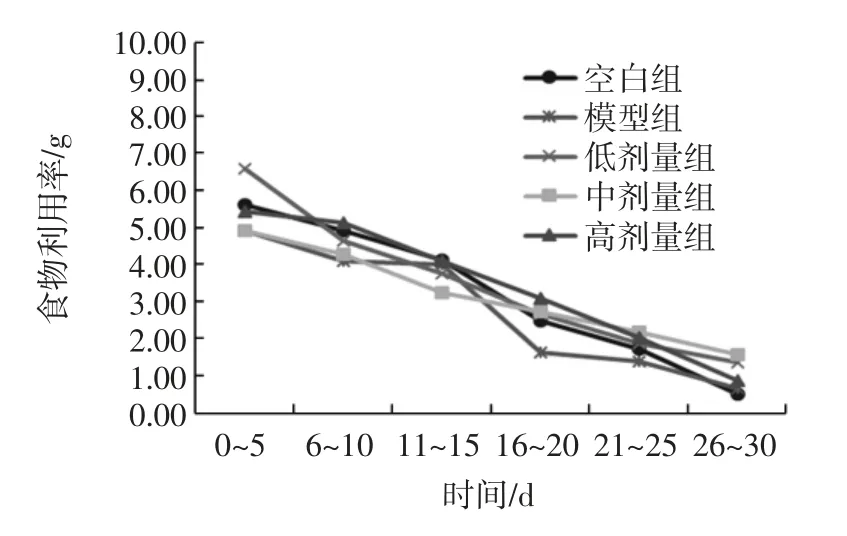
图3 玉米肽对小鼠食物利用率的影响Fig.3 Effect of corn peptide on the utilization rate of food in mice
由图2、图3可得,小鼠的体重随着时间的延长而增长,各组的食物利用率及净增体重无显著性差异(p>0.05),各组动物在实验过程中无表现异常,这说明玉米肽在实验剂量范围内对小鼠正常生长无影响,玉米肽对动物的生长发育无不良影响。
2.2 玉米肽对小鼠抗氧化物质GSH含量的影响
小鼠体内全血和肝脏抗氧化物质GSH 含量结果如表1所示。
表1 玉米肽对小鼠抗氧化物质GSH 的影响(±SD,n=10)Table 1 The effect of corn peptide on mice in whole blood and liver tissue GSH(±SD,n=10)

表1 玉米肽对小鼠抗氧化物质GSH 的影响(±SD,n=10)Table 1 The effect of corn peptide on mice in whole blood and liver tissue GSH(±SD,n=10)
注:#、*表示较之正常对照组/模型对照组p<0.05,差异显著;**表示较之正常对照组/模型对照组p<0.01,差异极显著。
组别全血/(g/L)肝脏/(mg/gprot)空白对照组 0.23±0.04 1.42±0.35模型对照组 0.19±0.04# 0.71±0.07#玉米肽低剂量组 0.23±0.04* 0.77±0.08玉米肽中剂量组 0.23±0.04* 1.00±0.24*玉米肽高剂量组 0.22±0.025** 1.25±0.23
模型组全血和肝脏中GSH 的含量显著低于空白对照组(p<0.05);全血中的GSH 含量在各剂量组中均较之模型组显著提升(p<0.05),同时中剂量组肝组织的GSH 含量较之模型组也表现出了显著上升(p<0.05)。
2.3 玉米肽对小鼠抗氧化酶SOD活力的影响
小鼠血清和肝组织SOD 含量见表2。
表2 玉米肽对小鼠抗氧化酶SOD 活力的影响(±SD,n=10)Table 2 Effect of corn peptide on mice in serum and liver tissue SOD(±SD,n=10)
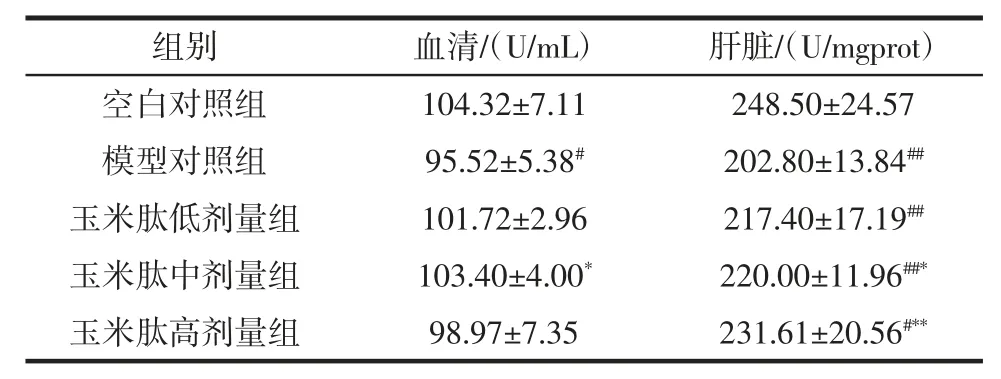
表2 玉米肽对小鼠抗氧化酶SOD 活力的影响(±SD,n=10)Table 2 Effect of corn peptide on mice in serum and liver tissue SOD(±SD,n=10)
注:#、*表示较之正常对照组/模型对照组p<0.05,差异显著;##、**表示较之正常对照组/模型对照组p<0.01,差异极显著。
组别血清/(U/mL)肝脏/(U/mgprot)空白对照组 104.32±7.11 248.50±24.57模型对照组 95.52±5.38# 202.80±13.84##玉米肽低剂量组 101.72±2.96 217.40±17.19##玉米肽中剂量组 103.40±4.00* 220.00±11.96##*玉米肽高剂量组 98.97±7.35 231.61±20.56#**
模型组较之空白对照组血清和肝组织中的SOD活性显著降低(p<0.05);而各剂量组与模型组比较,中剂量组在血清SOD 酶活性有显著提升(p<0.05),肝脏中SOD 酶活性的显著提升也在中、高剂量组有所体现(p<0.05)。
2.4 玉米肽对小鼠抗氧化酶GSH-Px活力的影响
小鼠全血和肝组织中GSH-Px 酶含量结果见表3。
表3 玉米肽对小鼠抗氧化酶GSH-Px 活力的影响(±SD,n=10)Table 3 Effect of corn peptide on mice in whole blood and liver tissue GSH-Px(±SD,n=10)
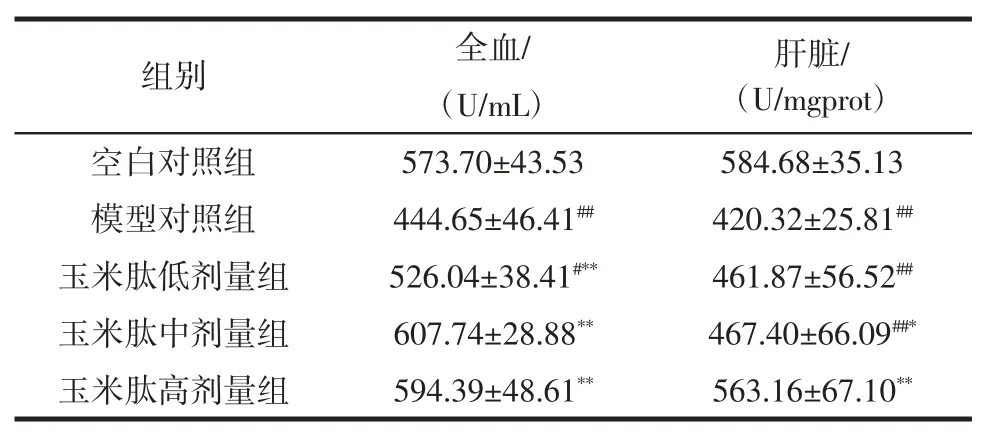
表3 玉米肽对小鼠抗氧化酶GSH-Px 活力的影响(±SD,n=10)Table 3 Effect of corn peptide on mice in whole blood and liver tissue GSH-Px(±SD,n=10)
注:#、*表示较之正常对照组/模型对照组p<0.05,差异显著;##、**表示较之正常对照组/模型对照组p<0.01,差异极显著。
肝脏/(U/mgprot)空白对照组 573.70±43.53 584.68±35.13模型对照组 444.65±46.41## 420.32±25.81##玉米肽低剂量组 526.04±38.41#** 461.87±56.52##玉米肽中剂量组 607.74±28.88** 467.40±66.09##*玉米肽高剂量组 594.39±48.61** 563.16±67.10**组别 全血/(U/mL)
较之正常对照组,模型对照组全血和肝组织中的GSH-Px 活性显著降低(p<0.01);全血中各剂量组提升GSH-Px 酶活性效果显著(p<0.01),而肝脏中玉米肽中、高剂量组也表现出了显著的差异(p<0.05)。
2.5 玉米肽对小鼠过氧化脂质降解产物MDA含量的影响
小鼠血清和肝脏组织中的MDA 含量结果见表4。
模型组肝组织中MDA 含量较之空白对照组提升显著(p<0.01)。高剂量组血清MDA 含量显著低于模型组(p<0.05),而肝脏中虽然各剂量组相对于模型组MDA 含量均有减少趋势,但无显著差异(p>0.05)。
表4 玉米肽对小鼠脂质过氧化物MDA 含量的影响(±SD,n=10)Table 4 Effect of corn peptide on mice in serum and liver tissue MDA(±SD,n=10)
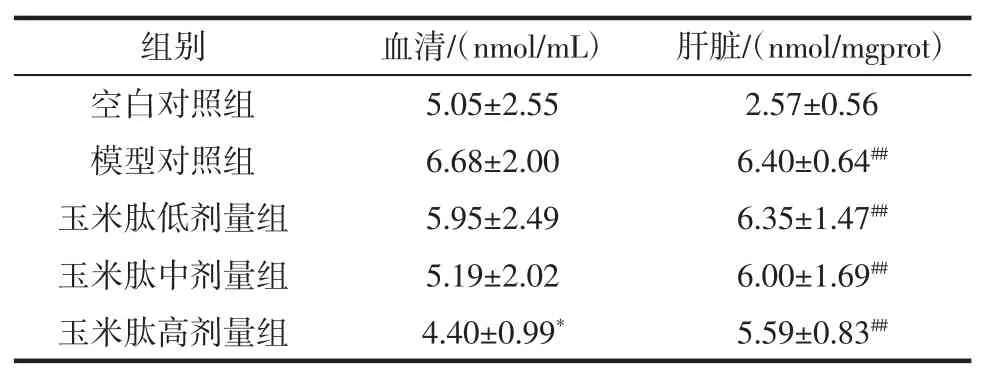
表4 玉米肽对小鼠脂质过氧化物MDA 含量的影响(±SD,n=10)Table 4 Effect of corn peptide on mice in serum and liver tissue MDA(±SD,n=10)
注:*表示较之模型对照组p<0.05,差异显著;##表示较之正常对照组p<0.01,差异极显著。
组别血清/(nmol/mL)肝脏/(nmol/mgprot)空白对照组 5.05±2.55 2.57±0.56模型对照组 6.68±2.00 6.40±0.64##玉米肽低剂量组 5.95±2.49 6.35±1.47##玉米肽中剂量组 5.19±2.02 6.00±1.69##玉米肽高剂量组 4.40±0.99* 5.59±0.83##
2.6 玉米肽对小鼠肝脏中PC含量的影响
机体PC 含量可以间接说明玉米肽抗氧化损伤的能力,结果见表5。
表5 玉米肽对小鼠肝脏蛋白质羰基含量的影响(±SD,n=10)Table 5 Effect of corn peptide on mice in liver tissue protein carbonyl(±SD,n=10)
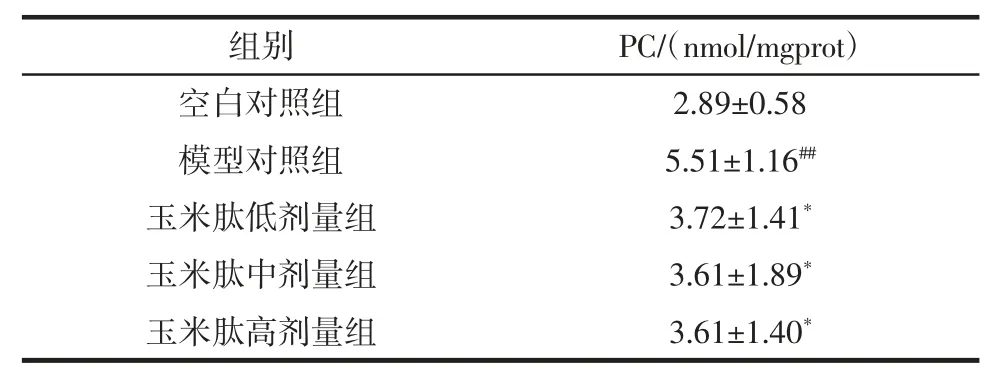
表5 玉米肽对小鼠肝脏蛋白质羰基含量的影响(±SD,n=10)Table 5 Effect of corn peptide on mice in liver tissue protein carbonyl(±SD,n=10)
注:*表示较之模型对照组p<0.05,差异显著;##表示较之正常对照组p<0.01,差异极显著。
组别PC/(nmol/mgprot)空白对照组 2.89±0.58模型对照组 5.51±1.16##玉米肽低剂量组 3.72±1.41*玉米肽中剂量组 3.61±1.89*玉米肽高剂量组 3.61±1.40*
较之正常对照组,模型组肝组织中的蛋白质羰基含量升高(p<0.01)。各剂量组肝组织中PC 含量显著(p<0.01)低于模型组。
3 讨论与结论
通过脱氢酶代谢乙醇转变为乙醛后继续代谢成乙酸盐,导致烟酰胺腺嘌呤二核苷酸产生,脂肪酸氧化抑制和脂肪积累,乙醇代谢后还原型辅酶Ⅰ(nicotinamide adenine dinucleotide,NADH)的生成增多,会增强呼吸链的活动,故氧化应激是酒精肝毒性的一个特征,同时也在酒精性肝病的发展中起重要作用[5]。本研究以小鼠肝脏和血液中的GSH、MDA 含量以及抗氧化酶系SOD、GSH-Px 的活性与肝组织蛋白质羰基(protein carbonyl,PC)含量为检测指标,探究玉米肽对小鼠乙醇氧化损伤模型的抗氧化程度。结果显示各指标模型组较之空白组均有显著差异,提示本实验造模成功,分析各指标可得,非酶类抗氧化剂GSH 和抗氧化酶系SOD 与GSH-Px 均在血清和肝脏中表现出显著的差异(p<0.01),此外肝组织PC 在各剂量组中均显示出了显著差异(p<0.05),而MDA 仅在高剂量组血清中有显著性差异(p<0.05),肝脏中未有任何显著性差异(p>0.05)。
本实验中的玉米肽平均相对分子质量低于1 000 D,由2~6 个氨基酸构成,可不经消化,直接吸收供组织利用,相关研究显示,水解玉米蛋白粉并经过正交试验后可获得抗氧化性大幅提升的玉米肽,其抗氧化活性与其相对分子质量具有相关性。DPPH 自由基的清除能力与其分子量显著相关,相对分子质量在5 000 D以下,随着相对分子质量的上升而下降[6]。结果表明玉米肽对乙醇诱导的氧化损伤模型小鼠具有抗氧化作用,这可能是通过提升其体积内抗氧化酶系活性、清除体内自由基等途径实现的。
乙醇诱导肝损伤中的氧化应激和自由基损伤作用一直被认为是极为重要的途径[7]。一旦出现促氧化剂和抗氧化剂之间的不平衡,作为氧化代谢的副产物产生的活性氧(reactive oxygen species,ROS)就会损害细胞大分子,例如DNA、脂质和蛋白质。研究表明乙醇摄入增加了脂质过氧化产物如MDA 的形成[7]。为了抵消这种氧化应激,细胞同时具有多种抗氧化酶系,其中主要是SOD 和GSH-Px,是细胞遭受氧化应激时进行抵御的重要酶系。由实验结果可得,MDA 含量在小鼠血清中降低显著(p<0.05),同时抗氧化酶系SOD 和GSH-Px 在小鼠体内均表现出了显著的活力提升(p<0.01),这表明玉米肽一方面可以激活体内抗氧化酶系,结合其氧化损伤后的自由基,同时可以通过自身直接结合自由基,来降低乙醇对肝脏的损害,降低膜脂损害后产生的大量MDA,进而在机体中起到抗氧化的作用。实验证据表明,GSH 是Nrf2 的靶关键解毒酶,Nrf2 是抗氧化反应的主要调节因子,在预防乙醇诱导的氧化应激和脂质积聚方面发挥着重要作用[8]。植物化学物质可以通过直接结合Keap1 激活Nrf2 共价连接,诱导解毒酶和相关蛋白,在保护细胞免受ROS 施加的自由基应激中起关键作用[9-10]。据此可以解释本实验中在GSH 含量上显示的显著(p<0.01)提高。除抗氧化酶系和膜脂受损的评价指标外,蛋白质作为功能繁多的生物大分子存在于体内,也是受到自由基攻击的主要目标,其侧链氨基酸的氧化是生命系统的重要信号,蛋白质受损的一个重要标志也就是蛋白质侧链羰基的形成。因此蛋白质羰基含量的测定是对衡量自由基对机体的损伤程度有着实际意义的指标[11]。本实验中玉米肽各剂量组均显著低于空白对照组(p<0.05),提示玉米肽可以自身结合自由基,在一定程度上防护机体蛋白质受自由基损害。
本实验结果显示在一定剂量下,由新疆地区特色粉质型玉米所研发的玉米肽具有抗氧化功能,这为该地区玉米开发具有保肝护肝及抗氧化功能产品提供了一定的理论依据,并拓展了该地区特色玉米品种的商业用途。

