浅析不同反应类型在滴定分析中的应用
王海龙


摘要:本文以典型习题为例,介绍了酸碱中和反应、氧化还原反应、沉淀反应、络合反应在滴定分析中的应用.通过对习题的详细分析,让学生更好的掌握不同类型滴定实验的分析方法和数据处理策略.有效的提升了学生的实验分析解答能力,拓展了学生的化学视野.
关键词:滴定实验;反应类型;化学视野
酸碱中和滴定是中学化学教材中重点介绍的一种定量分析方法.从近几年的高考化学试题中可以看出,滴定分析已经成为定量实验必考内容.但在高考试题中,却以其他反应为依托进行滴定实验的考查,体现了对学生知识迁移能力的考查.因此,在高考复习过程中,有必要从不同的化学反应类型对滴定实验进行拓展和延伸,以提高学生对滴定实验的分析能力.现以几题为例进行探讨.
1 酸碱中和反应
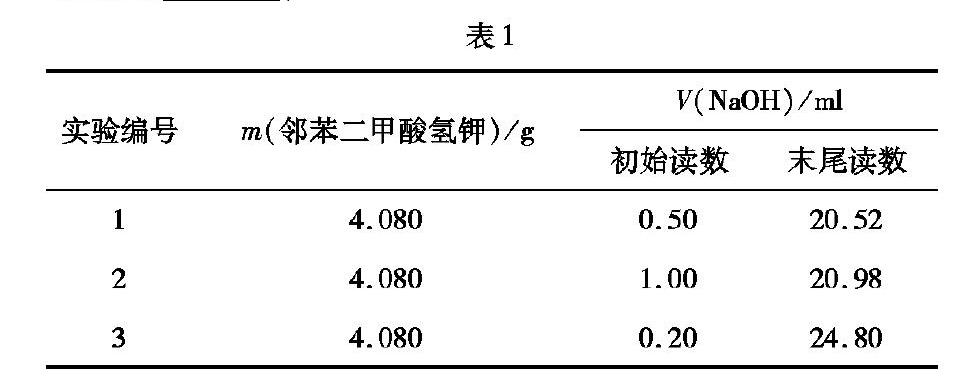
例1 滴定是一种化学实验操作也是一种定量分析的手段,它通过两种溶液的定量反应来确定某种溶质的含量,实验室常用邻苯二甲酸氢钾( KHCSH404)来标定氢氧化钠溶液的浓度,其操作过程为:
①准确称取4. 080g邻苯二甲酸氢钾加入250ml锥形瓶中;
②向锥形瓶中加30ml蒸馏水溶解;
③向溶液中加入1-2滴指示剂;
④用氢氧化钠溶液滴定至终点;
⑤重复以上操作;
⑥根据数次实验数据计算氢氧化钠的物质的量的浓度.
已知:I、到达滴定终点时,溶液的pH约为9.1.
Ⅱ、邻苯二甲酸氢钾在水溶液中可以电离出一个H+.
Ⅲ、邻苯二甲酸氢钾的相对分子质量为204.
请回答下列问题:
(1)为标定氢氧化钠溶液的浓度,应选用____作指示剂;
(2)完成本实验,已有电子天平、铁架台、滴定管夹、锥形瓶、烧杯等,还必须的仪器是:____;
(3)判断到达滴定终点的实验现象是____;
(4)在整个滴定过程中,两眼应该注视着____;
(5)滴定实验记录数据如下表,则NaOH溶液的浓度为____,
(6)滴定过程中,下列操作能使测定结果(待测液的浓度数值)偏小的是( )
A.上述操作中,将邻苯二甲酸氢钾直接放入锥形瓶中溶解
B.滴定管在滴定开始时尖嘴有气泡,滴定完成时气泡消失
C.滴定完毕,尖嘴外留有液滴或溶液滴在锥形瓶外
D.滴定前仰视读数而滴定终了俯视读数
【解析】
(1)已知到达滴定终点时,溶液的pH值约为9.1,结合指示剂的变色范围可知,应该选用酚酞作指示剂.
(2)根据操作过程可知,使用的仪器有:铁架台、滴定管夹、碱式滴定管、烧杯、锥形瓶、电子天平、量筒等,还缺少的仪器为:碱式滴定管、量筒、药匙,
(3)由于用氢氧化钠滴定邻苯二甲酸氢钾( KHC8H404)溶液,滴定结束前溶液为无色,滴定结束后溶液为浅红色,则滴定终点现象为:滴入最后一滴NaOH溶液,溶液由无色变为浅红色,且在半分钟内不褪色,
(4)滴定过程中,为了及时判断滴定终点,两眼应该注视锥形瓶内溶液的颜色变化.
(5)邻苯二甲酸氢钾的物质的量为:
(6)上述操作中,将邻苯二甲酸氢钾直接放入锥形瓶中溶解,不影响滴定结果,故A錯误;滴定管在滴定开始时尖嘴有气泡,滴定完成时气泡消失,导致消耗的待测液体积偏大,测定结果偏小,故B正确;滴定完毕,尖嘴外留有液滴或溶液滴在锥形瓶外,导致消耗的待测液体积偏大,测定结果偏小,故C正确;滴定前仰视读数而滴定终了俯视读数,导致读出的待测液体积偏小,测定结果偏大,故D错误,答案为:BC.
2 氧化还原反应
这类滴定依托于氧化还原反应,它以一种氧化剂或还原剂为标准液,采取直接或间接的方式对另一种具有还原性或氧化性的物质进行滴定,从而测出其浓度,这类滴定我们称其为氧化还原滴定,氧化还原滴定根据氧化剂的不同可分为高锰酸钾法、重铬酸钾法、碘量法、溴酸钾法等,最常用的也就是高锰酸钾法和碘量法.
例2 KMri04溶液常用作氧化还原反应滴定的标准液,由于KMri04的强氧化性,它的溶液很容易被空气中或水中的某些少量还原性物质还原,生成难溶性物质Mn0( OH)2,因此配制KMri04标准溶液的操作如下所示:
①称取稍多于所需量的KMn04固体溶于水中,将溶液加热并保持微沸1小时;②用微孔玻璃漏斗过滤除去难溶的Mn0(OH)2;③过滤得到的KMn04溶液贮存于棕色试剂瓶并放在暗处;④利用氧化还原滴定方法,在70 - 80℃条件下用基准试剂(纯度高、相对分子质量较大、稳定性较好的物质)溶液标定其浓度.
请回答下列问题:
(1)准确量取一定体积的KMn04溶液需要使用的仪器是____.
(2)在下列物质中,用于标定KMn104溶液的基准试剂最好选用
(填序号).
A.H2C204·2H20
B.FeS04
C.浓盐酸
D.Na2 S03
(3)若准确称取Wg你选的基准试剂溶于水配成500 mL溶液,取25.00 mL置于锥形瓶中,用酸性KMri04溶液滴定至终点,共消耗酸性KMn04溶液V mL.则酸性KMri04溶液的物质的量浓度为____mol/L.
(4)若用放置两周的酸性KMn04标准溶液去测定水样中Fe2+的含量,测得的浓度值将____(填“偏高”、“偏低”或“无影响”). 解析:(1)高锰酸钾溶液具有强氧化性,量取时应该选用酸式滴定管.
(2) H2C204.2H2O常温下是稳定的结晶水化物,溶于水后纯度高、稳定性好,可以用作基准试剂,故A正确;FeS04.7H20在空气中不稳定,亚铁离子容易被氧化成铁离子,不宜用作基准试剂,故B错误;浓盐酸不稳定,易挥发,不宜用作基准试剂,故C错误;Na2S03具有还原性,在空气中容易被氧化成硫酸钠,不宜用作基准试剂,故选A;
(3)滴定时滴入最后一滴,高锰酸钾不反应,溶液变成紫红色并保持半分钟不褪色,说明滴定到达终点;草酸的物质的量浓度为:
(1)滴定终点的现象是____.
(2)若用AgN03溶液滴定NaSCN溶液,可选为滴定指示剂的是____.
A. NaCI
B.BaBr2
C.Na2 Cr04
刚好达到滴定终点时,发生的离子反应方程式为____.
(3)用AgN03溶液滴定KCI等含氯离子溶液时常用K2 Cr04溶液做指示剂.锥型瓶中现有氯离子浓度约为0. Imol/LKCl溶液18. 90mL,向其中加入2滴(共0.1mL)O. 2mol/L的Na2Cr04溶液,然后用浓度约为0.1mol/LAgN03溶液进行滴定.试计算达到终点时溶液中氯离子的最大浓度,
解析(1)根据沉淀滴定法的原理,可知溶液中Ag+和Cl一先反应.Cl-消耗完后再和指示剂反应生成Ag2Cr04砖红色沉淀,由此可知滴定终点的现象.
(2)若用AgN03去滴定NaSCN溶液,可选用的滴定指示剂的物质的溶解度应比AgSCN大,且现象明显,应为Na2Cr04,混合物中有砖红色沉淀生成.4配位(络合)反应
络合滴定法是化学分析中最重要的滴定分析方法之一.它以络合反应为基础,在络合滴定分析中应用最广泛络合物的是乙二胺四乙酸,简称EDTA. ED-TA具有广泛的配位性能,几乎能与所有的金属离子形成螯合物.EDTA能与大多数金属离子形成1:1的络合物,它们之间的定量关系是:EDTA的物质的量等于金属离子的物质的量.
例4(2016年浙江高考29题节选)无水MgBr2可用作催化剂.实验室采用镁屑与液溴为原料制备无水MgBr2,为测定产品的纯度,可用EDTA(简写为y4-)标准溶液滴定,反应的离子方程式:Mg2++ y4-= Mg+ Y2-
①滴定前润洗滴定管的操作方法是____.
②测定前,先称取0. 2500g无水MgBr2产品,溶解后置于锥形瓶中,用0. 0500 mol.L-l的EDTA标准溶液滴定至终点,消耗EDTA标准溶液25.50mL,则无水MgBr2产品的纯度是____(以质量分数表示).
解析①滴定前润洗滴定管的操作是从滴定管上口加入少量待装液,慢慢倾斜滴定管,使液体流至管口处,注意不要使液体流出,旋转滴定管数周,然后将其竖起,打开玻璃塞或挤玻璃珠,清洗滴定尖嘴,最后把剩余液体从管口倒出,重复2—3次.
②依据方程式Mg2++ y4-= Mg+ y2-分析可知,n( MgBr2)=n(EDTA),n(MgBr2)=0.0500mol/L×0. 02550L=0.001275mol,m( MgBr2)=0.001275molx184g/mol=0.2346g,溴化鎂的产品的纯度=0.2346g÷0. 2500g×100%= 93. 8%.
从以上几种不同类型的反应在滴定实验中的应用可以看出:滴定分析实验可以借助不同的化学反应进行,但实验的原理及分析过程基本是相同的,只是在数据处理上略有不同.因此,在高考备考复习过程中,可以依托化学教材中的实验,对一些内容进行合理的拓展和延伸,既能有效提升学生对此类题目的解答能力,又对学生视野的拓展有所帮助.
参考文献:
[1]兰建新.高考化学试题中的中和滴定分析及其教学[J].化学教学,2015 (09):73 - 77.
[2]建国.酸碱中和滴定实验误差综合分析[J].侯甘肃教育,2008(01).

