便携式无燃料低温燃烧氧烛工艺研究
张彦军, 马军, 田涛, 宋振兴, 桑玮, 龚仕洪, 王宇航,黄维东, 吴昊, 向鑫, 李仁杰, 刘剑
(1.军事科学院 系统工程研究院 卫勤保障技术研究所, 天津 300161;2.西南科技大学 材料科学与工程学院, 四川 绵阳 621010)
0 引言
氧烛作为一种固态氧源,具有产氧量高、使用方便等特点[1],其蓄氧量与液态氧相当, 大约是同体积压缩氧气的3倍。由于固体氧烛比压缩氧和液态氧更安全,广泛用于飞行、潜艇、矿山救援等方面[2-4]。氧烛主要由氧盐、催化剂、黏结剂和抑氯剂组成。氧盐的主体成分为氯酸盐,其在高温时分解出氧气。早期氧烛采用能在较低温度下分解的氯酸钾氧盐,但由于其易吸湿、不易点燃等缺点,之后的盐柱改用氯酸钠。氯酸钠的分解温度约在500 ℃,高于其熔点(260 ℃),因此氯酸钠分解时容易流淌而影响氧烛燃烧的稳定性。氯酸盐分解为放热反应,为了维持氯酸钠的分解,需要在盐柱中加入金属燃料,利用金属燃烧释放的热量来维持氯酸钠的分解。常用燃料为金属、非金属单质粉末,如铁粉、镁粉、铝粉、钴粉、钛粉、硼粉等。金属燃烧时,局部会产生上千摄氏度的高温,氯酸钠在温度较高时会分解产生大量氯气,由于金属密度比氯酸钠高,燃烧时还会消耗氧气,金属燃料的加入会显著降低氧烛的体积产氧率。在工程应用中减少金属燃料的用量,不仅能减少氧烛产生的有害气体,还能提高氧烛的产氧率。使用催化剂可以降低氯酸盐的分解温度[5],常用的催化剂有铁、钴、镍、铜、 锰等过渡金属氧化物或相应的盐类,过渡金属氧化物有三维空轨道,能提供良好的电子转移,通常认为其催化机理是通过在氧化还原循环中加速电子转移,从而使氯酸钠在更低的温度下分解[6-8]。另外,某些碱金属过氧化物同样对氯酸盐的分解具有催化作用,如过氧化锂、过氧化钠等,但这些物质具有较强的吸湿性,给氧烛加工、装配、贮存带来很大的不便,因此较少被使用。即使在较低的温度下燃烧,氯酸钠分解也会有少量的氯气产生,氯气对人体有毒,医学上供呼吸的氧气中规定氯气的最高允许值为0.001 mg/L[9],通常在氧烛配方中加入抑氯剂如碱金属的过氧化物来消除氯气。除了以上重要试剂外,氧烛配方中都要加入一定量的黏结剂如玻璃纤维、高岭土等。黏结剂主要起支撑作用,防止氯酸钠在燃烧时流淌;黏结剂还可使盐柱具有足够的强度,避免运输或燃烧过程中盐柱破碎断裂。
我国在矿用和船用大体积氧烛的应用方面有大量的研究。如张峥等[10]通过热重分析(TG)研究了氧烛催化剂对氧烛燃烧的影响,在正交实验中得到了较优的氧烛配方,在环境温度不高于33.3 ℃时氧烛利用率达到了88.6%,但氧烛外壳温度达到了115 ℃. 王雅娟等[11]设计了夹套式结构氧烛,用硅气凝胶隔绝盐柱燃烧释放的热量,氧烛燃烧时的外壁温度仍然高达近250 ℃. 便携式氧烛是为适合野外多种环境而研制的,它要求氧烛体积小、产氧率高、烛体温度低,便于安全和贴身使用。目前国内研制的室内大体积氧烛配方及工艺还不适合便携式氧烛的制作。
本文通过制备一种效率较高的钴盐催化剂,使氯酸钠的分解温度低于其熔点,同时通过对催化剂和黏结剂、抑氯剂的配方和压制工艺及燃烧过程的分析,厘清了助剂对氧烛燃烧过程的影响,综合协调控制各工艺因素,制备了能在较低温度下燃烧的便携式无燃料氧烛,其烛体体积小、燃烧时外壳温度低,放氧速率可稳定控制在5 L/min,氯气含量低于0.001 mg/L,达到了便携氧烛的制作与使用要求。
1 实验条件与测试
1.1 试剂与仪器
氯酸钠、二氧化硅、二氧化锰等试剂均为分析纯,购于成都市科龙化工试剂厂;过氧化钡购于山东西亚化学股份有限公司;三氧化二钴、四氧化三钴、氧化镍购于上海阿拉丁试剂有限公司。
形貌分析采用德国蔡司公司生产的Ultra 55型扫描电子显微镜(SEM),热分析仪采用瑞士梅特勒- 托利公司生产的TGA/SDTA851e型热分析仪,盐柱强度测试采用无锡建仪仪器机械有限公司生产的TYE-300型压力试验机。气体成分检测采用深圳市逸云天电子有限公司生产的MS400型气体检测仪。盐柱质量变化记录采用上海卓精电子科技有限公司生产的BSM-220型电子天平。
1.2 实验过程
氧盐柱分为引火段和主体段两种,直径均为30 mm. 引火段中加入引火药,盐柱高度3 cm左右;主体段中无引火药,高度根据装配的需要来压制。盐柱的压制分别采用干法和湿法两种方式。干法压制的典型步骤为:称取一定质量预先干燥的氯酸钠、黏结剂(高岭土、二氧化硅或三氧化二铝)、抑氯剂过氧化钡(BaO2)、催化剂,加入球磨机中碾磨30 min后取出,将粉状混合物加入模具中,在5 MPa压力下成型。压制好的样块脱模,在130 ℃干燥20 h备用。湿法压制的盐柱配方与干法压制一致,区别在于湿压法在研磨后的粉料中加入一定量的蒸馏水,物料配制成泥状灌入模具中压制成型,样块经脱模干燥备用。干燥好的盐柱装配时,将点火段与主体段紧密对接,用二氧化硅气凝胶毡将两段药柱包裹后塞入铁罐,盐柱裹毡的层数根据罐子与盐柱的尺寸而定,确保盐柱与罐壁之间的空隙都被密实填充,铁罐盖装上点火帽后密封铁罐。盐柱及其燃烧后的残渣微观形貌用SEM观察,氯酸钠的熔融燃烧温度由差热分析(DTA)测得,升温速率为20 ℃/min,温度范围为25~800 ℃. 失重率由TG仪测试得到,空气气氛,升温速率为20 ℃/min,温度范围为25~800 ℃. 抗压强度由压力试验机测试,加载速率为0.5 kN/s. 测试样品为直径30 mm、高度20 mm的圆柱。放氧速率测试是用天平记录燃烧过程质量的变化,将损失的质量换算为氧气体积计算产氧率。释放气体的成分由气体检测仪测试,将燃烧后的气体收集,通过测试仪,测试氯气含量。
2 实验结果与讨论
2.1 催化剂对氯酸钠分解的影响
纯氯酸钠的升温过程热分析如图1所示。由图1可见,从室温开始升温时,DTA曲线呈平缓向下的趋势,为吸热过程,对应为氯酸钠固体的升温吸热。约到240 ℃时,曲线出现了一个陡峭的向下吸热峰,峰值在260 ℃,此过程对应为固体氯酸钠的熔融。而后在350~500 ℃间,曲线平稳上升,对应为氯酸钠熔体的升温过程。到500 ℃左右曲线出现了较明显的向上放热峰,一直持续到600 ℃左右放热停止。结合TG曲线可以看出,从室温到300 ℃温度范围内,氯酸钠的质量几乎没有变化,从300~500 ℃范围内,伴随有少量氯酸钠的失重,从500~600 ℃范围内质量损失在40%左右,整个升温过程氯酸钠失重约为43%,与理论的氯酸钠分解放氧失重率45%大致相当,表明氯酸钠从300 ℃左右开始逐渐分解,主要的分解温度范围在500~600 ℃之间。
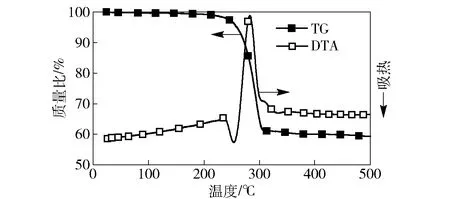
图2 氯酸钠催化分解的TG-DTA图Fig.2 TG-DTA data of decomposition of sodium chlorate with catalyst
图2为加入5%钴盐催化剂后,氯酸钠分解的TG-DTA曲线。从图2中可以看出:加入催化剂后,氯酸钠的熔融温度没有变化,仍然在240 ℃左右开始熔融;但在加入催化剂后,氯酸钠的熔融峰变小,紧接着251.5 ℃开始出现陡峭的放热曲线,表明氯酸钠在熔融温度下有大量的放热现象发生,到298.4 ℃放热峰结束,之后没有出现明显的熔体升温过程。结合TG曲线可以看出,251.5~298.4 ℃温度范围内,样品失重率约为42%,与理论上氯酸钠分解放氧的失重率一致,表明这段温度对应为氯酸钠的分解。由此可以看出,加入催化剂后,氯酸钠的分解温度由原来的500~600 ℃降低到了260 ℃左右。不同催化剂对氯酸钠分解的温度降低效果不同。实验验证了文献[5,10]中报道效果较好的催化剂,在添加相同质量分数5%时,其对氯酸钠催化分解的起始温度和结束温度都不同,具体的结果见表1. 由表1可以看出,自制催化剂的降温效果>四氧化二钴>二氧化锰>四氧化三钴>氧化镍。自制催化剂在低于250 ℃时就可以使氯酸钠分解,分解温度低于氯酸钠的熔点。同时,自制催化剂可以使氯酸钠在50 ℃温度范围内(低于300 ℃)分解完全,而其他催化剂作用下氯酸钠分解完全的温度都在350 ℃以上。随着催化剂用量的增加,氯酸钠分解温度会进一步降低。图3为催化剂用量变化时氯酸钠的分解DTA曲线。由图3可见,当催化剂的含量从1%增加到10%时,曲线上放热峰逐渐提前,从260.2 ℃降低到了246.3 ℃,表明氯酸钠分解温度不断降低。继续增加催化剂时,其对氯酸钠分解温度的降低不再明显。加入1%的自制催化剂即可显著改变氯酸钠的分解,表明自制催化剂具有较高的催化活性。由于钴盐在高温下分解为钴的氧化物,可以认为钴盐的催化机理是通过钴氧化物在氧化还原循环中加速电子转移,使氯酸钠在更低的温度下分解[6]。
表1 不同催化剂作用下氯酸钠的开始、结束分解温度和失重率数据
Tab.1 Initial decomposition temperature, end decomposition temperature, and weight loss of sodium chlorate under the action of different catalysts
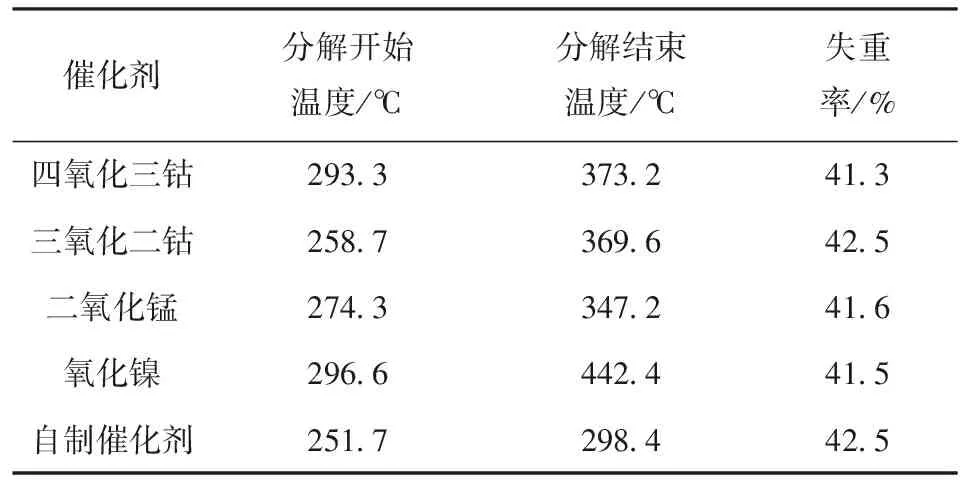
催化剂分解开始温度/℃分解结束温度/℃失重率/%四氧化三钴293.3373.241.3三氧化二钴258.7369.642.5二氧化锰274.3347.241.6氧化镍296.6442.441.5自制催化剂251.7298.442.5
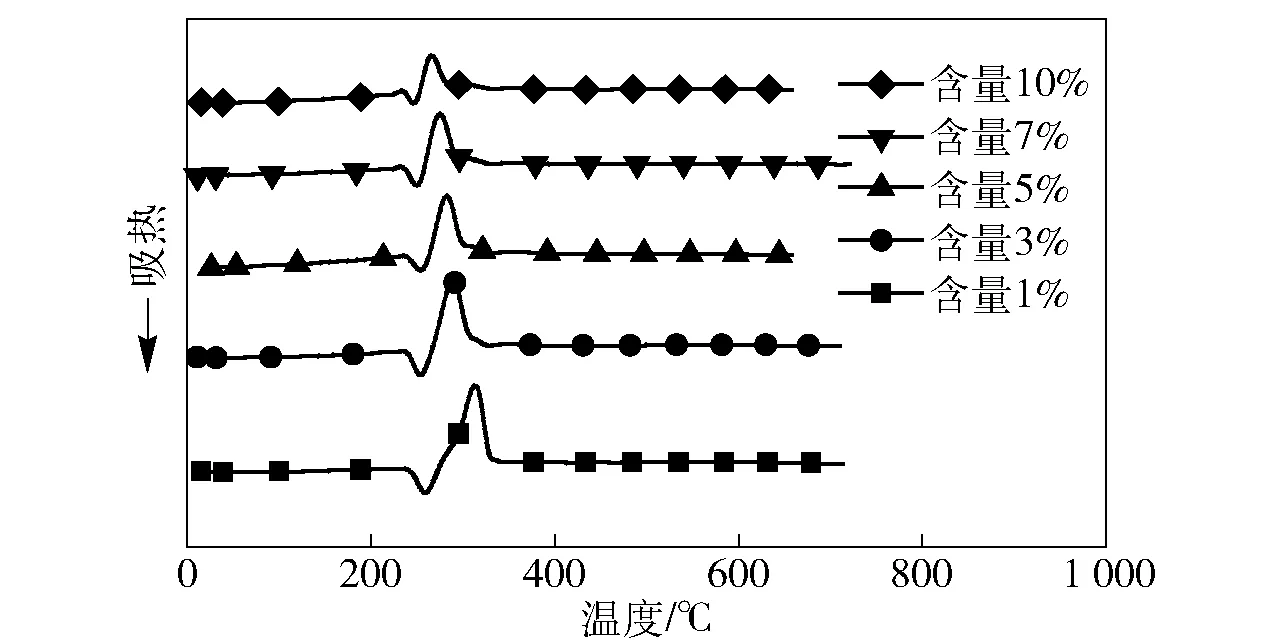
图3 不同催化剂含量的氯酸钠分解DTA图Fig.3 DTA data of decomposition of sodium chlorates with different catalyst contents
2.2 抑氯剂对氯酸钠分解的影响
氧烛燃烧时,氯酸钠分解放出氧气的同时也会放出少量氯气,由于呼吸系统对氯气比较敏感,需要控制氯气的含量。文献[9]中通常使用抑氯剂如碱金属过氧化物来消除氯气。在选择抑氯剂时除了要考虑其与氯气的反应活性外,还要兼顾盐柱在压制时过氧化物与水的反应,据此本文实验选择了过氧化钡,其有较高的吸氯作用且与水反应的速率较低。图4为抑氯剂加入后氯酸钠的分解图。由图4可以看出,随着过氧化钡的增加,氯酸钠的燃烧速度变慢,氧烛的放氧速率降低。表2列出了不同过氧化钡添加量的盐柱放氧结果。由表2可见,当过氧化钡的添加量从1%上升至 3%后,氯气的释放量从0.21×10-6降低到了0.14×10-6,氧烛的放氧速率也从5.32 L/min下降至2.82 L/min,继续增大过氧化钡含量,氧烛样块难以引燃,表明过氧化钡也会降低氯酸钠的分解活性。
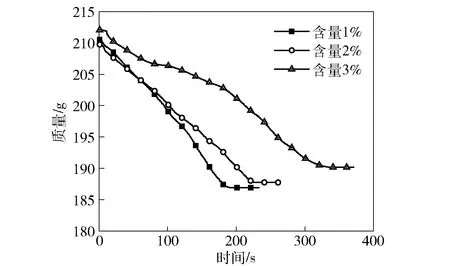
图4 不同过氧化钡含量盐柱的放氧速率曲线Fig.4 Oxygen releasing rates of oxygen candles with different contents of baryta
表2 过氧化钡对氯酸钠分解的影响
Tab.2 Combustion data of 1%-3% barium peroxide additives
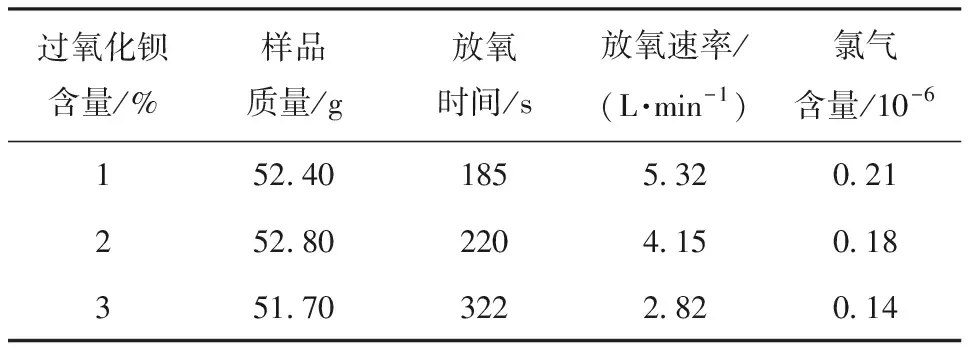
过氧化钡含量/%样品质量/g放氧时间/s放氧速率/(L·min-1)氯气含量/10-6152.401855.320.21252.802204.150.18351.703222.820.14
2.3 压制方法对氧烛燃烧的影响

图5 不同压制方法样块的微观形貌Fig.5 Cross-section images of oxygen candle
本文实验分别研究了干法压制和湿法压制盐柱的结构及燃烧特性。图5(a)为干法压制的氧烛样块断面SEM图,样块断面颗粒大小不均匀,大颗粒出现了较宽的裂纹。图5(b)为湿法压制的样块,样品断面颗粒较为圆润,颗粒间黏结堆叠紧密,颗粒大小较均匀,断面完整,成型好,无开裂现象。这种区别可以解释为在湿法压制过程中,水作为溶剂溶解了大量氯酸钠,这些溶液附着填充在未被溶解的氯酸钠、黏结剂和催化剂固体表面与颗粒之间的缝隙中。在干燥时,随着水的蒸发,这些溶解的氯酸钠在颗粒表面和缝隙间析出,使得颗粒表面圆润,缝隙间的氯酸钠则形成了颗粒间的黏合剂,使氧烛中的各组分强度增加,成型后最大抗压强度可达7.1 MPa,而干法压制的样块抗压强度为 2.7 MPa.
不同压制方法制得的氧烛燃烧也有明显的区别。图6(a)、图6(b)分别为干法压制和湿法压制的样块点火燃烧后残渣的微观结构。由图6可以看出,干法压制的样块在引火段燃烧后,没有引燃主体段盐柱继续燃烧,在未燃界面处有熔滴状氯酸钠出现,分析为引火段燃烧时使部分氯酸钠熔融,因其没有进一步燃烧分解,故冷却后形成了熔滴。图6(b)中湿法压制的样块点火后,氧烛燃烧持续至所有盐柱中的氯酸钠全部分解,燃烧后的残渣为多孔松散状,微观结构较规整。结合图5样品燃烧前的结构形态可以看出,水在压制成型中对盐柱成分的分布有关键作用:首先,水溶解了部分氯酸钠,使氯酸钠颗粒变小、表面积增大;其次,干燥时析出的氯酸钠包覆在催化剂外表面,使催化剂与氯酸钠形成面接触,催化燃烧得以顺利进行,燃烧后的残渣松散,无熔滴烧结现象。湿法压制时对水量的控制也很关键,需要析出的氯酸钠在催化剂表面包覆的厚度达到一个合理范围,实验中发现用过多或过少的水配制的物料,压制后得到的烛体都不能充分地燃烧。干法压制成型的样品由于没有氯酸钠析出包覆催化剂的过程,催化剂与氯酸钠为点接触方式,接触面积小,催化效率低,盐柱不易燃烧。此外,氯酸钠从水中析出也填充了颗粒间的缝隙,使盐柱结合紧密,盐柱强度增加,不易发生无开裂破损。
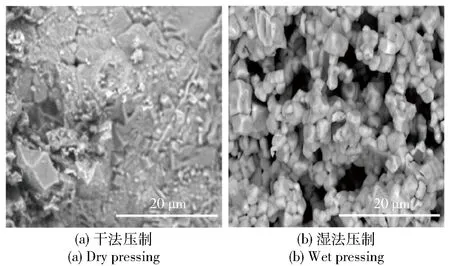
图6 不同压制方法样块盐柱燃烧后的微观形貌Fig.6 Cross-section images of burned oxygen candle
氧烛压制成型中使用不同的黏结剂,对盐柱的成型和燃烧影响显著。本文实验首先使用了一种二氧化硅黏土,但在盐柱燃烧时黏土也发生熔融,不能很好地防止氯酸钠流淌。然后分别使用了熔点更高的氧化铝作为黏结剂,制备得到了氧烛样块。两种不同黏结剂成型的样块燃烧后形貌如图7所示。其中,图7(a)为二氧化硅黏结剂压制的样块,其燃烧过程中出现了较多的熔盐泡。经测试发现所用的二氧化硅黏结剂在500 ℃左右发生了熔融,点火药燃烧的温度超过了黏结剂的熔融温度,使二氧化硅黏结剂和氯酸钠都发生了熔融,黏结剂失去了对氯酸钠熔盐的固定作用,熔盐流淌形成了熔滴,氯酸钠分解放出的氧气起到了发泡剂作用,使熔盐表面出现鼓泡,熔盐的流动破坏了盐柱中催化剂和氯酸钠的混合分布,失去了催化作用的盐柱不能持续燃烧。图7(b)显示,用氧化铝为黏结剂时,样块能持续燃烧,燃烧后没有出现融滴和鼓泡现象。这是因为氧化铝的熔点超过2 300 K,是良好的耐火材料,在氯酸钠熔融分解过程中,氧化铝固体对熔盐起到了很好的支撑固定作用,使熔融的氯酸钠不会发生流淌,盐柱中催化剂和氯酸钠的混合分布形态保持较好,催化作用持续稳定,盐柱得以持续燃烧,燃烧后的残渣结构疏松且稳定。

图7 二氧化硅和氧化铝作黏结剂的压块燃烧后图像Fig.7 Burned candle samples with silica and alumina binders
通过以上对各组分作用的研究和压制工艺的考察,确定出一个较合理的配方为:质量分数5% 自制催化剂,氧化铝作为黏结剂,2%的过氧化钡作抑氯剂,湿法压制。此配方工艺压制的样品燃烧彻底充分,不需要添加金属燃料,产氧率大于4 L/min,氯气含量低于0.001 mg/L. 由于本文配方工艺较好地控制了氯酸钠燃烧分解的温度,氧烛密封罐的外表温度低于60 ℃,满足了便携使用的要求。
3 结论
1)通过提高催化剂的催化效率,可使氯酸钠的分解温度降低至其熔融温度以下,来解决氯酸钠氧烛燃烧时的温度太高和容易流淌等问题。
2)黏结剂主要作用是保持盐柱燃烧时的结构与成分分布的稳定,因此黏结剂熔融温度应高于盐柱熔融分解温度,才能有效地解决氯酸钠高温燃烧流淌起泡的问题。
3)抑氯剂不仅可以吸收氯气,还可以用它来控制氧烛放氧速率。
4)尽管采用了高效催化剂,但只有通过各组分配方和压制工艺的协同配合,才能使氧烛的制作工艺和燃烧效果都满足便携使用的要求。

