几种仔猪肠道损伤模型的建立及肠道损伤生物标志物的研究进展
王 蕾,易 丹,吴 涛,侯永清, *
(1.武汉轻工大学农副产品蛋白质饲料资源教育部工程研究中心,湖北武汉 430023;2.武汉轻工大学动物营养与饲料科学湖北省重点实验室,湖北武汉 430023)
肠道不仅是所有营养物质消化吸收的最终场所,也是动物体内最大的免疫器官,是机体防御体系的第一道屏障,维护肠道健康对保障养猪生产至关重要[1-3]。研究证明,肠道是机体应激反应的中心器官,各种应激因素(如心理性、生理性、营养性和病原性的应激因子)会导致肠道结构损伤与功能紊乱,包括肠道屏障功能受损引起局部或系统性的炎性反应、肠道分泌与吸收功能异常引起腹泻等。此外,一些病原性因素(如致病性大肠杆菌、轮状病毒、传染性胃肠炎病毒、猪流行性腹泻病毒等)也会损伤仔猪肠道的结构与功能。因此,肠道功能紊乱是当前危害仔猪健康与生长的核心问题之一,建立稳定可靠的仔猪肠道损伤模型是研究肠道损伤机制及营养干预的关键。然而,由于实际条件下肠道损伤的病原(刺激)因子多样化、致病机制复杂、环境控制要求严格等原因,仔猪腹泻和肠道损伤动物模型通常难以建立[4]。本文主要介绍了本实验室成功建立的几种仔猪肠道损伤模型,并总结了在这些模型下肠道损伤生物标志物研究进展。
1 单一肠毒素(STa)重组大肠杆菌感染诱导的仔猪肠道损伤模型
产肠毒素大肠杆菌(ETEC)能引起人和动物肠道功能障碍和损伤,并导致断奶仔猪腹泻,降低仔猪的生长性能[4]。ETEC 是引起腹泻的最常见细菌病原体,仔猪在感染后常因急性剧烈腹泻而脱水死亡,给养猪业造成重大经济损失。由于抗生素类药物的大量添加,近年来具有多重耐药性的超级菌株屡见报道,给ETEC 造成的仔猪腹泻等疾病的预防控制和治疗带来巨大挑战,也对人类的健康构成潜在威胁[5]。
为了克服致病性大肠杆菌的环境污染及实验猪普遍具有较强耐受性等问题,本课题组通过基因重组技术构建了表达单一肠毒素重组大肠杆菌(LMG194-STa),其体外相对毒性为大肠杆菌K88 的94%[5],通过LMG194-STa 口腔灌服感染,成功建立了LMG194-STa 诱导下的仔猪肠道损伤模型[4]。
1.1 灌服LMG194-STa 引起仔猪腹泻 灌服LMG194-STa 前根据仔猪粪便的稀软程度判断腹泻情况,并记录仔猪精神状态的变化;灌服LMG194-STa 后每隔3~4 h观察1 次。计算灌服LMG194-STa 前后的总腹泻率,腹泻率= 腹泻总头次/(总头数× 攻毒天数)×100%[5]。研究发现,给7 日龄仔猪灌服2×109CFU LMG194-STa,4 h 后仔猪开始出现精神不济,伴随腹泻,大部分仔猪呈犬坐姿态,仔猪腹泻率增加266.8%[5]。研究表明,大肠杆菌K88 是导致新生或断奶仔猪腹泻的重要病原菌之一,主要通过其菌体表面的菌毛黏附素特异性结合小肠上皮细胞刷状缘特定的受体,从而在宿主体内定植、大量繁殖、分泌肠毒素导致仔猪腹泻[6],而LMG194-STa 则是通过调节肠上皮细胞的氯离子通道引起的电解质失衡,诱发仔猪腹泻,两者都会导致肠道黏膜的急性损伤[5]。
1.2 灌服LMG194-STa 破坏了仔猪肠道结构形态 如图1所示,LMG194-STa 可引起小肠损伤的程度与K88 相同。

图1 对照组、LMG194-STa 组和K88 攻毒组空肠光镜照片(×4) [5]
灌服LMG194-STa 能降低小肠绒毛高度、小肠绒毛高度/ 隐窝深度及绒毛表面积[4]。可见单一肠毒素STa 在一定程度上引发了小肠绒毛萎缩。这与已发表的关于大肠杆菌感染或大肠杆菌等毒素如脂多糖(LPS)对肠道形态结构的影响结果一致[3,7-8]。小肠绒毛高度、绒毛高度/隐窝深度、绒毛表面积等指标在很大程度上决定了小肠的消化吸收能力。正常生理情况下,小肠的绒毛高度由隐窝细胞增殖率和细胞周转率共同决定,绒毛高度、绒毛宽度直接与肠绒毛表面积呈正相关,与小肠的吸收功能同样呈正相关[9]。隐窝是小肠上皮在绒毛根部下陷至固有层而形成的管状腺,开口于相邻的绒毛之间。小肠隐窝深度反映了肠上皮细胞的生成情况,隐窝变浅说明肠上皮细胞成熟率上升,隐窝的深浅与肠绒毛的正常机能和完整形态密切相关[10]。绒毛高度/隐窝深度综合反映肠道的功能状态,比值降低则说明肠道形态结构可能受损[11],导致肠道吸收功能障碍进而引起腹泻。绒毛表面积则可以直接体现肠绒毛与营养物质的吸收面积,当绒毛受损或绒毛萎缩时,会降低绒毛表面积,进而降低肠道的吸收功能[11],导致机体的生长障碍以及腹泻等。
1.3 灌服LMG194-STa 对仔猪血浆D- 木糖和二胺氧化酶(DAO)活性的影响 研究发现,灌服LMG194-STa 后仔猪血液淋巴细胞数量和DAO 水平显著增加,血浆D-木糖含量显著降低[4]。DAO 是人类和哺乳动物小肠黏膜上层绒毛细胞中特有的具有高度活性的细胞内酶,在组胺和多种多胺代谢中起重要作用,能够直观反映肠道机械屏障的完整性和受损伤程度[4],当肠黏膜上皮细胞受到损伤时,DAO 才会被释放出来进入血液,导致血液DAO 活性增高,血浆DAO 活性与肠损伤程度呈正相关[2,12]。因此,血液中DAO 活性是反映肠黏膜形态结构完整性的重要指标[7]。血液中D-木糖含量可以体现肠道的通透性,从而评价吸收功能的强弱。当肠道黏膜形态结构受损时,会导致D-木糖吸收能力下降,血浆D-木糖含量也会相应降低,以上结果进一步说明了灌服LMG194-STa 后仔猪肠道组织形态受损[4]。
1.4 灌服LMG194-STa 对仔猪肠道黏膜功能相关基因相对表达量的影响 灌服LMG194-STa 显著下调了仔猪空肠中与肠黏膜生长及完整性有关基因的相对表达量,如肠道绒毛蛋白(villin)、肠型脂肪酸结合蛋白(intestinal Fattyacid-Binding Protein,i-FABP)[4]。villin 是绒毛细胞分化的标志物,villin 作为重要的Ca2+肌动蛋白,位于小肠黏膜上皮细胞的刷状缘,标志着肠道细胞的成熟程度,villin 表达上调意味着更多的绒毛细胞增殖分化[2,13]。villin 基因表达量的高低被看作是肠道绒毛正常与损伤的标志之一[14]。灌服LMG194-STa 可以显著下调仔猪空肠和回肠villin 的mRNA 水平[4],说明灌服LMG194-STa 对仔猪肠道造成了损伤。i-FABP 是近年来研究较多的用于判定肠道损伤的指标[14]。i-FABP主要定位于小肠的肠细胞,在小肠缺血和细胞破裂后释放到血液中。当肠绒毛顶端区域细胞受损时,肠黏膜i-FABP 基因表达量下降和血液i-FABP 含量提高[15-16]。因此,i-FABP 被认为是肠道细胞损伤的另一个标志物。灌服LMG194-STa 后,显著下调了仔猪空肠i-FABP 的mRNA 水平[4],当肠绒毛顶端区域细胞受损时,肠黏膜i-FABP 基因表达量下降[17]。基质金属蛋白酶-3(MMP3)被认为是肠细胞损伤的标志物,在临床IBD(炎症性肠病)和腹腔疾病中,MMP3 在肠内高表达[18]。LPS 刺激可以提高仔猪肠道MMP3 mRNA 水平[3]。研究发现,LMG194-STa 处理后仔猪空肠MMP3 基因表达水平显著升高[4]。以上这些结果表明,LMG194-STa 刺激引起了仔猪肠道损伤。
当仔猪受到大肠杆菌感染时,肠道内炎性细胞因子的表达均发生改变,如IL-1β、IL-4、CCL-2(MCP-1)、CXCL9(MIG)、IFN-γ、HSPH1 和VNN1[4]。本团队研究发现,灌服LMG194-STa 显著上调了仔猪空肠IL-4、CCL-2、CXCL9 和IFN-γ 的mRNA 水平,但显著下调了VNN1 的mRNA 水平[4]。这些结果表明LMG194-STa 应激诱导了仔猪肠道炎症反应。
当仔猪受到大肠杆菌的感染时,可以改变营养代谢相关基因(如PCK1、INSR 和LPL)的表达[4]。研究发现,LMG194-STa 刺激下调了仔猪空肠INSR 和PCK1 及回肠LPL 基因相对表达量,但上调了回肠PCK1 基因相对表达量。研究人员推测,LMG194-STa 可以影响营养物质(包括氨基酸、葡萄糖和脂类)在肠道上的代谢[4]。
灌服LMG194-STa 成功建立了单一肠毒素重组大肠杆菌感染诱导的仔猪肠道损伤模型。体外试验研究结果表明,重组菌株LMG194-STa 与广谱菌株K88 具有相同的毒性,其毒性高于宿主菌株LMG194[4]。在体内试验研究结果表明,灌服LMG194-STa 可导致仔猪腹泻,造成肠道黏膜损伤,可以利用该仔猪腹泻和肠道损伤模型研究不同营养物质对肠毒素导致的肠道损伤的保护作用[4]。
2 猪流行性腹泻病毒(PEDV)感染诱导的仔猪肠道损伤模型
PEDV 感染引起的仔猪腹泻是养猪生产中常见疾病之一。目前国内外动物营养学研究中关于PEDV 感染仔猪模型的研究鲜有报道。PEDV 属于尼多病毒目、冠状病毒科、冠状病毒属,其基因组是单股正链具有感染性的RNA,5´端有1 个帽子结构(cap),3´端有1 个Poly(A)。PEDV 主要的结构蛋白包括纤突蛋白(Spike protein,S)、膜蛋白(Membrane protein,M)和核衣壳蛋白(Nucleocapsid protein,N)。灌服PEDV 后仔猪肠道可定植大量的PEDV[14]。PEDV 感染会引起急性、重度萎缩性肠炎,并伴有病毒血症[19]。本课题组经过多次试验,探索出了一种猪肠道损伤的PEDV 感染模型:给14 日龄仔猪单次灌服104.5TCID50的PEDV YN 株。通过设计合成PEDV 膜蛋白(M 蛋白)和核衣壳蛋白(N 蛋白)基因的引物,利用qRT-PCR 方法检测到仔猪空肠黏膜PEDV M 和N 蛋白基因的相对表达量显著增加,抗病毒蛋白MX1 在空肠和回肠中的基因相对表达量也显著提高,表明PEDV 攻毒成功[2,14]。MX 蛋白(黏病毒抗性蛋白)是细胞抗病毒的重要先天性介质[20]。MX1 是I 型干扰素的重要下游效应物[21],MX1 基因已被证明具有抗多种RNA 病毒的抗病功能,包括猪的甲型流感病毒[20]。此外,MX1 在细胞凋亡和细胞因子介导的细胞信号转导中起重要作用[21],病毒感染可以诱导其表达[22-23]。
2.1 PEDV 感染对仔猪腹泻率及血液生化指标的影响 研究发现,PEDV 感染仔猪均出现腹泻、犬坐、食欲不振、呕吐的表观症状,该试验剂量下(单次灌服104.5TCID50),PEDV 感染显著提高了仔猪腹泻率(100%),但并未引起仔猪的死亡[2,14]。PEDV 感染后,仔猪平均日增重显著降低了37.4%[14]。另外,PEDV 感染提高了仔猪血浆总蛋白(TP)、白蛋白(ALB)、甲状腺球蛋白(TG)、尿素氮(BUN)、血氯(CL)等含量及谷丙转氨酶(ALT)和γ-谷氨酰转移酶(GGT)活性,表明PEDV 感染容易导致仔猪代谢改变[2]。
2.2 PEDV 感染对仔猪氧化应激的影响 活性氧(ROS)的产生及升高被认为是包括消化性溃疡、炎症性肠病(IBD)和胃肠道癌症等胃肠道黏膜疾病发病的一个重要因素[2,24]。丙二醛(MDA)是氧化损伤的重要指标,可作为体内氧化应激的标志[1-2,25]。ROS(如H2O2)主要由线粒体作为正常代谢的副产物产生[26]。细胞具有防御ROS 和其他氧化剂的防御机制,抗氧化酶包括过氧化氢酶(CAT)催化H2O2还原为水[27]。PEDV 感染显著降低了血浆和回肠CAT 活性,但显著提高了血浆和小肠MDA 和H2O2含量[2],说明口腔灌服PEDV 可以引起机体与肠道氧化应激[2]。
2.3 PEDV 感染对仔猪肠黏膜生长和形态结构的影响肠道黏膜中总蛋白、RNA 和DNA 含量、RNA/DNA可以用来评估肠道生长和发育[2,28]。研究表明,PEDV感染显著降低了空肠和回肠RNA 含量和回肠RNA/DNA[2],说明PEDV 感染影响了仔猪肠黏膜的生长。
完整的肠道屏障在防止肠腔病原微生物和饮食过敏原渗入肠道黏膜中起重要作用[2]。研究表明,PEDV 感染显著降低了仔猪血浆D- 木糖含量[2,14],同时显著提高了血浆中DAO 活性[2]。此外,PEDV 感染导致小肠中的i-FABP 表达显著降低[2,14]。这些结果表明,PEDV感染可以诱导肠道黏膜损伤,影响小肠的吸收和完整性。
进一步研究PEDV 感染对7 日龄仔猪肠道形态结构的影响发现,PEDV 感染显著降低了仔猪小肠绒毛高度,提高了小肠隐窝深度,降低了小肠绒毛高度/隐窝深度[2,14],显著降低了空肠和回肠绒毛表面积[2]。与灌服LMG194-STa 有类似结果,PEDV 感染仔猪下调了小肠villin 的mRNA 水平,说明PEDV 诱导了小肠细胞死亡[2]。以上结果说明,PEDV 感染损害了仔猪肠道生长与形态结构。
综上所述,PEDV 感染可降低仔猪的生长性能,引起仔猪严重腹泻、肠道绒毛萎缩、吸收与屏障功能紊乱,并不导致仔猪死亡。该模型的建立将为PEDV 感染仔猪肠道功能的营养调控研究提供有效技术手段。
3 直肠灌注乙酸诱导的仔猪结肠炎模型
溃疡性结肠炎模型动物以鼠类为主,鲜有仔猪的溃疡性结肠炎模型。本研究团队在仔猪上建立了一种简便易行、重复性好、稳定的溃疡性结肠炎模型[1,25]。通过直肠灌注乙酸(10 mL,10%v/v,由肛门导管导入25 cm处,灌注1 次)诱导仔猪溃疡性结肠炎的模型,仔猪结肠上皮脱落,淋巴细胞浸润(如图2)。乙酸诱导溃疡性结肠炎模型是一种典型的化学诱导性炎症模型,采用乙酸化学性刺激剂可以造成肠黏膜化学性损伤,继而产生炎性症状[29]。利用该模型课题组研究了功能性氨基酸[25]和三丁酸甘油酯[1]对仔猪结肠功能的保护作用。
直肠灌注10%乙酸后,仔猪倦怠懒动、后背微弓(推测有腹痛感),采食下降,出现稀便与脓血便,血便中可见肠黏膜脱落,血便第2 天消失,但仍有稀便,第3天恢复正常[29]。

图2 直肠灌注乙酸后结肠的形态学变化[1]
在乙酸刺激诱导的仔猪溃疡性结肠炎模型中,结肠黏膜损伤肉眼观察评分和病理切片组织学评分均显著高于对照组[25,29],表现为溃疡和炎性细胞明显浸润,组织学溃疡表现为结肠黏膜坏死、发炎,中性粒细胞和淋巴细胞为主要浸润细胞(图2)。乙酸刺激仔猪显著降低了回肠绒毛高度/隐窝深度及结肠杯状细胞比例,显著提高了上皮内淋巴细胞和淋巴细胞密度[1,25]。
仔猪直肠灌注10%乙酸后3 d,肠外壁严重粘连和水肿,均出现溃疡,病理切片可见结肠黏膜炎性细胞重度浸润,重度纤维化,黏膜下层大量增厚,黏膜上皮坏死溶解脱落,有大量淋巴细胞、多形核细胞、浆细胞,毛细血管充血,肠腺间质出血。灌注后7 d 可见溃疡灶脱落,仍有毛细血管充血,炎性细胞浸润,但对比灌肠后3 d 已明显减少,另有大量成纤维细胞增生[29]。
以上这些结果表明直肠灌注10%乙酸成功诱导了仔猪结肠炎。
4 吲哚美辛(IDMT)诱导的仔猪肠道损伤模型
IDMT 是一种非甾体抗炎药(NSAID),它通过抑制前列腺素合成而引起大鼠小肠的严重炎症和溃疡[30]。IDMT 在猪上诱导的肠道损伤鲜见报道。本团队通过多次摸索,采用IDMT 作为炎性损伤诱导剂,建立了仔猪肠道损伤模型:选用7 日龄杜×长×大仔猪(2.96±0.24) kg,饲喂7 d 后开始腹腔注射IDMT(5 mg/kg 体重);连续注射3 d,然后采集血液和肠道样品测定与肠道损伤相关的指标。结果显示(图3)IDMT 显著提高了血浆DAO 活性、i-FABP 含量、中性粒细胞和嗜酸性粒细胞数量、肠道MMP3 mRNA 水平、髓过氧化酶(MPO)活性和MDA浓度,但显著降低了血浆瓜氨酸浓度、肠道谷胱甘肽过氧物酶(GSH-Px)活性、villin、i-FABP、瞬时受体阳离子通道亚家族V 成员6(TRPV6)、水通道蛋白质(AQP10)和内向整流钾离子通道13(KCNJ13)的mRNA 水平[30]。此外,在IDMT 刺激仔猪的空肠远端和回肠有大量出血点、肠壁变薄和溃疡,IDMT 显著降低仔猪小肠绒毛高度和绒毛表面积[30]。以上结果表明,IDMT 提高了小肠中的促炎基因表达和血液中嗜酸性粒细胞和中性粒细胞的水平,导致仔猪肠道炎性损伤和氧化应激,并阻碍了肠黏膜生长和肠道营养物质运输[30]。IDMT 诱导的仔猪肠道损伤模型可进行人和动物肠道功能障碍及营养干预的研究。
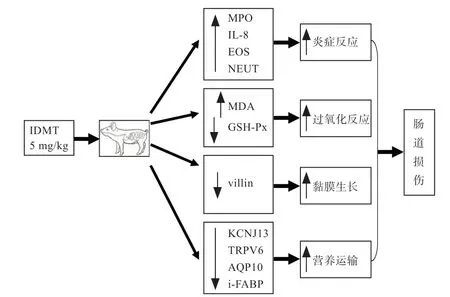
图3 IDMT 对仔猪肠道损伤作用[30]
4.1 IDMT 对仔猪血液学指标的影响 在IDMT 诱导的仔猪肠道损伤模型中,IDMT 显著提高了血浆DAO 活性、i-FABP 含量、NEUT 和EOS,但降低了血浆中淋巴数量和瓜氨酸浓度[30]。研究表明,IDMT 容易引起细菌易位,从而导致严重急性炎症和肠屏障功能紊乱[31]。因此,IDMT 诱导的血液免疫细胞数量的增加可能是由肠道炎症和细菌易位引起[30]。
血浆DAO、血浆和小肠中的i-FABP 是肠道损伤的生物标志物。在本肠道损伤模型中,IDMT 提高了仔猪血浆DAO 活性和i-FABP 水平[30],但降低了仔猪空肠和回肠中的i-FABP mRNA 水平[30],表明IDMT 可以引起仔猪肠道损伤。这与IDMT 降低了血液中瓜氨酸水平的结果一致,血浆瓜氨酸降低也被认为是肠道损伤的有效生物标志物[32]。
4.2 IDMT 对仔猪肠道形态结构的影响 IDMT 刺激后,仔猪的空肠远端和回肠有大量出血点、肠壁变薄和溃疡;IDMT 显著降低仔猪小肠绒毛高度和绒毛表面积,表明IDMT 造成了仔猪肠道损伤[30]。
IDMT 可引起严重的肠道炎症和溃疡。IDMT 降低肠内源性前列腺素的产生,导致微循环障碍、肠粘液减少、细胞间连接的破坏及黏膜通透性增加[30-31]。黏膜损伤可归因于胆汁酸、蛋白水解酶、肠杆菌和毒素的渗透以及炎症细胞因子的分泌、嗜中性粒细胞浸润和嗜酸性粒细胞浸润[31]。
4.3 IDMT 诱导仔猪氧化应激 IDMT 刺激提高了仔猪血浆H2O2水平、空肠MDA 浓度和MPO 活性,降低了空肠GSH-Px 活性。作为一种非甾体抗炎药,IDMT 能溶解肠细胞膜磷脂,损伤上皮细胞线粒体,导致细胞间钙外排和自由基产生,从而导致肠道过氧化和黏膜氧化应激。研究表明,口服IDMT 引起小肠溃疡,这可能与小肠中MPO 活性的显著增加相关[30]。
4.4 IDMT 对肠黏膜基因表达的影响 在本肠道损伤模型中,IDMT 刺激可下调回肠villin、i-FABP、TRPV6、AQP10 和KCNJ13 的mRNA 水平,但上调了仔猪空肠和 回 肠 中MMP3、pBD-1 和IL-8 的mRNA 水 平[30]。如前所述,血浆i-FABP 水平升高和肠道i-FABP 下调也表明IDMT 引起肠损伤。此外,MMP3 是肠道损伤的重要介质,包括免疫介导的肠损伤[18],IDMT 诱导MMP3 mRNA 水平升高进一步证实了IDMT 引起了肠损伤。此外,在本模型中,IDMT 刺激引起的肠道炎症,上调了空肠和回肠中IL-8 和pBD-1 mRNA 水平。
在IDMT 诱导的仔猪肠道损伤的模型中还发现,IDMT 刺激可以下调肠营养转运相关蛋白质的表达,如TRPV6、KCNJ13 和AQP10。TRPV6 是近年来发现的一种高选择性的Ca2+跨膜转运通道,主要负责Ca2+由细胞外向细胞内的主动跨膜转运,在机体内参与多种病理生理活动的调节[33],参与肠道跨细胞钙转运[34]。而AQP10 是水通道蛋白质,在肠黏膜上皮细胞中表达[35]。同样,以往研究表明,LPS 刺激下调了仔猪空肠AQP 3和AQP10 的基因相对表达量[3]。
因此,IDMT 不仅引起肠道损伤,而且降低了肠道营养物质运输能力[30]。
5 肠道损伤相关标志物的研究
通过应用以上这些仔猪肠道损伤模型,本团队研究了肠道损伤的标志物。血中DAO 活性与仔猪腹泻程度显著相关,可以用DAO 活力检测和D-木糖试验来评价肠道功能。仔猪肠道损伤与血浆DAO 活性和i-FABP 水平密切相关。当仔猪肠道受损,腹泻率增加,血浆DAO活性和i-FABP 水平显著提高。给仔猪灌服D-木糖,若肠道功能受损,则D-木糖吸收能力降低,血液D-木糖水平显著降低。因此,仔猪血浆D-木糖水平能较好地反映肠黏膜的完整性与吸收功能。此外,在这几种仔猪肠道损伤试验模型下,肠黏膜villin、i-FABP、pBD-1、KCNJ13 的基因相对表达量均显著降低,而MMP3 基因相对表达量均增加。因此,以血浆DAO 活性、瓜氨酸 和i-FABP 水平,肠 黏 膜Villin、iFABP、MMP3、pBD-1、KCNJ13 基因为标志物,结合D- 木糖吸收试验和肠黏膜形态学观测的肠道功能检测方法与体系,可为诊断仔猪肠道疾病提供理论依据。
6 小 结
本实验室成功建立了几种仔猪肠道损伤模型:①灌服LMG194-STa 诱导的仔猪肠道损伤模型;②灌服PEDV 诱导的仔猪肠道损伤模型;③直肠灌注乙酸诱导的仔猪溃疡性结肠炎模型;④腹腔多次注射IDMT 诱导的仔猪肠道炎性损伤模型。这几种肠道损伤模型为猪和人类的肠道功能障碍研究和营养干预提供了技术手段,同时,应用这些模型本团队确定了肠道损伤的系列标志物,可为仔猪肠道疾病的诊断提供重要依据。

