平邑甜茶根尖染色体制片技术优化及核型分析
王彦 华丽源 钱关泽

摘要:为探讨制备平邑甜茶染色体制片的最佳技术参数,以平邑甜茶根尖为试验材料,比较材料的不同采集时间、预处理方法、酶解时间和后低渗时间对平邑甜茶根尖染色体制片的影响。结果表明:在26 ℃培养条件下,平邑甜茶最佳取材时间为11:00—11:30;4 ℃低温冰水混合物进行预处理能够获得较为分散的染色体标本;酶解采用2.5%果胶纤维素混合酶在37 ℃下处理最佳时间为2 h,后低渗最佳时间为20 min。核型分析发现平邑甜茶染色体属于小型染色体,染色体臂比变化在1.01~2.46之间,差异不大,核型组成成分为中部着丝点染色体(m)、亚中部着丝点染色体(sm),核型属于2B型。
关键词:平邑甜茶;根尖;染色体制片;核型分析;去壁低渗法
中图分类号: Q949.751.8;S685.120.1 文献标志码: A 文章编号:1002-1302(2019)01-0091-06
平邑甜茶[Malus hupehensis (Pamp.) Rehd. var. mengshanensis G. Z.Qian]是蔷薇科苹果属植物,属于湖北海棠的一个变种,典型的无融合生殖型三倍体植物。20世纪70年代开始,就有人试图将人类染色体标本制备方法引用到植物材料上来[1-3],如今植物方面的染色体制片已经取得了很大的进步,但是目前在平邑甜茶植物染色体制片方面的报道很少,林盛华等报道平邑甜茶为三倍体植物,染色体数为 2n=3X=51[4],梁国鲁报道了用胰酶法诱导山荆子染色体中期G带的研究[5],周攀等报道了利用风油精制备平邑甜茶染色体制片技术的研究[6]。平邑甜茶在细胞学方面的研究很少,主要原因在于染色体小,数量较多,制片时染色体难分散,制片难度大。染色体制片一般分为压片法和去壁低渗法。压片技术能快速制备染色体临时片[7-8],但压片法容易残留过多的细胞质,且染色后着色程度受染色剂影响很大,染色体和细胞质不易区分,很难获得效果好的压片[9-10]。去壁低渗法可以很好地使染色体分散开,但操作中会受到诸多因素影响,技术不熟练的情况会对结果造成影响。本试验取平邑甜茶种子根尖运用去壁低渗法进行染色体制片,从不同取材时间、预处理剂、酶解浓度、酶解时间、后低渗时间等方面进行对比,对制片技术进行讨论,为平邑甜茶细胞學研究提供清晰度高的染色体制片,并且对其进行核型分析,旨在为平邑甜茶基因组原位杂交提供细胞学基础及技术支撑,奠定山荆子组植物细胞分子遗传图谱的基础。
1 材料和方法
1.1 材料
试验材料为平邑甜茶种子根尖,于2016年9月在山东省临沂市平邑县采集平邑甜茶果实,收集种子,晾干后用水浸泡24 h,铺在有1层滤纸2层纱布的培养皿中,在5 ℃下培养 15 d 打破休眠,放于26 ℃培养箱中,待根尖长至0.5 cm时截取并进行试验。
1.2 方法
1.2.1 取材时间 于24 h内取平邑甜茶根尖,每隔30 min取材1次,进行预处理制片。
1.2.2 预处理 分别将所取的根尖材料用0.2%秋水仙素、2 mmol/L 8-羟基喹啉、饱和α溴萘预处理液处理2~4 h,然后在4 ℃冰水混合物低温冰浴分别处理21、22、23、24 h。
1.2.3 固定 预处理后的材料置于-20 ℃的卡诺式固定液[乙醇 ∶ 冰醋酸=3 ∶ 1(V/V)]中固定2~24 h。
1.2.4 前低渗 将平邑甜茶根尖从固定液里取出,用蒸馏水冲洗3次,浸泡10 min后加入到0.075 mol/L KCl溶液中处理30 min进行前低渗,使根尖细胞充分吸水,细胞器细胞质破散,细胞壁易于酶解,染色体分散。
1.2.5 酶解 固定24 h以上之后用水冲洗3次,再用浓度为2.5%的果胶酶纤维素酶混合液在37 ℃下分别处理1、2、3 h。
1.2.6 后低渗 将酶解后的根尖细胞在常温下蒸馏水浸泡,让平邑甜茶根尖细胞吸水更加膨胀,使细胞壁破裂,细胞质破散,染色体更容易分散,细胞膜失去约束容易破裂,所以低渗时间应控制在一定范围,本试验后低渗进行3个时间处理——10、20、30 min。
1.2.7 镜检 之后在NIKON ECLIPSE 80i共聚焦荧光显微镜及图像分析系统下镜检并拍照。
1.2.8 染色体核型分析 选出染色体分散良好的5个中期细胞测量每条染色体长度(长、短臂长度,随体不计算在内),计算公式如下:
染色体相对长度=(单一染色体总长度/全组染色体总长度)×100%;
染色体相对长度指数=单一染色体长度/全组染色体平均长度;
臂比值=长臂长度(L)/短臂长度(S);
核型不对称系数=全组染色体长臂总长度/全组染色体总长度×100%;
着丝点指数=短臂长度/单一染色体总长度×100%;
核型分析采用李懋学与陈瑞阳标准[11],依据Lever等两点四区命名系统[12],核型分类标准参照Stebbins的标准[13],参照Arano公式[14]计算核不对称系数。
2 结果与分析
2.1 取材时间
不同时间取材制作的染色体制片观察结果见表1,可知平邑甜茶种子根尖最佳取材时间是一天之中的11:00—11:30,此时间段的平邑甜茶种子根尖生长旺盛,中期分裂相对较多,形态清晰,便于取材制片。
2.2 预处理剂与预处理时间的选择
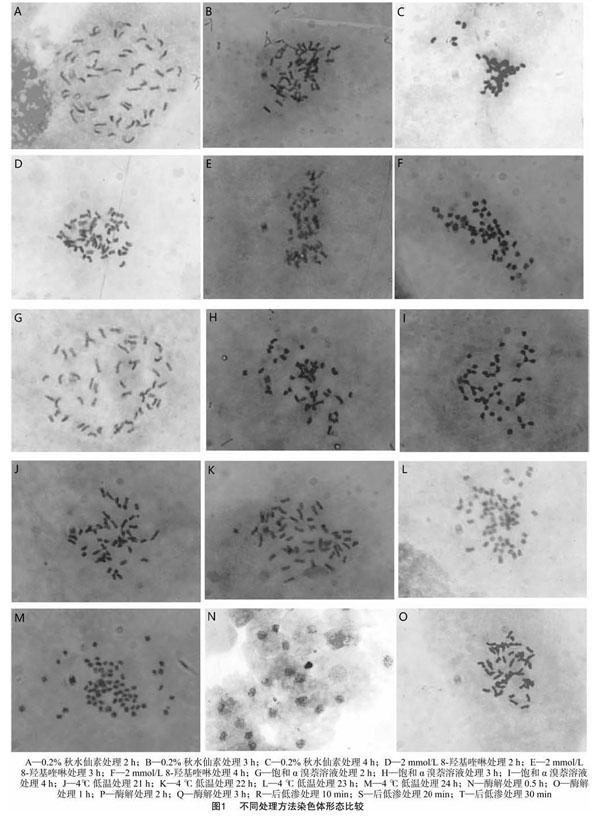
对不同预处理剂及处理时间进行比较,结果见表2和图1。其中使用0.2%秋水仙素和饱和α溴萘溶液处理2 h时根尖染色体都是凝缩程度不足,拖尾现象严重(图1-A、图1-G);用0.2%秋水仙素处理3 h和4 h粘连聚集现象又很严重(图1-B、图1-C);饱和α溴萘溶液处理3 h的染色体分散一般,但凝缩过度(图1-H),而处理4 h又出现了粘连,染色体依然凝缩过度(图1-I)。2 mmol/L 8-羟基喹啉溶液处理一直有粘连现象(图1-D、图1-E、图1-F),也就是说用预处理剂处理平邑甜茶根尖染色体都会出现粘连和聚集的现象。用4 ℃冰水混合物处理22 h以内染色体比较分散,没有粘连现象(图1-J、图1-K),而4 ℃冰水混合物处理23 h和24 h,染色体就凝缩过度,并有聚集现象(图1-L、图1-M),处理22 h染色体长度适宜,分散良好,清晰度好,是最佳的预处理方法(图1-K),因此本试验以4 ℃低温处理22 h的方式进行预处理制片。
2.3 解离时间的选择
利用2.5%果胶酶纤维素酶混合酶液在37 ℃下进行不同时间的酶解处理比较,结果见图1。其中酶解处理0.5 h时有大量细胞壁存在,大量的细胞堆积,不分散(图1-N);酶解处理1 h时细胞壁酶解效果一般,大量细胞质残存,染色体稍微粘连,不够分散(图1-O);酶解处理2 h时,酶解程度适宜,细胞壁被酶解掉,细胞质分散了,染色体分散良好,计数方便(图1-P);酶解3 h时,细胞出现破裂,染色体发生了缺失,酶解过度(图1-Q)。因此平邑甜茶根尖最佳酶解时间为2 h,酶解温度为37 ℃。
2.4 后低渗时间的选择
不同后低渗时间处理比较结果见图1,其中后低渗 10 min 时,平邑甜茶染色体并没有分散开,有粘连现象,计数困难(图1-R);后低渗20 min时染色体分散良好,计数方便,背景干净(图1-S);后低渗30 min时染色体过于分散,有丢失现象,后低渗过度(图1-T)。因此平邑甜茶根尖最佳后低渗时间为20 min。
2.5 平邑甜茶根尖细胞染色体核型分析
选择50个染色体分散良好的细胞观察计数,发现47个细胞染色体数目为51条,3个细胞染色体数目为63条,分别占总计数的94%和6%,因此确定平邑甜茶体细胞染色体数目为2n=51。根据平邑甜茶中期染色体对平邑甜茶进行核型分析,详见图2、图3和表3。
按Kuo的分类标准[15],可将平邑甜茶体细胞划分为4个组:L组(第1、第2、第3、第4对)、M2组(第5、第6、第7、第8、第9对)、M1组(第10、第11、第12、第13、第14、第15、第16对)、S组(第17对),染色体相对长度组成为2n=51=L+5M2+7M1+1S。
按照Levan等的分类标准[12],平邑甜茶核型公式为2n=3x=39m+12sm(SAT)。13对中部着丝粒染色体,4对近中部着丝粒染色体,在第3对染色体短臂上带有随体,染色体相对长度变化是1.3%~2.8%,着丝点指数变化是28.86%~49.76%,平均臂比值1.50。
根据Arano的分类方法[14],核型不对称系数是64.03%。
根据Stebbins的分类标准[13],染色体最长与最短染色体比值是2.13,臂比值大于2的染色體占全部染色体比例为0.12,属于2B型。
3 讨论
植物染色体制片技术是植物遗传学、染色体工程、植物细胞生物学、植物细胞分类学和物种生物学等众多学科的基本试验技术[16-18]。植物细胞染色体的观察和分析,对于染色体核型分析以及培养过程中细胞变异等遗传学现象的研究具有重要意义[19]。杜培等对花生根尖染色体制片,认为45%醋酸处理根尖效果比酶解去壁HCl解离经济实用,效果相差微小,该方法适用于花生、芝麻、水稻、玉米等植物[20];顾蔚等对华中五味子染色体制片,发现用0.1%秋水仙素处理1 h,1 mol/L 盐酸解离12 min制片分散效果最佳[21];虢国成等认为去壁低渗法制备大麦和玉米染色体制片比压片效果好[19];李晓玲等用对二氯苯处理3~4 h,1 mol/L HCl 60 ℃解离 13 min, 改良石碳酸品红染色10 min制作树型金银花染色体制片最佳[22];洪培培等用0.002 mol/L 8-羟基喹啉处理一串红根尖并用压片法制片效果最好[23];王超等用α-溴萘与对二氯苯混合液,0.002 mol/L 8-羟基喹啉和0.1%秋水仙素,对木薯根尖预处理2 h、酶解时间4 h,染色体制片效果最好[24]。这些研究表明不同物种制作染色体制片最佳处理条件不同,而对于平邑甜茶染色体制片报道很少,良好的染色体制片会受到很多因素的影响,取材就是个重要因素[21]。通过对平邑甜茶的根尖进行不同时间的取材,发现一天之中 09:00 前,其根尖细胞基本不分裂,从09:30开始平邑甜茶根尖细胞开始进入分裂期,但至11:00时处于分裂中期的细胞所占比例开始增加,持续到11:30后大部分细胞进入分裂后期直到12:00分裂基本结束。
染色体制片过程中预处理很重要,不少研究表明,预处理是染色体制备的关键步骤之一[16]。预处理持续时间的长短取决于染色体大小、材料大小、温度和植物的耐药性等诸多因素[25]。通过对平邑甜茶根尖进行4种不同预处理剂的不同时间处理,发现药物性预处理都会普遍导致染色体出现聚集和粘连的现象,处理时间不够,拖尾现象严重,处理时间过长染色体凝缩过度,这也印证了前人所述,预处理过度,染色体缩得很短,缢痕不清晰,压片时部分甚至全部染色体粘连或者聚缩成团,尤其是长时间处理易引起上述现象的发生[26]。而4 ℃低温处理能使染色体凝缩程度适宜,分散良好,冰水混合物处理是比较合适的预处理方式。
酶解的作用是软化细胞壁,并且将细胞间的果胶层除掉,方便制片。根据不同酶解时间的比较试验,确定时间过长染色体容易缺失,过短则酶解不彻底,细胞粘连,染色体不能得到释放,果胶纤维素混合酶液酶解2 h染色体分散良好,细胞质残留少。
后低渗是否适宜,常常是试验成败的关键之一,材料在蒸馏水中停留时间过长,会引起原生质体解体[27]。通过对平邑甜茶根尖后低渗时间的不同处理,发现后低渗短于10 min原生质并未破裂,染色体聚集现象严重,不分散;后低渗长于 30 min 原生质解体,染色体分散过度,容易丢失,时间过长。通过比较,后低渗20 min原生质刚刚解体,染色体分散良好,易于观察。
核型分析是探讨植物亲缘关系和进化趋势的一个重要途径,核型的类型是衡量物种进化程度的重要依据,在长期进化中,染色体数目、结构都在改变,核型也随之改变,早在20世纪80年代,在苹果属核型研究方面就有很多研究报道,蒲富慎对苹果属11个种进行染色体核型分析,发现山荆子、毛山荆子、新疆野苹果较为原始[28]。有研究表明我国苹果属中22个不同类型染色体数目和核型进而研究进化趋势[29-30],林盛华对苹果中3个杂交种染色体数目研究发现了10个单株是四倍体[4];肖艳等通过对苹果属植物6个类型核型分析,证明了苹果属植物多倍体和染色体倍性变异[31];本研究中,观察到平邑甜茶染色体属于小型染色体,染色体臂比变化为 1.01~2.46,差异不大,核型组成成分为中部着丝点染色体(m)、亚中部着丝点染色体(sm)核型属于2B型,这与梁国鲁等报道[30]一致。在染色体相对长度比,平均臂比、着丝点指数、相对长度、不对称系数方面有所差异,导致这种核型差异可能原因是无融合生殖中染色体结构产生了变化,但核型变化是否影响到繁殖能力,需要进一步研究。
參考文献:
[1]陈瑞阳,宋文芹,陈 晓,等. 植物染色体Giemsa分带技术的研究[J]. 植物学报,1979,21(1):11-18.
[2]Bikram G S,Kimber G. The giemsa c-banding karyotype of rye[J]. Proc.Nat,1974,71(4):1247-1249.
[3]Heneen W. Chromosome morphology in inbred rye[J]. Hereditas,2012,48(1-2):182-200.
[4]林盛华,刘捍中,蒲富慎. 苹果属植物不同倍性的杂种后代染色体数目观察[J]. 中国果树,1989(4):15-16,63.
[5]梁国鲁. 山荆子染色体中期G带带型的初步研究[J]. 遗传,1990,12(2):4-16,49.
[6]周 攀,董文轩,商月惠. 平邑甜茶染色体制片技术的风油精法[J]. 安徽农业科学,2007,35(6):1611-1611.
[7]朱 微. 植物染色体及染色体技术[M]. 北京:科学出版社,1982:2-87.
[8]祝水金. 遗传学实验指导[M]. 2版.北京:中国农业出版社,2005:6-7.
[9]詹少华. 大豆根尖染色体制片实验的教学改革[J]. 皖西学院学报,2009,25(2):65-67.
[10]陈 高,孙 航,孙卫邦. 改进的植物染色体制片方法[J]. 植物生理学通讯,2007,43(4):759-760.
[11]李懋学,陈瑞阳. 关于植物核型分析的标准化问题[J]. 武汉植物学研究,1985,3(4):297-302.
[12]Levean A,Fredga K,Sandberg A. Nomenclature for centromeric position on chromosome[J]. Hereditas,1964,52:201-220.
[13]Stebbins G L. Chromosomal evolution in higher plants[M]. London:Edward Arnold,1971:87-89.
[14]Arano H. Cytological studies in subfamily Carduoideae (Compositae) of Japan. Ⅸ. The karyotype analysis and phylogenetic considerations on Pertya and Ainsliaea[J]. The Botanic Magazine Tokyo,1963,76(895):32-39.
[15]Kuo S R,Wang T T,Huang T C. Karyotype analysis of some formosan gymnosperms[J]. Taiwania,1972,17(1):66-80.
[16]李懋学,张赞平. 作物染色体及其研究技术[M]. 北京:中国农业出版社,1966:1-40.
[17]李懋学,张敩方. 植物染色体技术[M]. 哈尔滨:东北林业大学出版社,1991:1-53.
[18]冯 午,刘春清. 培育多倍体西瓜的初步报告[J]. 北京大学学报(自然科学版),1962(3):303-308.
[19]虢国成,向 洋. 大麦和玉米染色体去壁低渗法制片及其核型分析[J]. 大麦与谷类科学,2008(2):8-11.
[20]杜 培,张新友,李丽娜,等. 高质量花生根尖细胞染色体制片方法研究[J]. 河南农业科学,2013,42(3):31-35.
[21]顾 蔚,卜海东,张成艳,等. 华中五味子染色体制片优化及核型分析[J]. 西北植物学报,2008,28(2):2262-2266.
[22]李晓玲,杨 进,王洪涛,等. 树型金银花染色体制片优化及核型分析[J]. 河南农业科学,2009(7):102-106.
[23]洪培培,杨建玉,陈洪伟,等. 一串红染色体制片技术优化与计数[J]. 西北植物学报,2011,31(10):2124-2128.
[24]王 超,王婧菲,庄南生,等. 木薯根尖染色体制片方法的优化[J]. 热带作物学报,2012,33(4):627-630.
[25]林秀琴,蔡 青,路 鑫,等. 甘蔗根尖染色体制片技术研究[J]. 中国农学通报,2011,27(27):104-108.
[26]李潜学. 对二氯苯在植物染色体预处理中的应用[J]. 遗传,1980,2(6):30-32.
[27]陈瑞阳,宋文芹,李秀兰. 植物有丝分裂染色体标本制作的新方法[J]. 植物学报,1979,21(3):297-298.
[28]蒲富慎,林盛华,李秀兰,等. 中国苹果属植物核型研究[J]. 植物科学学报,1985,3(4):451-456.
[29]陈瑞阳,宋文芹,李秀兰,等. 中国苹果属植物染色体数目报告[J]. 武汉植物学研究,1986,4(4):337-342.
[30]梁国鲁,李晓林. 中国苹果属植物染色体数目新观察[J]. 西南农业学报,1991,4(4):25-29.
[31]肖 艳,黄建昌,成明昊. 几种苹果属(Malus)植物核型研究[J]. 仲恺农业技术学院学报,1997,10(2):53-60.

