4个早熟梨品种叶片对黑斑病的抗病性评价及与抗氧化酶的关系
王宏 马娜 蔺经
摘要:对翠冠、苏翠1号、华酥和七月酥等4个梨品种,接种黑斑病菌,评价不同品种的发病率、发病程度、病斑生长速度。通过分析比较叶片中超氧阴离子自由基( O-2 · )、超氧化物歧化酶 (SOD) 、过氧化氢(H2O2)、过氧化氢酶 (CAT)的活性变化,探讨不同梨品种的抗病机制。结果表明,4个品种中,翠冠和苏翠1号较抗病,华酥、七月酥较感病。接种病原菌引起翠冠和苏翠1号梨叶片 O-2 · 和H2O2活性升高,同时抗氧化酶SOD和CAT活性也上升;华酥叶片 O-2 · 和SOD活性升高,但是CAT含量降低;而七月酥无论是活性氧或解毒酶含量均下降。表明活性氧信号参与了翠冠、苏翠1号和华酥对黑斑病的响应,而CAT作为解毒酶,参与了翠冠和苏翠1号对黑斑病的抗性响应。
关键词:梨;黑斑病;抗病性;活性氧;抗氧化酶
中图分类号: S436.612.1+4 文献标志码: A 文章编号:1002-1302(2019)02-0080-03
梨黑斑病是梨主要病害之一,由丝孢纲丝孢目链格孢属真菌[Alternaria alternata (Fr) Keissler]引起[1-2]。病原菌侵染叶片、果实、新稍,在病叶、病梢及病果上越冬[1]。来年春天,病部产生分生孢子,借风雨传播,进行初次侵染[1]。雨季,病原菌孢子迅速扩散,在1~2周内,60%~80%的叶片即可发病[1],对梨产业造成严重的经济损失,制约了梨产业的发展。
国内外对该病的防治有大量研究,目前防治该病的主要方法仍然是化学防治[2]。化学药剂的使用存在潜在的危害,会造成污染环境,影响人体健康,长期使用还会引起病原菌对化学药剂的抗药性等。提高梨树抗病能力是扩大梨果产量和改善梨果品质的关键。梨黑斑病菌是一种死体营养型病原真菌[3]。在长期的植物病原菌互作中,植物自身形成了多种防御机制,抵御了黑斑病菌的侵染[3]。研究砂梨不同品種对黑斑病的防御机制,为梨黑斑病的合理防治及砂梨抗黑斑病的分子育种奠定理论基础。
本研究室选育的苏翠1号以早熟梨华酥为母本,翠冠为父本杂交选育而成,该品种果实成熟早、品质优、外观好 [4],目前在生产中进行推广和应用。其对黑斑病的抗病性和抗病机理未有系统报道。本试验对包括翠冠、苏翠1号、华酥在内的4个梨品种接种黑斑病病原菌,调查了叶片发病情况及感病期间活性氧[超氧阴离子自由基( O-2 · )和过氧化氢(H2O2)]及活性氧清除酶[超氧化物歧化酶(SOD) 和过氧化氢酶(CAT)]的活性,为实际生产中梨黑斑病的合理防治和砂梨抗黑斑病育种提供理论指导。
1 材料与方法
1.1 试验时间地点
试验于2017年在江苏省农业科学院果树所梨研究室实验室进行。
1.2 试验材料
1.2.1 供试梨品种 翠冠、苏翠1号、华酥、七月酥,均来源于江苏省农业科学院梨种质资源圃。
1.2.2 供试菌株 黑斑病病原菌[Alternaria alternata (Fr) Keissler],来源于江苏省农业科学院植保所刘凤权老师研究室[5]。
1.3 接种方法
黑斑病病原菌接种在土豆琼脂培养基上,16 h(25 ℃)/8 h(22 ℃)光周期培养4 周后,收集病原菌孢子,将孢子悬浮液浓度稀释为1.0×106 个孢子/mL用于接种叶片[3]。取生长4周的植株顶部往下第4 张叶片,将叶片正面向上放入0.6%的琼脂培养基上,无菌针刺穿叶片表面,接种病原菌[3]。处理和对照各80张叶片,并平均分作2组,一组用于接种病原菌,每张叶片接种2滴 10 μL 孢子悬浮液,另一组只接种无菌水。叶片接种后置于25 ℃暗培养,每天观察叶片发病情况,以发病率(发病叶片占总接种叶片的比例)和病斑直径作为衡量发病程度的指标[3]。
1.4 检测项目及方法
活性氧自由基、SOD、H2O2及CAT的活性测定均采用江苏南京建成生物工程研究所响应的试剂盒,试剂盒编号分别为A052、A001-1-1、A064、A007-1-1[3]。
2 结果与分析
2.1 4个梨品种叶片黑斑病发病差异
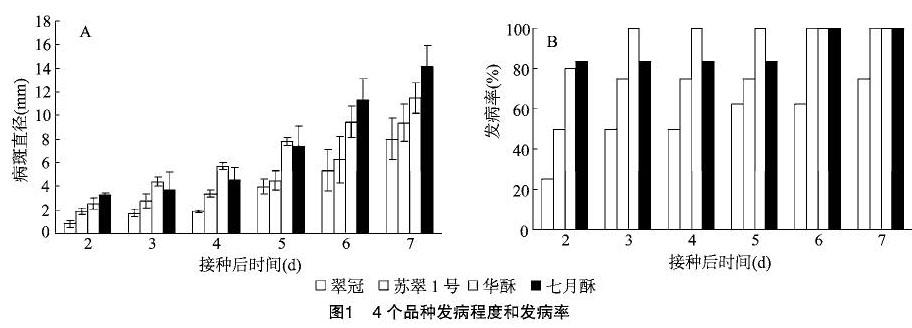
叶片在接种后2 d形成病斑,4个品种中,翠冠和苏翠1号发病程度较轻,其次是华酥,发病最重的为七月酥(图1-A)。接种病原菌后2 d,翠冠的发病率为25%,华酥为80%,七月酥为83.3%。随着接种时间延长,翠冠叶片上的发病率逐渐上升,到接种后7 d为75%。接种后3~5 d,苏翠1号发病率为75%;接种接种后6 d达到了100%。接种后 3 d,华酥的发病率达到了100%。七月酥在接种后接种后 3~5 d的发病率仍为83.3%,接种后6 d达到了100%(图1-B)。4个品种上病斑每日平均生长速率不同。日平均生长速率分别为翠冠 1.43 mm/d,苏翠1号1.50 mm/d,华酥 1.79 mm/d,七月酥2.19 mm/d。
2.2 超氧阴离子自由基活性的变化
接种病原菌后,翠冠、苏翠1号、华酥和七月酥的 O-2 · 活性都受到不同程度的影响(图2)。在接种后3 d,前3个品种的 O-2 · 活性都高于未接种时,接种后5 d, O-2 · 活性下降。接种后,七月酥的 O-2 · 活性下降。
2.3 SOD活性的变化
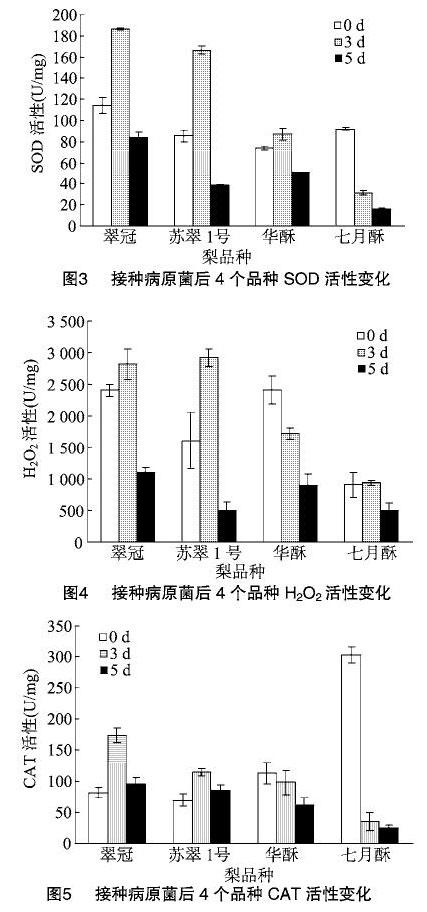
接种病原菌后,翠冠、苏翠1号、华酥和七月酥的SOD活性都受到不同程度的影响(图3)。在接种后3 d,前3个品种的SOD活性都高于未接种时,接种后5 d,SOD活性下降。接种后,七月酥的SOD活性下降。
2.4 H2O2活性的变化
與接种前比较,接种病原菌后 3 d,翠冠和苏翠1号的H2O2活性上升,而华酥和七月酥的H2O2活性下降(图4)。在接种后5 d,4个品种的H2O2活性均下降。
2.5 CAT活性的变化
与接种前比较,接种病原菌后,翠冠和苏翠1号的CAT活性上升,而华酥和七月酥的CAT活性下降(图5)。
3 讨论与结论
梨黑斑病是梨树主要病害之一,在我国各梨产区均有发生,尤其在南方夏季多雨时,梨园树体发病严重[1],造成较大的经济损失,并在梨进出口贸易中受到进口国的严密关注[1]。防治梨黑斑病的关键是抗病育种,鉴定梨种质资源对黑斑病的抗性是培育新品种的关键。苏翠1号为本研究室培育的新品种,因其成熟早,品质忧,外观好[4],在生产中推广应用后受到广泛好评。但是其对黑斑病的抗性未有系统报道。本试验用其母本华酥、父本翠冠以及七月酥作为对照品种,调查了离体条件下,4个品种梨叶片对黑斑病的抗性,并分析了抗病机制。结果表明4个早熟品种中,翠冠和苏翠1号较抗病,其次是华酥,七月酥最感病。
在植物与死体营养型病原菌互作中,病原菌一般通过分泌多种毒力因子,调节宿主响应(如植物激素、活性氧(ROS)等激活细胞坏死)来实现定植蔓延[6]。ROS作为一种信号分子诱导抗性反应,促进细胞坏死,并且具有抗菌活性[7]。ROS以 O-2 · 和H2O2的形式存在。SOD催化 O-2 · 形成H2O2[8] ,胞外形成的H2O2进入细胞内,引起细胞程序性死亡[9]。死体营养型病原菌从坏死的组织吸取营养,从而大量扩展[9]。CAT作为解毒酶,把H2O2分解为H2O和O2[8]。研究表明,CAT突变体表现出了H2O2诱导的细胞死亡症状[10]。很多研究也证实,对于死体营养型病原菌,植物产生的ROS毒性的大小直接取决于植物产生的超氧化物和过氧化氢的浓度[9]。本试验比较了接种黑斑病病原菌后,4个品种的活性氧和抗氧化酶的活性。接种早期,翠冠和苏翠1号的 O-2 · 、SOD、H2O2和CAT的活性较高,而华酥和七月酥上 O-2 · 、SOD、H2O2和CAT的活性下降。表明病原菌触发了翠冠和苏翠1号产生ROS,而较高的CAT含量表明CAT参与H2O2的解毒,抑制了H2O2引起的细胞死亡,从而提高了这2个品种的抗病性。
参考文献:
[1]王 宏. 梨黑斑病菌(Alternaria alternata Japanese pear pathotype)生物学特性及生物-化学协同防治技术的研究[D]. 南京:南京农业大学,2003:1-6.
[2]杨晓平.梨黑斑病菌鉴定及砂梨抗黑斑病分子机制探讨[D]. 武汉:武汉大学,2015:1-10.
[3]Wang H,Lin J,Chang Y,et al. Comparative transcriptomic analysis reveals that ethylene/H2O2-mediated hypersensitive response and programmed cell death determine the compatible interaction of sand pear and Alternaria alternate[J]. Frontiers in Plant Science,2017,8:195.
[4]蔺 经,盛宝龙,李晓刚,等. 早熟砂梨新品种‘苏翠1号[J]. 果农之友,2013,40(11):7-8.
[5]杨晓蕾,钱国良,范加勤,等. 梨黑斑病菌拮抗细菌的筛选鉴定及其拮抗活性的研究[J]. 南京农业大学学报,2014,37(1):68-74.
[6]Takeshi S,Tomoko S,Yoshihiro N,et al. Ultrastructural localization of hydrogen peroxide in host leaves treated with AK-toxin Ⅰ produced by Alternaria alternate Japanese pear pathotype[J]. Journal of General Plant Pathology,2002,68(1):38-45.
[7]Rossi F R,Gárriz A,Marina M,et al. The sesquiterpene botrydial produced by Botrytis cinerea induces the hypersensitive response on plant tissues and its action is modulated by salicylic acid and jasmonic acid signaling[J]. Molecular Plant-Microbe Interactions,2011,24(8):888-896.
[8]Bestwick C S,Brown I R,Bennett M H,et al. Localization of Hydrogen peroxide accumulation during the hypersensitive reaction of lettuce cells to Pseudomonas syringae pv. phaseolicola[J]. Plant Cell,1997,9(2):209-221.
[9]Govrin E M,Levine A. The hypersensitive response facilitates plant infection by the necrotrophic pathogen Botrytis cinerea[J]. Current Biology,2000,10(13):751-757.
[10]Greenberg J T,Yao N. The role and regulation of programmed cell death in plant-pathogen interactions[J]. Cellular Microbiology,2004,6(3):201-211.

