TAM受体在肝脏疾病中的免疫调节作用
吴凤天 杨 英 王云云 朱海红 陈 智
TAM酪氨酸激酶受体是新近发现的具有广泛生物学效应的信号蛋白分子。作为Toll样受体(Toll like receptors, TLRs)及细胞因子诱导炎性免疫反应的多效性抑制剂,TAM受体家族在炎症环境下通过调控细胞因子等进一步调控固有免疫,促进组织修复,减轻炎性反应[1]。和其他酪氨酸激酶受体家族(receptor tyrosine kinases, RTKs)一样,它的下游分子也参与到生长因子信号通路中,这些下游分子在人体很多肿瘤组织中呈过表达状态,并且和肿瘤细胞的增殖、转移等相关。TAM家族的独特之处在于它有特殊的配体结构,这些配体在固有免疫和适应性免疫的调节中发挥着重要作用[2]。本文将围绕TAM受体家族配体、TAM家族的免疫调节作用以及TAM受体家族与肝脏疾病(包括肝癌、肝衰竭、肝纤维化和丙肝等)发生、发展之间的关系进行阐述,有助于深入理解有关TAM受体对各种肝脏疾病的免疫调节作用。
一、TAM受体家族的配体
最早发现的TAM受体家族的两个共同配体蛋白是Gas 6和Pro S。两者同为维生素K依赖蛋白,Pro S主要由肝细胞和内皮细胞产生,Gas 6主要表达在血管内皮细胞及平滑肌细胞,两者参与到MERTK介导的凋亡细胞吞噬清除过程;巨噬细胞表面的MERTK 蛋白可以通过与凋亡细胞表面翻转的磷酯酰丝氨酸(phosphatidylserine, PtdSer)结合,促进巨噬细胞更早地发挥胞吞作用(图1)[3]。

图1 巨噬细胞通过TAM受体发挥胞吞作用
近年来发现,半乳糖凝集素3(galectin-3)、桶蛋白(tubby)和桶装样蛋白1(tubby‐like protein 1,TULP-1)也是TAM受体家族的配体。其中半乳糖凝集素3主要由巨噬细胞产生,在组织损伤时表达上升,例如在心肌梗死或急/慢性肝损伤时,它募集纤维母细胞至损伤组织,促进组织纤维化。半乳糖凝集素3有一系列下游信号级联,但与TAM受体家族相关的信号作用目前尚不明确,目前仅知它通过MERTK分子来发挥吞噬作用,仍需进一步研究[4]。而tubby 和TULP-1是TAM受体家族中MERTK的专有配体,它们表达在视网膜上皮支持细胞及巨噬细胞表面,促进细胞胞吞作用[5]。
二、TAM家族在免疫调节中的作用
TAM受体家族TAM是负向调节受体,是Toll样受体及细胞因子诱导炎性免疫反应的多效性抑制剂,TAM受体的减少会引起组织持续的炎性损伤,这在无菌或者是感染性炎症的实验模型中都可以得到验证。在模拟内毒素血症环境下,MERTK敲除的模型小鼠体内存在持续高浓度的肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)及白介素1(interleukin-1,IL-1)并引起组织损伤,这些小鼠大部分发生了感染性休克甚至死亡[6]。Ruthin等表明大鼠树突状细胞的Toll样信号通路激活并产生炎性细胞因子,这一过程可被TAM受体抑制,尤其是MERTK和Axl分子。TAM受体可以介导细胞因子抑制因子1(suppressors of cytokine signaling 1,SOCS 1)及细胞因子抑制因子3(suppressors of cytokine signaling 3,SOCS 3)参与到Toll样受体信号通路激活的过程,并在其中一些节点发挥抑制细胞因子生成的作用。这也证明了TAM受体家族是通过调节细胞因子从而实现固有免疫的调控。反过来SOCS 1及SOCS 3的持续增加也会使下游TAM受体激活,在这个负反馈过程中,细胞因子作为TLR信号通路的产物与它们各自的受体结合并激活信号转导与转录激活因子1(signal transducers and activators of transcription1,STAT 1),作为炎性细胞因子,STAT 1也可以诱导Axl的表达。
在Gas 6或Pro S的协同作用下,Axl可以直接结合白细胞干扰素(interferon, IFN)相关受体,这个蛋白复合物可以改变STAT 1下游途径转而激活SOCS 1及SOCS 3,从而阻断被病原体活化的TLR信号通路及其下游细胞因子的释放[7]。根据以往对TLR信号通路的大量研究,笔者已经认识到TLR信号通路再识别和清除外来病原体,引发炎性反应,同时启动体内固有免疫应答,调节特异性免疫等发挥着重要作用。但在炎症恢复阶段,负向调控分子必须及时终止炎性反应,才可以避免炎症的进一步扩大及慢性炎症对机体产生的损伤。而上述研究以及笔者所在实验室的前期实验结果均证实TAM受体家族在负向调控TLR信号通路诱导的炎性反应方面起着关键作用。
另外,巨噬细胞的TAM信号通路既可以促进细胞发挥胞吞作用,又可以影响细胞因子的释放,从而促进伤口愈合及抑制炎症。MERTK介导的胞吞作用促进了Th 2型细胞因子的释放,这些细胞因子包括白细胞介素4(interleukin-4,IL-4),白细胞介素10(interleukin-10,IL-10),转化生长因子beta(transforming growth factor beta, TGF-β)[8]。一项小鼠体内实验表明这一作用是通过抑制NF-κB信号通路、激活磷脂酰肌醇-3(phosphatidylinositol 3-kinase,PI3K)信号通路来实现。凋亡细胞的摄入产物进一步诱导了MERTK表达,细胞膜碎片的胆固醇代谢物激活了肝X受体(liver X receptor, LXR),LXR结合并激活了MERTK启动子,并促进在组织损伤过程中抑炎因子的释放[9]。目前TAM受体的促进剂及抑制剂均已研制成功,若能深入研究明确TAM受体在炎性反应中如何有效调控固有免疫应答等,或可为病原体诱发过度炎性反应导致机体免疫失衡(例如重症肺炎、急性肝衰竭等)这一问题提供新的解决方法。
三、TAM受体家族与肝癌
TAM受体作为酪氨酸激酶受体家族的一份子,不仅具有致癌性,还可以促进肿瘤细胞生存,产生耐药性并向远处转移[10]。正如前文提到的,TAM受体相较其他RTKs而言,其独特的一点正是其配体Gas 6可以和凋亡细胞细胞膜暴露的PtdSer结合,激活巨噬细胞表面的MERTK分子,促进巨噬细胞的胞吞作用并诱导巨噬细胞向抑炎方向极化。在肿瘤内部,不仅存在大量凋亡细胞,肿瘤细胞还能自分泌或旁分泌配体Gas 6,肿瘤细胞微环境处在抑炎的免疫抑制状态下,更加有利于它的生存及远处转移。He等研究表明,在体外实验中,肝癌细胞表面Axl的表达和肝癌淋巴结转移有关。用小干扰RNA抑制Axl在小鼠肝癌细胞株Hca-F和Hca-P的表达后,细胞的增殖能力明显降低。无论是体外实验还是体内实验都显示,配体Gas 6通过Axl介导的某种信号通路来发挥促进肝癌细胞的增殖和淋巴结转移的作用,其中可能和Axl引起Cyr 61蛋白下调有关,需要进一步实验支持论证[11]。
在肝细胞癌中,肝内转移常与肝癌细胞的上皮-间质转化(epithelial-mesenchymal transition ,EMT)相关。Reichl等研究表明EMT转化的肝癌细胞中Axl受体存在上调现象。在体外实验中, Axl表达下调会引起间质转化的肝癌细胞的侵袭性和跨内皮迁移能力减弱,反之Axl过表达会诱导肝癌细胞的转移定植。TGF-β在体外能抑制肝细胞增殖和诱导细胞凋亡,在肝细胞癌中会促进癌细胞的增殖、侵袭和转移。进一步研究发现,抑制Axl的表达会减弱肝细胞对TGF-β介导的生长抑制作用的耐受性[12]。这一作用可能与Axl/14-3-3ζ信号通路相关。 Axl/14-3-3ζ信号通路激活会引起Ser 213处Smad 3接头区(Smad 3L)的磷酸化,导致肿瘤细胞中TGF-β靶基因如PAI 1,MMP 9和Snail的上调以及增强的TGF-β1在间质肝癌细胞中的分泌[13]。总之,肝癌细胞上Axl高表达会促进癌细胞的血管侵袭,促进肝移植后肿瘤复发甚至减低患者远期生存率[10]。一项关于索拉菲尼耐药的肝细胞癌研究发现,TYRO3在肝癌细胞尤其是索拉菲尼耐药的肝癌细胞中表达明显升高。该研究前期从体外实验及体内实验两个层面确认miR-7-5p (miR-7)在人肝细胞癌中发挥的抑癌作用。进一步研究发现TYRO3通过PI3K/PKB途径调节Huh-7细胞的增殖、迁移和侵入,并且随着索拉菲尼耐药的产生而表达显著升高。而miR-7可靶向作用于TYRO3基因,从而有效抑制了索拉非尼敏感和索拉非尼耐药Huh-7细胞中的TYRO3表达,进一步抑制癌细胞的迁移和侵袭[11]。
四、TAM受体家族与肝癌治疗靶点
TAM受体在促进上皮-间质转换、侵袭及转移等肿瘤生物学行为发挥多种作用,并与晚期肝癌的一线药物索拉菲尼的耐药有关。卡博替尼是新兴多激酶抑制剂,作用靶点包括除了TAM受体中的Axl,还包括c-MET、RET、ROS1、VEGFR1-3等。它的一项2期、随机停药临床实验显示出对肝癌具有抗肿瘤效果[14]。为了评估卡博替尼对于接受索拉菲尼或者其余系统治疗后的晚期肝癌患者的抗肿瘤作用,一项国际多中心随机、双盲、安慰剂对照的3期临床试验因此展开。最后实验数据表明使用卡博替尼患者的中位生存期为10.2个月(安慰剂8.0个月),无进展生存期为5.2个月(安慰剂1.9个月),这显示其对晚期肝细胞癌具有抗肿瘤效果,对于接受过系统治疗的晚期肝癌患者,卡博替尼相较于安慰剂均可延长患者的总生存期及无进展生存期[15]。可预见这一临床实验的结果进一步激发了研究者在肝癌领域中对TAM受体的研究热情,目前急需解决的问题是进一步研究TAM受体在肝癌中发挥的抗肿瘤作用的具体机制。根据2015年版的《慢性乙型肝炎防治指南》提供的数据显示,我国肝癌患者中由乙型肝炎引起的约占80%[16]。另外结合TAM受体在炎性反应中对机体免疫的调节作用,为避免炎癌转换,探索其通过调节机体免疫应答来实现抗肿瘤效应的可行性。
五、TAM受体家族与肝衰竭
在急性肝衰竭和慢加急性肝衰竭(acute on chronic liver failure,ACLF)中均有关于MERTK信号通路的相关研究,MERTK在急性肝衰竭中可能发挥保护作用。小鼠肝脏模型的肝动脉结扎后不久,血清Gas 6水平升高。通过蛋白质印迹实验分析肝匀浆组织提取物,提示在缺血性损伤过程中MERTK磷酸化而非Axl选择性增加,这表明MERTK介导的信号通路优先发挥作用。Gas 6敲除小鼠表现出更活跃的炎性细胞因子转录水平(IL-1A、TNF-α),并在部分肝缺血损伤后患者中更容易出现暴发性肝衰竭。补充重组Gas 6蛋白可以大大缓解暴发性肝衰竭的发生[17]。在体外实验中,仍存在Gas 6对细胞因子的调控作用,同样的实验结果在库普弗细胞系上可以得到复制[18]。
肝衰竭患者发病的一个重要原因是全身炎性反应。Bernsmeier等开展的研究显示,和健康组及肝硬化组对比,慢加急性肝衰竭的患者外周血中MERTK阳性的单核细胞明显增多,同时Gas 6、Pro S1、半乳凝素-3以及磷酸化的MERTK均升高,提示MERTK信号通路在肝衰竭时被激活。而用ACLF患者的血浆刺激健康人的单核细胞,同样观察到MERTK阳性表型的单核细胞增多。MERTK阳性单核细胞表现出对内毒素的刺激不敏感。而再用小分子MERTK抑制剂作用于单核细胞,则发现可以恢复细胞对脂多糖刺激的反应并产生TNF-α和IL-6。研究者认为MERTK阳性单核细胞更容易发生跨内皮迁移,并提出了一个建立动态模型来观察外周血单核细胞在损伤肝组织中的募集。研究结论得出,受损的肝组织可以导致MERTK表达增加。在全身炎性反应中,内皮功能障碍能使肝脏内的单核细胞逆转移到外周血液和局部淋巴结,可能会导致免疫休克及更易发生的脓毒血症[18]。Taehoon Chun等在体外实验中发现,Axl可以通过诱导巨噬细胞自噬来抑制NLRP 3炎性小体从而起到抑制肝脏炎性反应的效应[19]。
目前TAM家族在肝脏炎症中的负反馈调节方面的基础研究并不少见,但如何将成果进一步转化应用于临床之中,仍值得思考。
六、TAM受体家族与肝脏纤维化
在肝衰竭中,TAM受体家族可能有利于维持肝脏免疫稳定状态,但在慢性肝病中TAM受体则与肝脏纤维化密切相关。肝星状细胞的激活在肝损伤进展中起关键作用,在慢性肝病中,这些细胞分泌胶原蛋白和其他细胞外基质蛋白,促进肝脏纤维化并向肝硬化发展。已有小鼠实验证实TAM受体家族参与到慢性肝损伤过程中。暴露在四氯化碳中的模型小鼠,其肝星状细胞的活化依赖于Gas 6介导的Axl的激活,进而上调信号蛋白激酶B(protein kinase B,PKB)和NF-κB(图2)[20]。Axl的转录和翻译增加也引起了下游肝脏巨噬细胞和星状细胞的活化。在另一种慢性肝损伤模型中,用蛋氨酸-胆碱缺乏饲料喂养小鼠,使其诱发脂肪性肝炎,在这种饮食条件下,Gas 6基因敲除小鼠显示肝星状细胞及TGF-β的表达被抑制。此外,和野生型小鼠比较,肝脏坏死性炎症和脂肪变性均延迟发生; TNF-α、IL-1β和巨噬细胞趋化蛋白1 的信使RNA表达均降低,并且7天后解剖Gas 6基因敲除的小鼠肝脏时,发现其肝脏的巨噬细胞浸润减少[20]。在Petta等[21]开展的一项700余例关于非酒精性肝硬化患者的临床队列研究中发现,携带MERTK AA等位基因的患者明显比GA/GG等位基因患者的肝纤维化程度低,MERTK表达在人类肝脏星状细胞表面并促进肝纤维化的形成。
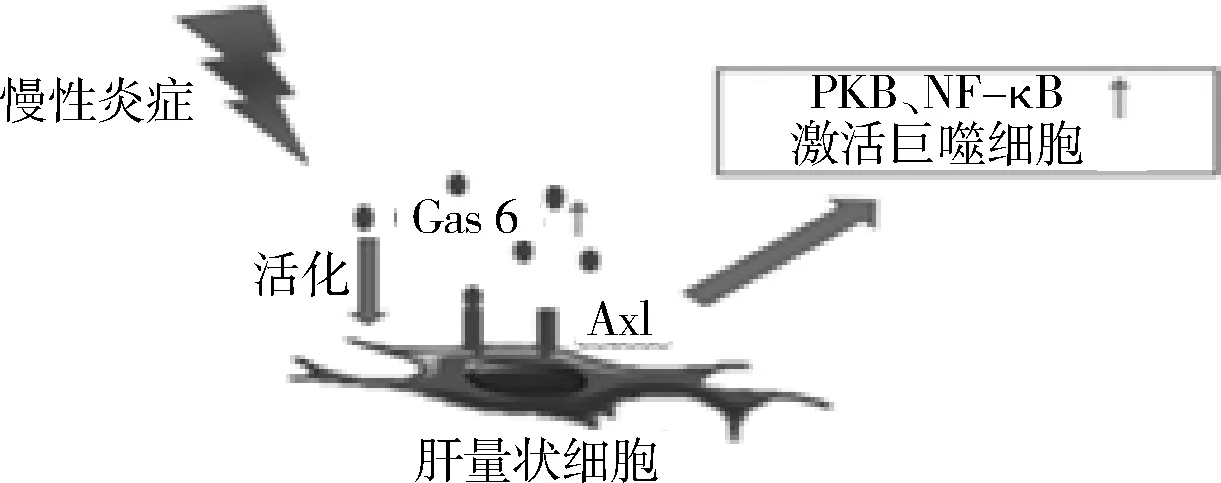
图2 慢性炎症下肝星状细胞被Axl激活
七、TAM受体家族与丙肝
最近在慢性丙型肝炎病毒(hepatitis C virus, HCV)感染的患者研究中发现,强烈的干扰素反应可以促进病毒清除。慢性丙型肝炎患者体内发生干扰素Ⅰ/Ⅲ型信号通路的长期激活及其下游IFN刺激基因(IFN-stimulated genes, ISGs)的高基线表达,这使得丙肝患者在接受治疗之前是不太可能获得持续的病毒学应答的,人们认为这是由于缺乏对ISGs的敏感度而导致的。这种现象的机制没有完全阐明。然而,Read等[22]研究表明,无论在体外或体内模型中,慢性HCV感染的肝细胞中Axl表达上调。
综上所述,TAM受体及其配体是广泛的在肝脏中表达并有助于肝脏免疫调节,通过细胞因子信号通路调节固有免疫来维持稳态。目前关于TAM受体家族的研究主要聚焦在免疫调节和肿瘤生物学两个方面。正如上文所说, TAM受体在肝衰竭中发挥着抑制免疫应答过度活化,阻止炎症重症化的重要作用。在慢性肝病中,TAM受体可能参与促进肝星状细胞的活化过程,引起肝脏纤维化。不过目前TAM受体对其他炎性肝脏疾病的影响仍未阐述清楚,因此,进一步研究TAM信号在其他免疫介导的肝脏炎症疾病中的作用,并针对肝病时异常TAM信号转导区域进行靶向干预,或许会开创肝病治疗的新局面。同时,TAM受体在人类大多数癌症中过表达,起着抑制宿主抗肿瘤免疫作用,促进了肿瘤转移的作用。同样的情况也存在肝细胞癌中,TAM受体的配体Gas 6对肿瘤相关巨噬细胞的影响,以及在调节NK细胞,CD4+T细胞,和CD8+T细胞来促进肿瘤进展的机制方面仍待进一步研究。这些发现极有可能推动针对肝细胞癌免疫疗法的发展。

