载三氧化二砷PLGA微球的制备与体外释放对肝癌的影响
吴育民 杜端明 陈娟萍 刘春霖
三氧化二砷(arsenic trioxide,As2O3)是中药砒霜的主要有效成分[1]。最早是治疗疟疾、结核病和梅毒的辅助药物,后来被用于治疗急性早幼粒白血病,取得了一定的疗效,接着发现三氧化二砷对肝癌和肺癌等肿瘤也有一定的抑制作用,并开发了三氧化二砷注射液用于临床治疗[2-4]。三氧化二砷能够影响细胞周期,抑制肿瘤细胞增殖与迁移,还能够诱导肿瘤细胞凋亡,可能通过下调Bcl-2/bax 基因的表达,使线粒体膜PT 通道开放,释放Cyto-C、AIF、钙离子等凋亡激发因子使细胞走向凋亡[5-7]。有研究发现,三氧化二砷能促进肿瘤血管内皮细胞的凋亡,干扰内皮细胞和肿瘤细胞之间的相互作用,从而诱导内皮细胞凋亡,抑制肿瘤血管生成,间接抑制肿瘤生长[8-10]。
三氧化二砷虽然能够抑制肿瘤生长,但也存在许多问题。首先是毒副作用,三氧化二砷在杀灭肿瘤细胞的同时对正常细胞损伤较大,具有较强的毒性,其次三氧化二砷水溶性较小,给药时容易析出。因此有必要改进药物给药方式,构建药物载体,更好地更高效低毒地进行药物控制给药。乳酸/羟基乙酸共聚物(polylactic-co-glyconlic acid,PLGA)由乳酸和羟基乙酸缩合而成,可经人体正常代谢,最终降解为H2O和CO2,因此几乎对生物体无毒副作用[11],具有良好的生物相容性和可降解性,可应用于药物载体研究,该微球体系对包埋的药物具有保护作用,并能够靶向到到某些特殊,控制药物释放,延长药物作用时间,降低药物毒性和刺激性等优点[12-13]。因此本研究摸索了PLGA微球的制备方法,并将As2O3成功包埋在PLGA 微球里,并进行相关表征,模拟体内环境控制释放As2O3,为进一步的载As2O3PLGA 微球体内实验打下基础。
1 材料与方法
1.1 主要试剂和仪器
试剂。PLGA:aladdin P133293;三氧化二砷:北京双鹭药业; 20170701;PVA:aladdin P105126;二氯甲烷:AR 500 ml;PBS:Solarbio 20171211。
仪器。冷冻干燥机:上海比朗 FD-1A-50;旋转蒸发仪:山东博科RE-501;匀浆机:新芝 S10;恒温水浴锅:郑州宏朗 HH-2;药品冷藏柜:欧宝科技 SF-477S;温控摇床:太仓THZ-98;电感耦合等离子体质谱仪(ICP-MS):美国PE公司optima 8000;激光粒度仪:马尔文Zetasizer nano zs90。
1.2 载As2O3的 PLGA 微球制备
采用复乳溶剂蒸发法,将200 mg PLGA溶解在10 ml二氯甲烷溶液中,将 10 mg As2O3加入上述溶液中,用手持式匀浆机在5 000 rpm高速搅拌10 s,形成初乳溶液;迅速将初乳溶液倒入10 ml 3% PVA中,冰浴下10000 rpm匀浆搅拌10 s,形成复乳溶液;将复乳溶液倒入500 ml 0.5% PVA中,室温下磁力搅拌2 h,减压蒸馏6 h去除其中残余的有机溶剂,5 000 rpm离心15 min,去离子水洗3次,将沉淀冷冻干燥可得到 PLGA 微球载As2O3,4 ℃保存。
采用同样的方法制备不加药物的空白 PLGA 微球粉末。
1.3 载As2O3的PLGA粒径测定
称取一定量载As2O3的PLGA微球(或空白PLGA微球)溶于含0.5% Tween 80的水中使得浓度为1 mg/ml,超声分散10 min后立即用激光粒度仪测定粒径。
1.4 载As2O3的PLGA 微球体外释放
取制备好的载As2O3的PLGA微球溶于3 ml PBS中溶解混匀混匀,37 ℃条件下,200 rpm震荡培养,每隔24 h取样,3 000 r/min离心5 min取上清与4 ℃保存,并补液3 ml继续培养,连续19天取样。连续取样完成后,利用ICP-MS测定砷含量换算成As2O3的含量,绘制释放曲线。
1.5 兔肝癌模型造模
VX2 细胞培养:从液氮中取出冻存管、用PE手套包裹后用镊子迅速将其置于38 ℃~40 ℃温水中并不断搅动。使冻存管中的冻存物在1 min之内融化,打开冻存管,迅速将细胞悬液吸到已经装有10 ml特定培养基的离心管中,混匀将细胞转移至培养瓶中,37 ℃培养,第二天观察生长情况,换液继续培养。弃去培养上清,PBS洗两遍,0.25%胰酶(含0.02% EDTA)消化3 min,加入DMEM高糖培养基终止消化并悬起细胞;收集细胞至离心管中,1 000 rpm离心3 min,弃尽上清,加入 DMEM 高糖培养基吸管吹匀;将上述细胞悬液稀释至适宜细胞密度后加入准备好的培养皿中,于37 ℃ 5%二氧化碳培养箱中培养。
肿瘤细胞接种:收集生长状态良好的VX2细胞,消化悬浮后接种在新西兰兔右侧后腿,1~2周后基本形成肿瘤,之后后进行肝癌模型造模。
兔肝癌模型建立:将成瘤后新西兰兔的肿瘤取下,裁剪成2~3 mm3大小瘤粒。麻醉移植兔子,剑突下约2 cm开口,将肝脏暴露在视野下,用显微镊子夹起瘤块,包埋在肝脏中,深约1 cm,待肝脏无瘤粒溜出、无出血,关闭腹腔,缝合。
2 结果
2.1 载As2O3的PLGA微球制备
载As2O3的 PLGA 微球以及空载的PLGA微球扫描电镜图片,都是均匀的圆球状,大小均匀,形状规则稳定。空载的PLGA微球更加的光滑,载 As2O3的 PLGA 微球表面较为粗糙,有的还有部分凹陷,但更为均一。
2.2 载As2O3 的PLGA微球粒径测定
如下图1所示,两种微球粒径的比较,可以观察到粒径差距不大,主要均分布在20~30 μm之间,说明包埋 As2O3之后的PLGA微球几乎不受影响,与空载微球相差无异。显示了PLGA微球良好的稳定性和优异的药物包埋能力。
2.3 载 As2O3 的PLGA 微球体外释放
图2显示的是载 As2O3的PLGA 微球体外释放的累计释放曲线,随着时间进行 As2O3缓慢均匀的从 PLGA 中释放出来,逐渐增多。由图2可以看出一开始释放速率较快,随后逐渐减缓直至释放完全。载As2O3PLGA微球体外释放在15天趋近于释放完全。
3 讨论
三氧化二砷拥有良好的抗肿瘤效果,广泛地应用于各种实体瘤及白血病的治疗,但由于其水溶性和毒副作用限制了其更加广泛和高效率的应用。本实验采用PLGA微球作为药物载体进行包埋As2O3,制备成载As2O3的 PLGA 微球制剂,实现药物的控制释放,降低As2O3的毒性,提高As2O3的利用率。
首先,我们通过优化工艺改善制备条件,采用复乳溶剂蒸发法制备了均一稳定的PLGA微球,并通过在制备微球过程中加入了As2O3,实现了包埋As2O3的PLGA微球的制备,扫描电镜分析载As2O3的PLGA微球与空载的PLGA微球相比,差别不大,只是略微的微球表面粗糙,个别微球表面凹陷,宏观观察呈白色粉末(空载PLGA也呈白色粉末状),表明As2O3已经被包埋进去。激光粒度仪对空载和载 As2O3的PLGA微球进行表征,粒径大部分集中在20~30 μm之间,并没有因为 As2O3而改变,说明了PLGA良好的药物包埋能力和稳定的结构。
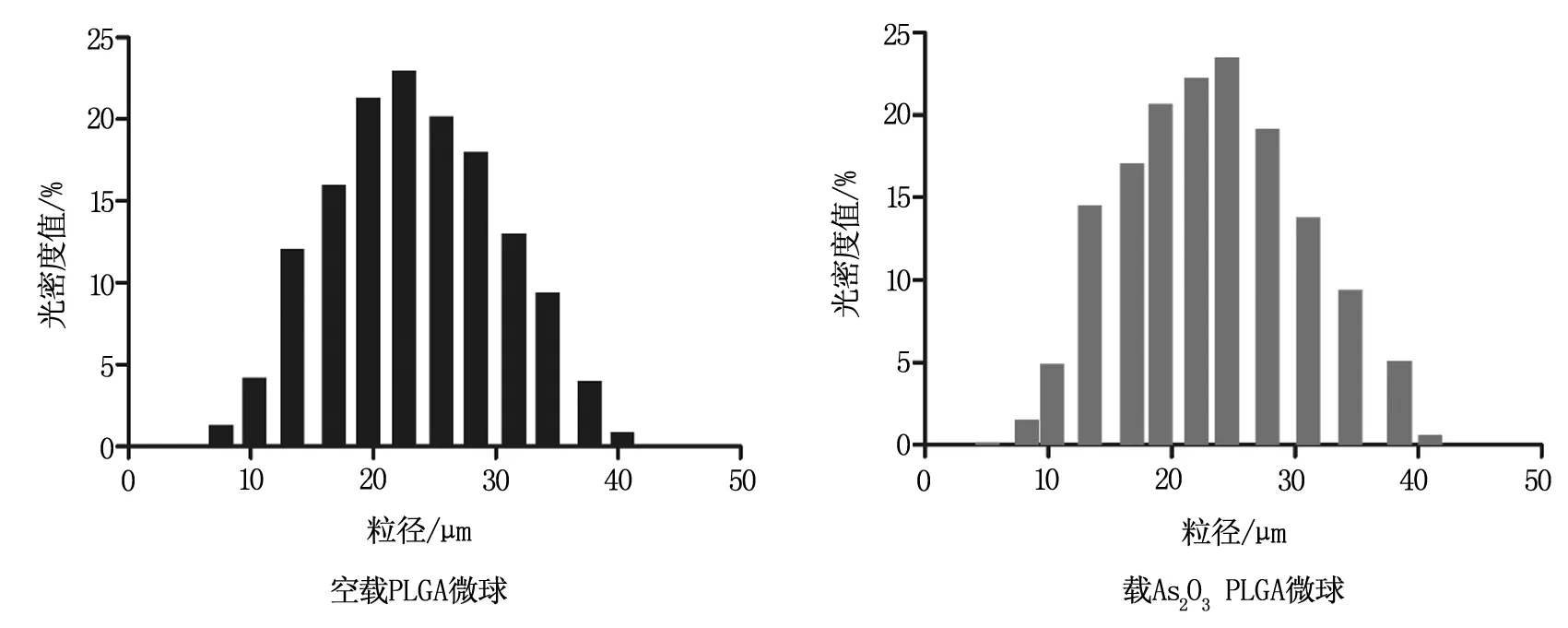
图1 PLGA微球粒径测定
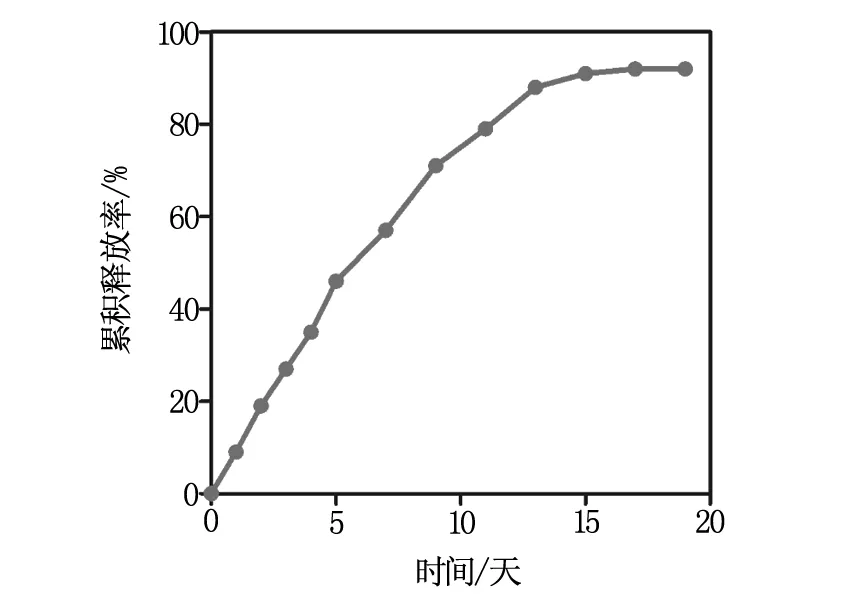
图2 载As2O3 PLGA微球体外释放曲线
进一步模拟体内环境的As2O3药物缓释,在37 ℃条件下,200 rpm震荡培养,每天定时取样,连续19天不间断,采用ICP-MS检测As的含量,换算成As2O3的含量,从而可以算出As2O3每天的累计释放量,并绘制释放曲线。随着时间进行As2O3缓慢均匀的从PLGA中释放出来,逐渐增多。由图可以看出一开始释放速率较快,随后逐渐减缓直至释放完全。载As2O3PLGA微球体外释放在15天趋近于释放完全。相比于游离的药物,微球载药的控制释放极大地提高了As2O3的利用率,也减少了它的毒副作用。
对新西兰兔进行肝癌动物模型造模,首先是培养VX2细胞,之后接种新西兰兔成瘤,最后去肿瘤植入肝脏,肝癌模型造模。目前为止造模成功,下一步的研究将载As2O3PLGA微球用于肝癌的治疗中。
致力于开发新型的给药方式、新剂型一直是许多研究者关于如何利用As2O3的不懈追求,最大限度提高 As2O3的药物利用率,减少它的副作用,是我们研究者的最终目标[14-15]。我们提供的载As2O3PLGA微球在体外环境下显示了良好的药物缓释性能,为接下来的载As2O3的PLGA体内给药实验提供重要的支撑。

