多肉植物黄丽组培快繁体系的建立
李 博,高明波
(大连民族大学生命科学学院,辽宁大连 116600)
黄丽(Sedum‘Golden Glow’)是景天科景天属多年生多肉植物,茎短,叶呈肉质,排列很紧密,呈莲座状,叶片呈匙形。黄丽除了可做盆栽观赏,还可以治疗肝病、尿酸、痛风以及高血压。本试验选择黄丽叶片为外植体,通过组织培养技术建立其快繁体系。已有研究表明,在多肉植物玉扇的组培快繁中,不同外植体的诱导效应存在差异,取材是否得当影响组培成功率[1]。刘芳等研究表明,组合为3mg/L 6-BA、0.1mg/L NAA 和1mg/L KT 的培养基配方能使劳尔叶片愈伤组织诱导率高达95.7%,6-BA 和NAA 对愈伤组织分化芽的效果显著,3mg/L 6-BA 和0.3mg/L NAA 组合,新芽分化率80%[2]。所以本试验采用了多肉植物黄丽的不同器官切片作为外植体进行诱导,从而找到最适合组培的切片,并且通过不同浓度的6-BA、NAA 和KT 对外植体进行诱导,从而确立多肉植物黄丽愈伤组织诱导、茎叶分化及生根阶段的最佳培养基。
1 材料与方法
1.1 试验材料及预处理
供试多肉植物黄丽为网上购买。试验试剂:250 gMS 培养基(不含琼脂和蔗糖),青岛高科园海博生物技术有限公司;500 g 蔗糖,天津市科密欧化学试剂有限公司;100g 琼脂粉,北京奥博星生物技术有限责任公司;1g 6-苄胺基嘌呤(以下称6-BA),国药集团化学试剂有限公司;25gα-萘乙酸(以下称NAA),常州市光明生物化学研究所;6-糖氨基嘌呤(以下称KT),北京奥博星生物技术有限责任公司。试验器材:HVA-85高压灭菌锅,HIRAYAMA MANUFACTURING CORPORATION;ABS 80-4 分析天平,KERN &Sohn GmbH;SW-CJ-2FD 洁净工作台,苏净集团苏州安泰空气技术有限公司。
将黄丽放入干净的烧杯中,用自来水冲洗干净后加入适量洗衣粉,用软毛刷轻轻刷洗15min,之后倒去洗涤剂,在自来水下冲洗30min 以上。打开紫外线灭菌灯照射消毒超净工作台30min,在清洁好超净工作台后将黄丽移到超净工作台上,先用75%乙醇浸泡30 s,用无菌水冲洗4~5 次,再用0.1%HgCl2(氯化汞)消毒5min,用无菌水冲洗4~5 次。剥取黄丽叶片和茎段,挑选状态较好的黄丽组织在无菌环境下切成1cm2左右的小块,用无菌滤纸吸干多余水分后以备用[3]。
1.2 试验方法
1.2.1 外植体的选择。外植体选择时所用基本培养基为:MS+1.0mg/L 6-BA+0.1mg/L NAA+3%蔗糖+0.7%琼脂,pH 值调至6.0。分别取黄丽的叶片、茎段2 种不同组织为材料,每种接种5 瓶,每瓶接种3 块。进行恒温光照培养,培养温度为(25±2)℃,光照强度为2000Lx,每日光照12~16h[4]。在5、10、15d 时分别观察愈伤组织的诱导情况,并测定愈伤组织的大小。
1.2.2 诱导愈伤组织培养基的选择。诱导愈伤组织的基本培养基为:MS+0.1mg/L NAA+3%蔗糖+0.7%琼脂,分别添加0、0.5、1.0、1.5、2.0mg/L 的KT、6-BA[5]。以黄丽的叶片或茎段部分组织为外植体进行接种,每种接种5 瓶,每瓶接种3 块。进行恒温光照培养,培养温度为25±2℃,光照强度为2000Lx,每日光照12~16h。在5、10、15 d 时观察外植体的生长情况,并测定愈伤组织的大小。
1.2.3 诱导分化生茎培养基的选择。诱导分化生茎的基本培养基为:MS+0.1mg/L NAA+3%蔗糖+0.7%琼脂,分别添加0、0.5、1.0、1.5、2.0、2.5mg/L 的6-BA[5]。进行恒温光照培养,培养温度为(25±2)℃,光照强度为2000Lx,每日光照12~16h。在5、15、30 d 时观察愈伤组织的变化情况以及诱导茎叶生长情况,并测定茎叶的大小。
1.2.4 生根培养基的选择。生根的基本培养基为:MS+3%蔗糖+0.7%琼脂,分别添加0、0.1、0.2、0.3、0.4、0.5mg/L 的NAA[5]。对上一阶段诱导出的已分化的茎叶植株进行生根培养。进行恒温光照培养,培养温度为(25±2)℃,光照强度为2000Lx,每日光照12~16h。在5、15、30 d 时观察愈伤组织的变化情况以及根的生长情况并测定根的大小。
1.3 测定方法
在无菌的条件下,使用直尺测量愈伤组织,茎叶以及根的大小。
1.4 数据分析方法
使用Excel 等软件对实验数据进行处理与分析。数据用平均值表示。结果用三线表整理。
2 结果与分析
2.1 不同器官切片对愈伤组织的诱导效应
本试验利用多肉植物黄丽的器官叶片、茎段的横纵切片分别作为试验材料,选择最适合做组培快繁的材料。横切为沿着较短长度方向切割,纵切为沿着较长长度方向切割。
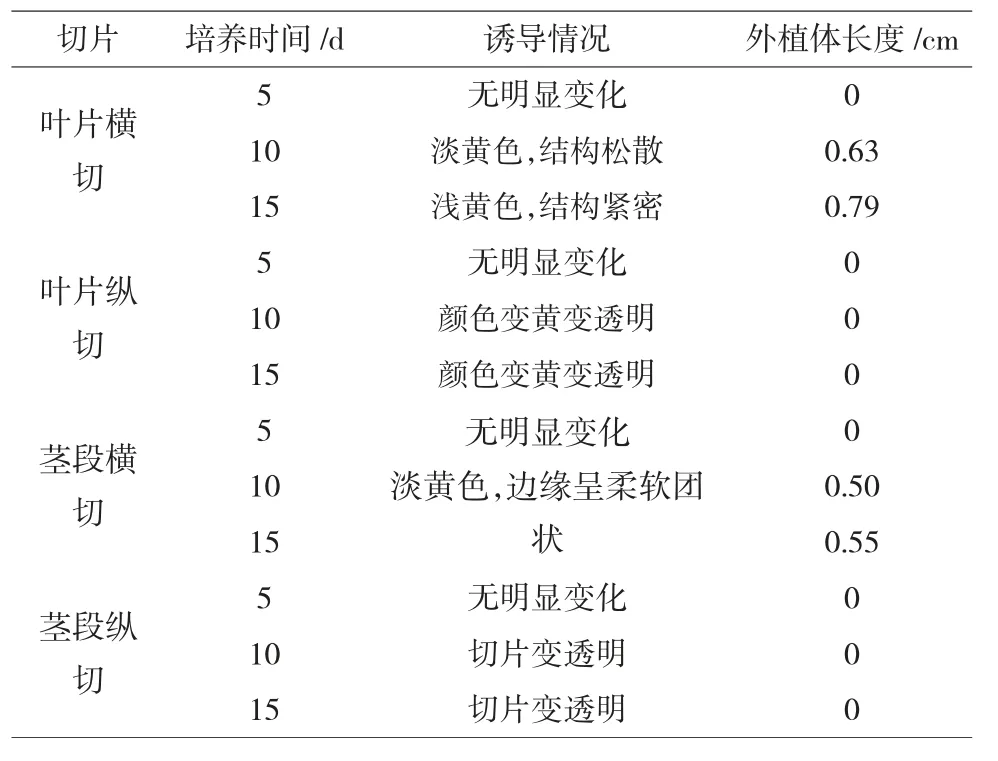
表1 不同器官切片对愈伤组织的诱导效应
由试验结果可知,黄丽的茎段横纵切片均不可作为外植体进行组培,叶片的纵切片也不合适,叶片的横切片胀大呈淡黄色,结构较为紧密,还可以观察到外植体的大致形状,且外植体的长度明显长于其他组织,即诱导愈伤组织的效应明显优于其它部分。
2.2 不同激素浓度对黄丽组培各阶段的影响
2.2.1 不同浓度KT、6-BA 对外植体的影响。由试验结果可知,经过不同浓度激素的愈伤组织诱导培养基诱导培养后,不同浓度的激素对外植体的诱导率相同,都为100%,即不同浓度的KT、6-BA 均能诱导黄丽外植体形成愈伤组织,但诱导效果有很大差别,外植体长度明显高于对照组。诱导培养5d 后外植体无明显变化,诱导培养10d 后愈伤组织呈颗粒状聚集,表明愈伤组织一般在诱导培养后10d 左右产生,愈伤组织数量随培养天数的增加而逐渐增加。比较了不同浓度KT、6-BA 的诱导效果,6-BA 最佳浓度的诱导效果比KT最佳浓度的诱导效果好。愈伤组织诱导效果最好为6-BA 浓度为1mg/L 时,诱导培养15d 后,外植体长度可达1.05cm,明显高于其他浓度的6-BA
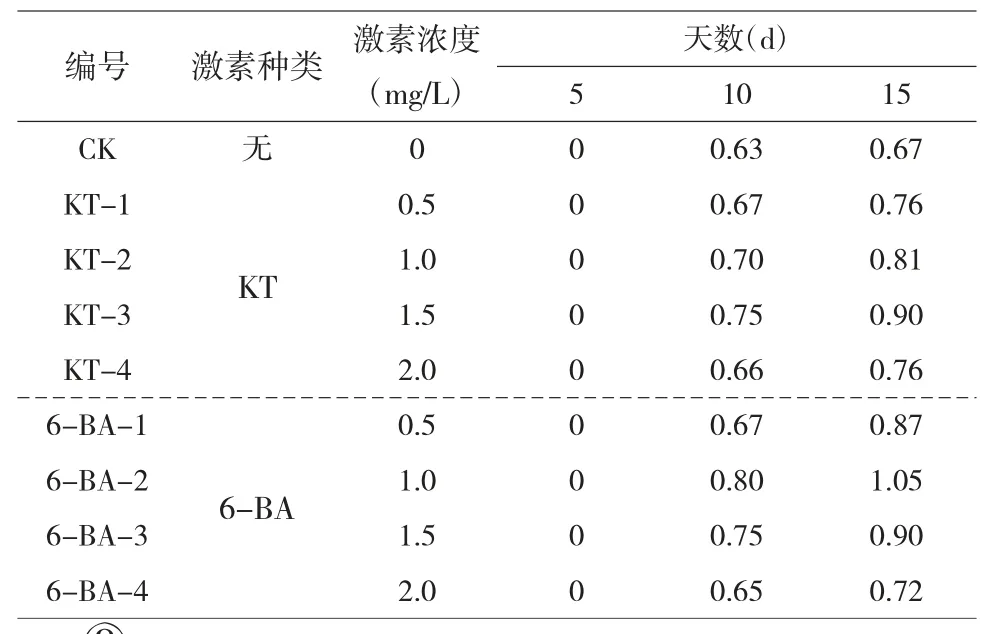
表2 不同浓度KT、6-BA 影响下外植体的长度 单位:cm
2.2.2 不同浓度6-BA 对叶片组织的影响。由试验结果可得,随着时间增长不同浓度6-BA 条件下的叶片组织均有增长,其中5d 时诱导效果都不明显,15d 时除了6-BA 浓度为0.5mg/L 的一组,其他组都有变化,到30 d 时诱导效果与对照组相比均有显著变化,但增长程度不同,随着6-BA 的浓度增大,诱导效果逐渐明显,当6-BA 浓度为2mg/L 时,叶组织的诱导效果最好,产生丛生芽。
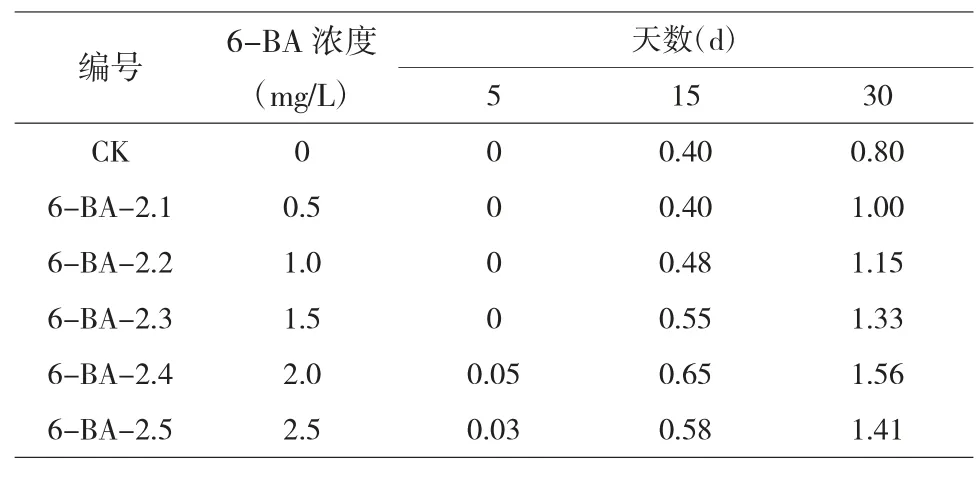
表3 不同浓度6-BA 影响下叶片组织的高度 单位:cm
2.2.3 不同浓度NAA 对根组织的影响。由试验结果可得,经不同浓度NAA 诱导黄丽叶片组织分化生根,除0.5mg/L 浓度的NAA 环境下,其余随着时间增加不同浓度NAA 条件下的根系均有增长,其中5d 时诱导效果都不明显,15d 时除了NAA 浓度为0.5 mg/L 的一组,其他组都有变化,到30d 时诱导生根效果有显著变化,但增长程度不同,随着6-BA 的浓度增大,诱导效果逐渐减弱,当浓度达到0.5mg/LNAA 时不再诱导生根,当NAA 浓度为0.1mg/L 时,诱导生根效果最佳,根系长度明显高于对照组及其它浓度试验组。
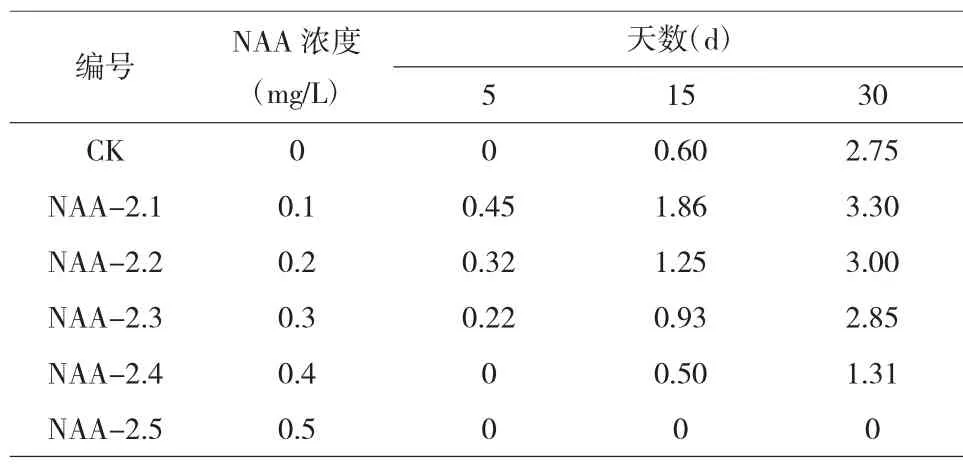
表4 不同浓度NAA 影响下根组织的长度 单位:cm
3 讨论
该试验首先以黄丽的叶片和茎部的横纵切片为外植体,筛选适合作为外植体的组织,通过试验得到了叶片横切片是最合适作为外植体的结论,其他切片均不合适,不适宜产生愈伤组织。以叶片横切片为外植体,通过3 组试验确定了黄丽愈伤组织诱导的最佳培养基配方为:MS+0.1mg/L NAA+3%蔗糖+0.7%琼脂+1mg/L 6-BA;诱导分化生茎的最佳培养基为MS+0.1mg/L NAA+3%蔗糖+0.7%琼脂+2mg/L 6-B 诱导生根的最佳培养基为MS+3%蔗糖+0.7%琼脂+0.1mg/L NAA。采用该试验愈伤组织诱导培养基配方,大约10d 就有愈伤组织产生,1d 能够得到较为明显的愈伤组织,再采用诱导生茎培养基配方,培养15d 可获得丛生芽,之后采用该试验的生根培养基,诱导培养5d 即可有根系产生,再培养10d 就可形成完整植株,所以采用本试验的最佳培养基配方进行黄丽组织培养,不到2 个月即可获得完整植株。综上所述,该研究得到了黄丽组织培养的最佳外植体及各培养阶段的最佳培养基配方,建立了多肉植物黄丽的组培快繁技术体系,研究结果能有效提高愈伤组织诱导成功率、缩短种苗生产周期,为黄丽的工厂化育苗提供了试验依据,具有良好的应用前景。

