关节软骨与软骨下骨改变在不同骨关节炎动物模型中的特点
谭启钊,牛国栋,赵振达,李思维,宋纯理,冷慧杰*
(1. 北京大学第三医院骨科,北京 100191; 2. 北京脊柱疾病重点实验室,北京 100191)
骨关节炎(osteoarthritis, OA)是一种全球性的疾病,60岁以上的妇女的发病率为50%以上,已经日益成为危害人类健康和加重社会负担的重要因素[1]。骨关节炎最主要的特征表现为关节软骨的破坏缺损。然而,软骨在关节中并不是孤立的组织,与其相连的组织均对其退变发挥着作用,尤其是软骨下方直接相连的骨骼(软骨下骨),更是引起了学者们的注意,甚至有学者将软骨和软骨下骨作为一个整体来看待[2]。近年来越来越多的研究表明软骨下骨代谢改变在OA进程中发挥重要作用,甚至有研究认为软骨下骨是OA治疗的靶点[3-5]。创伤型OA模型,如前交叉韧带切除术(anterior cruciate ligament transection, ACLT),因为其成模快,模型较成熟,目前很多关于软骨下骨与OA关系的研究都是基于该模型展开[4]。OA的发病原因多样,除了运动创伤病因外,还有退行性、激素改变等因素。软骨下骨的改变在不同病因导致的OA中表现和所发挥的作用还并不明确。文献中常用的OA动物模型包括ACLT[6]、关节腔注射木瓜蛋白酶(Papain)[7]、双侧卵巢切除术(ovariectomy, OVX)[8]等,它们代表了不同病因的OA。不同模型的OA软骨退变进程不一样,同时,软骨下骨代谢也有所不同。目前已经有研究比较了创伤性OA模型和软骨降解酶注射OA模型软骨下骨的变化特征[9]。OVX-OA模型中软骨下骨可能表现与其他模型不同,所发挥的作用可能也不相同。本研究假设不同类型OA中软骨和软骨下骨的病理改变机制不同,对不同病因的三种OA模型软骨与软骨下骨同时观察,并进行模型之间的横向比较,希望有助于人们更深刻的认识软骨下骨对软骨代谢的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组
6月龄SPF级雌性SD大鼠,24只,体重(250±15)g,来源于北京大学医学部实验动物科学部【SCXK(京)2016-0010】,进行编号,根据编号随机抽取,分为4组:假手术对照组(Sham,n=6),前交叉韧带切除手术组(ACLT,n=6),木瓜蛋白酶关节腔注射组(Papain,n=6),以及卵巢切除术组(OVX,n=6)。大鼠在北京大学医学部实验动物部【SYXK(京)2016-0041】进行适应性饲养一周。饲养环境温度为(20±2)℃,相对湿度为40%~50%,12 h光照/12 h黑暗,自由活动。
1.1.2 主要试剂和实验仪器
甲苯胺蓝试剂(Amresco,美国);木瓜蛋白酶试剂(美仑生物,中国);EDTA脱钙液(博士德,中国);4%多聚甲醛(Biosharp,中国);戊巴比妥钠(北京岚泰化工科技公司,中国);抗生素(北京大学第三医院药房,中国);micro-CT(Siemens,美国);梯度自动脱水机(Leica,德国);全景数字病理切片扫描分析装置(滨松,日本)。
1.2 方法
1.2.1 动物模型的制备
(1)ACLT诱导的骨关节炎模型
6只SD大鼠于造模前12 h禁食,用2%的戊巴比妥钠进行腹腔麻醉,用量为30 mg/kg,待其麻醉后进行术前剃毛,常规消毒,铺巾,在膝前正中切口切开,皮肤皮下组织,找到白色髌腱,沿其内侧切开关节束,同时使其膝关节过伸后屈曲膝关节找到前交叉韧带,用眼科剪切断,恢复其正常伸直位,之后进行髌骨复位,逐层缝合关节囊,皮下组织和皮肤,在缝合前再一次消毒,并在术后进行抽屉实验验证确实切断了前交叉韧带。在术后每天注射抗生素连续注射3 d,预防术后感染。
(2)木瓜蛋白酶注射模型
6只SD大鼠在造模前12 h禁食,手术时用2%的戊巴比妥钠进行腹腔麻醉,用量30 mg/kg,等待其麻醉后取仰卧位,在其膝关节髌骨下缘前内侧注射100 μL 2%的木瓜蛋白酶,在4,7 d分别再注射一次。
(3)卵巢切除动物模型
6只雌性SD大鼠在手术前12 h禁食,手术用2%戊比妥钠腹腔麻醉,待其麻醉后,剔除其腰椎旁到股骨处毛发,取俯卧位,酒精消毒,脊柱旁1.5 cm处小切口切开背部皮肤,分离皮下脂肪,找到卵巢和子宫拉出后,紧贴卵巢下部结扎卵巢动脉,手术剪紧贴结扎线减掉卵巢,纱布适当止血后,用生理盐水冲洗伤口后,逐层缝合肌层和皮肤。术后每天注射抗生素连续注射3 d,预防术后感染。
1.2.2 标本收取
在术后8周用10%过量麻醉法分别处死各组大鼠,取其膝关节,仔细剔除肌肉等周围软组织后,放入4%的多聚甲醛溶液中固定24 h。
1.2.3 Micro-CT扫描重建
对膝关节标本进行扫描,扫描电压与电流分别设置为80 kV,500 μA,扫描后进行重建,重建好的图像分辨率为13 μm。将胫骨平台钙化软骨以下、骺线以上区域作为感兴趣区域,对骨体积百分比、骨小梁数量、骨小梁厚度、骨小梁分离度、软骨下骨板厚度参数进行分析。
1.2.4 软骨组织染色与OA评分
扫描重建完成后的标本放入0.5 mol/L的EDTA溶液中脱钙5周,每3 d换液一次,脱钙后用手术刀沿冠状位切取标本,大小为1 cm × 0.5 cm × 0.5 cm,之后进行流水冲洗10 h,酒精脱水。经自动梯度脱水机进行后续脱水。石蜡包埋,进行连续切片,厚度为5 μm,切片行甲苯胺蓝染色。每个标本随机选择3个切片,每个切片根据软骨结构完整性、细胞排列方式、软骨基质染色、潮线情况等进行Mankin法OA评分[10]。
1.3 统计学方法
采用SPSS 18对4组间进行单因素方差分析,计量资料以平均值±标准差表示,检验值为P,认为P<0.05有统计学意义。
2 结果
2.1 关节软骨组织切片观察和Mankin评分结果
如图1所示,8周后对照组软骨结构比较完整,细胞排列整齐,未见明显软骨缺损(图1A)。ACLT组软骨边缘出现结构破碎,表层出现毛糙,染色变浅。深层出现水平和垂直裂隙,染色缺失(图1B)。木瓜蛋白酶组软骨整体结构破坏严重,软骨层变薄,有些部位近乎消失,软骨细胞出现大范围缺失。软骨部位出现肉芽组织,并且与骨髓腔相通(图1C)。OVX组软骨大体结构完整,软骨表面出现少量多糖流失及少量毛糙,透明软骨表层稍有不平(图1D)。
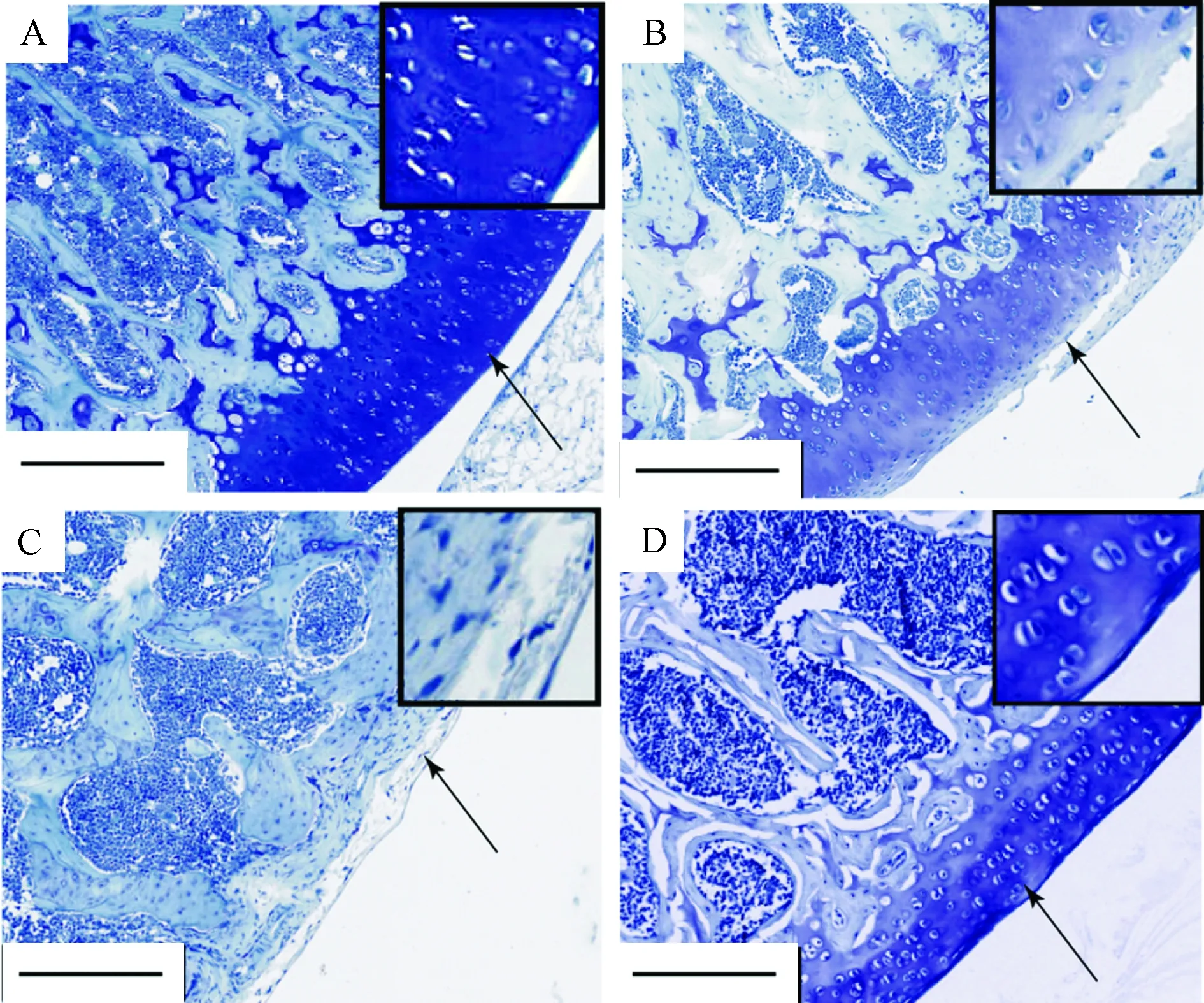
注:A. 假手术对照组;B. ACLT手术组;C.木瓜蛋白酶组;D. 卵巢切除组(bar=250 μm)。图1 软骨甲苯胺蓝染色(箭头指示了软骨表面区域)Note. A.Sham, B. ACLT, C. Papain, D. OVX(bar=250 μm).Figure 1 Histological changes of articular cartilage in the rats(Toluidine blue staining)
根据Mankin法对手术后8周的各组软骨切片进行评分,各组的各分项评分如图表1所列,总分如图2所示。对于不同的OA模型,术后8周时,木瓜蛋白酶注射组Mankin评分最高,软骨破坏最为严重,OVX组Mankin评分最低。各实验组除OVX组外,与Sham组相比较,均有显著性差异。
2.2 不同OA模型胫骨平台软骨下骨骨小梁参数
OVX组与正常对照组相比BV/TV减低,较ACLT组也减低,且均有统计学差异。OVX组与对照组和ACLT手术组相比骨小梁分离度增大,两者均有显著性差异。骨小梁厚度ACLT手术组较对照组稍高,OVX组稍低,木瓜蛋白酶注射组与对照组基本相等,三组与对照组相比差异无显著性。OVX组骨小梁数量与其他三组相比降低,且差异有显著性。ACLT组骨小梁容积百分比、骨小梁数量显著高于Papain组,骨小梁分离度显著小于Papain组。三个实验组与对照组相比软骨下骨板厚度都减少,差异有显著性。(图3,图4)
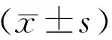
表1 各组Mankin方法OA评分Table 1 OA scores of all groups by Mankin’s histological grading

注:*P < 0.05。(下图同)图2 各组关节Mankin OA评分Note.*P < 0.05. (The same in the following figures)Figure 2 Mankin OA scores of articular cartilages in all groups
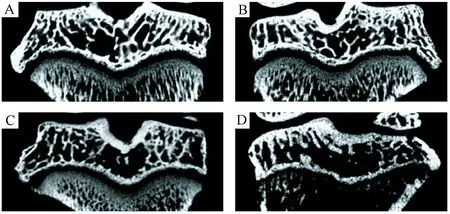
注:A. 假手术对照组;B. ACLT手术组;C.木瓜蛋白酶组;D. 卵巢切除组。图3 胫骨平台软骨下骨Micro-CT图像Note. A.Sham, B. ACLT, C. Papain, D. OVX.Figure 3 Micro-CT images of subchondral bonesof different rat groups
3 讨论
本研究关注软骨下骨在OA进展中的作用这一热点问题,通过选取不同大鼠OA模型来探讨不同病理因素导致OA情况下,软骨以及软骨下骨在OA进展中的变化特点。研究显示,代表不同病理的OA模型在造模8周时,软骨缺损和软骨下骨微结构变化程度不同,提示软骨下骨可能发挥不同作用。
软骨是OA中最被人们所关注的部位。我们的研究发现,同样造模8周,软骨缺损程度OVX组最弱,仅出现了类似蛋白聚糖流失的表面退变;ACLT组软骨缺损相对比较严重,某些部位已经出现了表层以及深层的缺损与破坏;Papain组最为严重,软骨已经近乎完全破坏,肉芽组织增生。这三种OA模型的软骨缺损结果与文献中观察基本一致[8-12]。有一点值得注意,OVX组的OA评分虽然均值高于Sham组,但没有统计性差异。这是因为OVX-OA表征OA的最初期变化,其软骨缺损主要表现为软骨表层蛋白多糖的流失,尚未造成结构的显著改变,对经典的OA评分系统不敏感。Hoegh-Andersen等[8]认为宜采用表面缺损评分系统来评价此类初期OA。

图4 胫骨平台软骨下骨骨小梁结构分析结果Figure 4 Trabecular analysis of subchondral bone by Micro-CT imaging
软骨下骨在OA进程中发挥的作用越来越受到人们重视,不过目前还没有研究对不同病理OA情况下软骨下骨的作用进行比较。研究结果显示,OVX组相对于Sham对照组,软骨下骨微结构显著疏松,而ACLT组与Papain组相对于Sham对照组,软骨下骨微结构没有显著差异,但相对于OVX组,有统计性差异。在我们研究的三种OA模型中,ACLT组通过手术手段令软骨所处的力学环境失稳,从而造成软骨磨损加剧,快速缺损。Papain组通过关节腔直接注射木瓜蛋白酶,通过化学刺激,直接令软骨降解,极速缺损。ACLT和Papain这两种模型直接针对软骨组织,因此软骨缺损快。两者相比较,ACLT是力学作用,相对较慢;Papain是化学作用,相对更快。这两种模型中软骨下骨处于相对被动地位,在第8周时,并未发生显著变化,因此可能没有对软骨的退变起到关键作用。而OVX-OA模型的主要手段是降低雌激素水平,而雌激素缺乏直接导致骨量流失和骨质疏松[13],因此研究发现软骨下骨微观结构的改变显著高于其他两个模型,而软骨缺损轻微。OVX-OA中,软骨下骨的改变可能对软骨造成力学与生物学环境的改变,从而对软骨的缺损起到更重要的作用。在大多数OA人群中,Papain和ACLT类似的OA只占少数,因此在临床实践中,软骨下骨对OA中的作用不容忽视。
有趣的是,软骨下骨骨板厚度这一指标在不同OA动物模型中均相对于Sham组显著减少。这个结果与Femke 等的研究结果相似,他发现在ACLT和软骨破坏OA模型早期软骨下骨板厚度即可出现减少。有研究已经发现软骨下骨板厚度改变和软骨破坏有关系,软骨下骨骨板在OA中变薄可能是面对软骨持续缺损的调节改变[14-16]。我们研究发现OVX-OA软骨下骨板同样变薄。因为OVX-OA软骨缺损并不显著,因此骨板变薄的机理可能与其他两个模型不一样,具体机制还有待进一步探讨。我们的研究发现软骨下骨板在不同模型中变化趋势一致,而骨小梁结构变化趋势不一致,可能也说明软骨下骨板在OA进程中可能会起一个更重要的作用。
综合文献中的研究和本研究的结果看,不同的OA造模方法可以造成软骨损伤与软骨下骨结构变化的差异,这可能是由于不同的OA模型代表了不同的OA发病机制。其中,关节腔注射胶原蛋白降解酶类的OA模型造模速度快,但与临床常见OA情况有所差异;ACLT与OVX模型在临床上有对应的患者人群,尤其是OVX-OA对应的绝经后妇女的OA的患者人群相对较大。我们在实验研究中要根据研究目的选择合适的OA模型;在临床OA诊断治疗中,要具体问题具体分析,找准靶点,在合理的时间点进行合理的治疗干预。

