草莓丝核菌根腐病病原菌鉴定及7种杀菌剂的抑菌作用测定
尹沙亮 钟珊 刘奇志 张国珍
摘要 为了解草莓丝核菌根腐病的病原种类及筛选防治丝核菌根腐病的有效杀菌剂,本研究基于形态学特征、细胞核荧光染色、菌丝融合群测定以及rDNA-ITS的序列分析,对北京和河北承德地区的草莓丝核菌根腐病的病原菌进行了鉴定,并利用菌丝生长速率法测定了7 种杀菌剂对丝核菌的抑菌作用。结果发现,北京地区的丝核菌为双核丝核菌(binucleate Rhizoctonia,BNR),属于融合群AG-A;河北的丝核菌为立枯丝核菌Rhizoctonia solani,属于融合群AG-4。氟啶胺、吡唑醚菌酯、噻呋酰胺、戊唑醇、咯菌腈、氟硅唑对2种丝核菌均有很强的抑制作用,EC50值为0.063 9~2.485 7 μg/mL,抑霉唑的抑制作用较差,EC50值为9.966 8~11.236 8 μg/mL。同一种杀菌剂对不同丝核菌的抑制作用存在差异,噻呋酰胺、戊唑醇、氟硅唑、咯菌腈和抑霉唑对立枯丝核菌的抑制作用强于对双核丝核菌。试验结果为生产上合理选用杀菌剂防治草莓丝核菌根腐病提供了科学依据。
关键词 草莓根腐病; 双核丝核菌; 立枯丝核菌; 杀菌剂筛选
中图分类号: S 436.639
文献标识码: A
DOI: 10.16688/j.zwbh.2018351
草莓Fragaria × ananassa Duch.属蔷薇科草莓属多年生常绿草本果树,因果实色泽鲜艳、芳香多汁、酸甜适口,含有丰富的维生素C,被誉为“水果皇后”[1]。2015年我国草莓总种植面积已达到12.93万hm2,总产量347.9万t[2]。随着国内草莓种植面积的扩大和栽培模式的转变,土传根部病害加重。已报道的草莓根腐病的病原菌达20多种,主要有镰孢属Fusarium[3]、炭疽菌属Colletotrichum[45]、丝核菌属Rhizoctonia[67]、柱孢菌属Cylindrocarpon[8]、拟盘多毛孢属Pestalotiopsis[910]等真菌。其中,由丝核菌引起的草莓根腐病是影响草莓生产的重要病害之一,严重威胁世界草莓的生产,在美国、澳大利亚、意大利等多个国家均有报道[7, 1112]。国内对草莓丝核菌根腐病的研究比较有限,前期报道的病原菌一般为立枯丝核菌R.solani[1314]。2016年,钟珊等[15]首次报道了由双核丝核菌binucleate Rhizoctonia引起的草莓根腐病在中国的发生。
针对其他作物上的立枯丝核菌,国内已有一些杀菌剂的毒力测定[1617]。而专门针对引起草莓根腐病的丝核菌进行杀菌剂的毒力测定鲜有报道[18]。目前国内引起草莓根腐病的丝核菌种类有哪些,不同丝核菌对杀菌剂的敏感性是否存在差异并不清楚。针对此问题,我们对北京和河北省承德地区的草莓丝核菌根腐病病样进行了分离和鉴定,并测定了氟硅唑、抑霉唑、吡唑醚菌酯、噻呋酰胺、戊唑醇、咯菌腈和氟啶胺7种杀菌剂对代表性菌株的抑菌作用,旨在为草莓丝核菌根腐病的有效防治提供科学依据和指导。
1 材料与方法
1.1 试验材料
1.1.1 草莓病样
2014年-2016年采自北京市昌平区和河北省承德地区。
1.1.2 杀菌剂原药
95%氟硅唑(flusilazole)、96%抑霉唑(imazalil)、97%吡唑醚菌酯(pyraclostrobin)和96%噻呋酰胺(thifluzamide)由北京中植科华农业技术有限公司提供;95%戊唑醇(tebuconazole)、95.2%咯菌腈(fludioxonil)和98.44%氟啶胺(fluazinam)由中国农业大学种子病理学实验室刘西莉教授提供。
1.1.3 丝核菌菌丝融合群标准菌株
双核丝核菌标准菌株由山东农业大学于金凤教授提供,立枯丝核菌标准菌株由中国农业大学陈旭君副教授提供。
1.2 试验方法
1.2.1 病原菌的分离与纯化
采用常规组织分离法进行分离:用流动的清水清洗草莓病株的根茎和小根。取剖开后有褐色病斑的根茎,在病健交界处切取5 mm×5 mm的组织块;取有黑褐色病斑的小根,于病健交界处切取5 mm长的小段。用3.3% NaClO溶液消毒1 min,灭菌水漂洗3次,再用灭菌吸水纸吸干表面水分,置于PDA平板上,28℃黑暗培养。3 d后挑取从病组织块长出的菌丝转皿培养,从菌落边缘切取单根菌丝尖进行菌株纯化。对纯化菌株进行编号保存备用。
1.2.2 形态学观察
将分离菌株在28℃培养3 d,于菌落边缘打取直径5 mm的菌饼,置于PDA平板(直径9 cm)培养基上,28℃黑暗培养,观察并记录菌落颜色,有无菌核产生等培养性状,十字交叉法逐日测量菌落直径。
1.2.3 菌丝细胞核数目观察
采用插片法培養菌株。菌株接种于PDA平板中央,灭菌盖玻片斜插在接菌点周围,菌丝长满盖玻片后取出。参照Xu和Hamer的方法[20]经过优化,用荧光染色剂Calcofluor(10 μg/mL)和 Hoechst 33258(1 μg/mL)对菌丝进行染色,荧光显微镜下观察菌丝细胞中的细胞核数目。
1.2.4 菌丝融合群测定
采用载玻片对峙法[2122]:待测菌株和标准菌株分别在28℃,黑暗条件下培养2 d,在菌落边缘各取菌饼(直径5 mm),同时置于涂有2% WA培养基的载玻片上,两个菌饼间隔约2 cm。将接菌的载玻片放置在28℃黑暗条件下保湿培养。待两菌落前沿相遇并交叠约2~5 mm后,取出载玻片于光学显微镜下观察。
1.2.5 分子生物学鉴定及系统发育树构建
采用CTAB法提取纯化菌株的基因组DNA。用通用引物ITS1 (5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)对分离菌株DNA进行PCR扩增。扩增产物经1%琼脂糖凝胶电泳检测后送至北京擎科新业生物技术责任有限公司测序,测序结果在GenBank中进行BLAST比对分析。在NCBI网站下载标准菌株的rDNA-ITS序列(表1),用BioEdit对供试菌株和标准菌株的序列进行比对分析,适当人工校正剪切后,用MEGA 6.0 以最大简约法(Maximum Parsimony,MP)构建系统发育树,Bootstrap=1 000。
1.2.6 杀菌剂的抑菌作用测定
先用二甲基亚砜(DMSO)将供试杀菌剂原药配成母液(104 μg/mL),之后用DMSO稀释,制成系列浓度梯度药液。将杀菌剂加入PDA培养基中,充分摇匀,制成含药平板(9 cm),以加入等量DMSO的PDA培养基为对照。用灭菌的打孔器在菌落边缘打取菌饼(5 mm),每一含药平板中央接种一个菌饼,28℃黑暗培养。每个药剂浓度重复3次。当对照菌落长至直径约7 cm时,用十字交叉法测量含药平板上的菌落直径,按下列公式计算菌丝生长抑制率。
菌丝生长抑制率=对照菌落直径-处理菌落直径对照菌落直径-菌饼直径×100%。
将菌丝生长抑制率换算成几率值(y),药剂浓度换算成浓度对数(x),得出各杀菌剂的毒力回归方程y=kx+b,并计算EC50值及相关系数。
2 结果与分析
2.1 菌株分离情况
从采集的草莓根腐病病样中共分离到25株丝核菌菌株,其中从北京市昌平区的病样分离到14株,从河北省承德地区的病样中分离到11株。分离菌株经柯赫氏法则验证,对草莓均有致病性(结果未列出)。
2.2 菌株的形态特征及细胞核数目
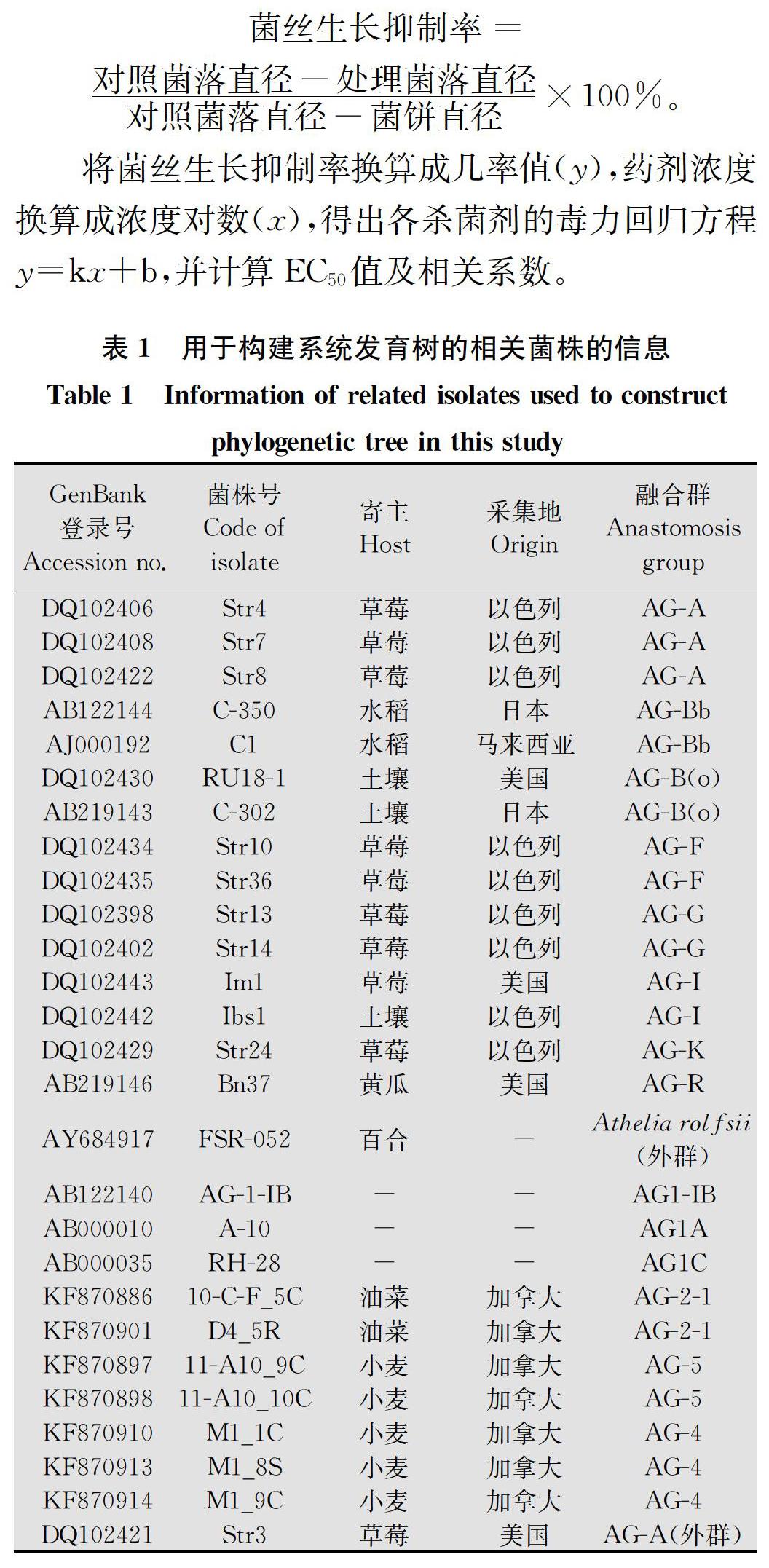
分离菌株在PDA平板上均呈辐射状生长,菌落较疏松。显微镜下观察,发现菌丝呈直角或近直角分枝,分枝处缢缩,近分枝处有隔膜,符合丝核菌属的特征。但不同地区分离菌株在菌落生长速度、菌落颜色及细胞核数目上不同。北京分离菌株生长相对较慢,平均生长速率为28.7 mm/d(图1a);菌丝体初期白色,后呈淡褐色,连续培养20 d仍不产生菌核;经荧光染色发现菌丝细胞内有两个细胞核(图1c)。河北分离菌株生长相对较快,以38.0 mm/d的平均速率生长(图1b);培养2 d后菌丝在PDA平板上开始纠集,随后颜色加深,形成黑褐色菌核;菌丝细胞内有3个以上的细胞核,多为4个(图1d)。根据菌丝的形态特征和细胞核数目,确定北京菌株为双核丝核菌binucleate Rhizoctonia,河北菌株为立枯丝核菌R.solani。
2.3 分离菌株的菌丝融合群
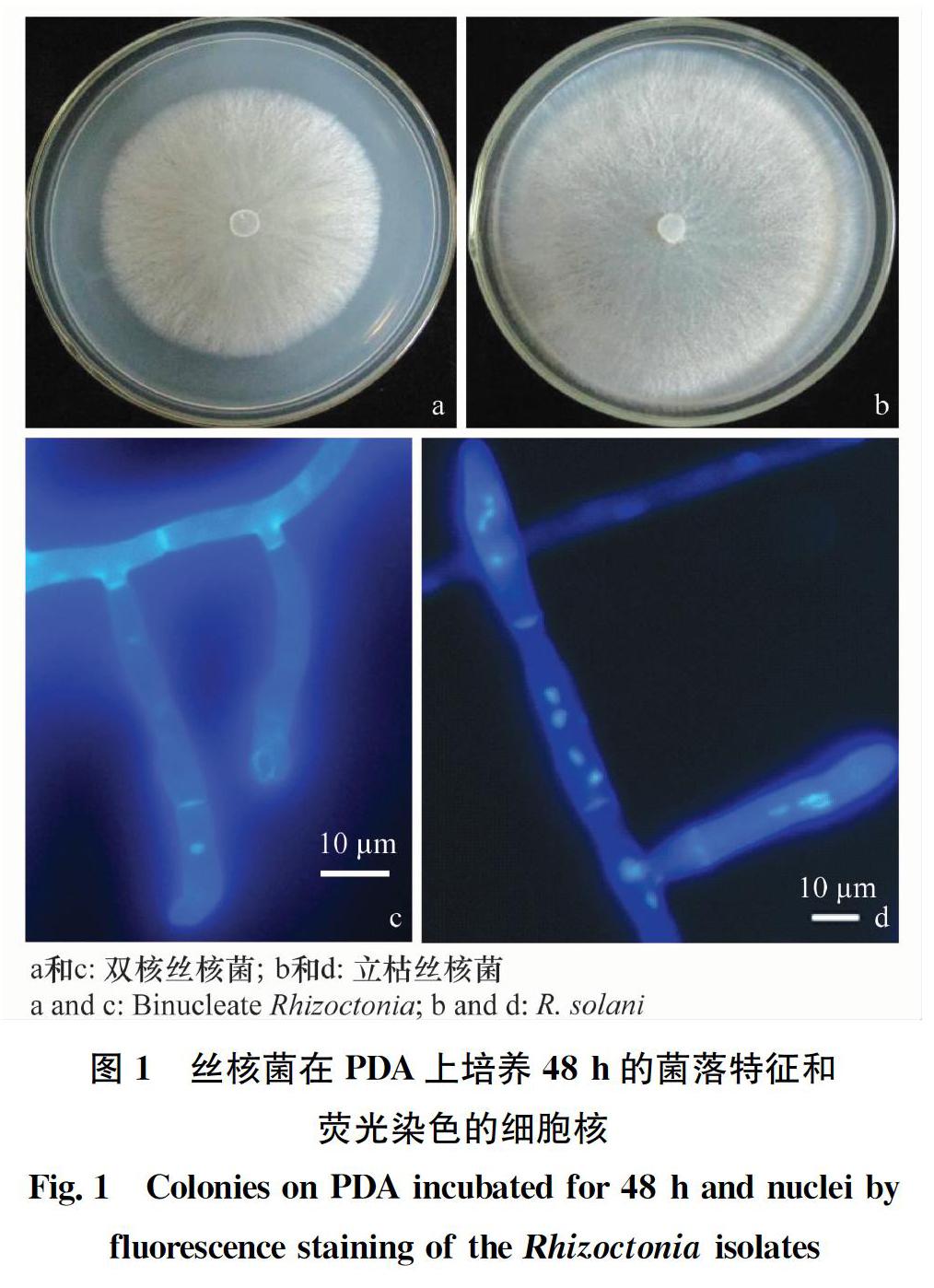
根据待测菌株与标准菌株的对峙培养观察和鉴定标准,分离得到的双核丝核菌菌株均能与菌丝融合群AG-A的标准菌株发生菌丝融合(图2a),而与其他融合群的菌株不发生菌丝融合(图2b);分离得到的立枯丝核菌菌株均能与菌丝融合群AG-4的标准菌株发生菌丝融合(图2c),而与其他融合群的菌株不发生菌丝融合(图2d)。测定结果表明,本研究从草莓根部分离到的双核丝核菌为AG-A融合群,立枯丝核菌为AG-4融合群。
2.4 分离菌株的分子生物学鉴定
用rDNA-ITS通用引物对ITS1/ITS4对双核丝核菌6株代表菌株(MLJ1-2-2、MLJ5-1-2、MLJ6-1-6、MLJ7-1-3、MLJ8-2-2和C1-1-2)和立枯丝核菌4株代表菌株(CD1-1、CD3-1、CD-L4-2和CD-P2-1-1)的基因组DNA进行PCR扩增,得到约600 bp的条带。以Athelia rolfsii(登录号:AY684917)为外群菌株,构建的双核丝核菌系统发育树显示,代表菌株与双核丝核菌AG-A融合群聚在一支,支持率为99%(图3a);以双核丝核菌AG-A(登录号:DQ102421)为外群菌株,构建的多核丝核菌的系统发育树显示,代表菌株与立枯丝核菌AG-4融合群聚在一支,支持率为91%(图3b)。分子生物学鉴定结果进一步印证了菌丝融合群的鉴定結果:测序的6株双核丝核菌和4株立枯丝核菌分别属于AG-A融合群和AG-4融合群。
2.5 两种丝核菌对杀菌剂的敏感性
通过测定7种杀菌剂对双核丝核菌和立枯丝核菌代表菌株菌丝生长的抑制作用,发现其中的6种杀菌剂对两种丝核菌均具有很强的抑制作用,EC50值在0.063 9~2.485 7 μg/mL之间。其中噻呋酰胺对立枯丝核菌的EC50值最低。抑霉唑对两种丝核菌的抑菌作用较差,EC50在9.966 8~11.236 8 μg/mL之间。同一种杀菌剂对不同丝核菌的抑制作用存在差异,噻呋酰胺、戊唑醇、氟硅唑、咯菌腈和抑霉唑对立枯丝核菌的抑制作用强于对双核丝核菌,即立枯丝核菌比双核丝核菌对这5种杀菌剂更为敏感(表2)。氟啶胺和吡唑醚菌酯对两种丝核菌的抑制作用比较一致,即两种丝核菌对这两种杀菌剂的敏感性比较一致。
3 讨论
由丝核菌引起的草莓根腐病是重要的草莓根部病害之一。在国外,已有不少国家和地区对引起草莓根腐病的丝核菌种类及其融合群进行了研究。在美国加州中部沿海地区从草莓上分离的123株菌中,除了1株为多核丝核菌外,其余均为双核丝核菌,包括3个融合群,即AG-A、AG-G和AG-I[23]。在南非的西开普省,59.3%的菌株为双核丝核菌AG-A、AG-G和AG-I,40.7%的菌株为立枯丝核菌的AG-6[24]。西澳大利亚州草莓上分离到的96株丝核菌均为双核丝核菌,具有致病性的菌株属于融合群AG-A、AG-K和AG-I[25]。而我国对引起草莓根腐病的丝核菌研究极为有限。本研究发现北京和河北承德地区引起草莓根腐病的丝核菌分别为双核丝核菌融合群AG-A和立枯丝核菌融合群AG-4。本研究仅对国内两个地区的草莓根腐病的丝核菌进行了鉴定,其他草莓产区是否存在丝核菌的其他种类以及融合群,还有待于进一步检测和研究。
通过测定7种杀菌剂对2种丝核菌抑菌作用,发现除抑霉唑外,其他6种杀菌剂对测试的丝核菌均具有很强的抑制作用,其中氟啶胺、吡唑醚菌酯和噻呋酰胺的抑制作用最强,EC50值在0.063 9至0.426 8 μg/mL。这些杀菌剂可作为生产上防治草莓丝核菌根腐病的候选药剂。同时,也发现同一种杀菌剂对不同丝核菌的抑菌作用存在差异,有5种杀菌剂表现为对立枯丝核菌的抑制作用强于对双核丝核菌的抑制作用,换言之,立枯丝核菌比双核丝核菌对杀菌剂更为敏感。对于这种差异的原因尚不清楚,也有待进一步研究。
参考文献
[1] 雷家军,张运涛,赵密珍. 中国草莓[M]. 沈阳:辽宁科学技术出版社, 2011.
[2] 中华人民共和国农业部. 中国农业统计资料2015[M]. 北京:中国农业出版社, 2015.
[3] STANKOVIC I, RISTIC D, VUCUROVIC A, et al. First report of Fusarium wilt of strawberry caused by Fusarium oxysporum in Serbia [J]. Plant Disease, 2014, 98(10): 1435.
[4] 张国珍. 我国对草莓炭疽根腐病的重视程度亟待提高[J]. 植物保护, 2015,41(2): 234236.
[5] EMBABY E M, RAGAB M E, DOUG K A A D, et al. First report of Colletotrichum acutatum and C.gloeosporioides causing anthracnose diseases on strawberry in Egypt [J]. Plant Pathology, 2010, 59(4): 808.
[6] 钟珊, 张涛, 杨俊, 等. 草莓丝核根腐病的病原菌鉴定[J]. 植物病理学报, 2016, 46(3): 289293.
[7] MARTIN F N. Rhizoctonia spp. recovered from strawberry roots in central coastal California [J].Phytopathology,2008,90(4): 345353.
[8] ADHIKARI T B, HODGES C S, LOUWS F J. First report of Cylindrocarpon sp. associated with root rot disease of strawberry in North Carolina [J].Plant Disease, 2013, 97(9): 1251.
[9] 朱杰华, 樊慕贞, 蔺成武. 草莓根腐病病原初步研究[J].河北农业大学学报,1994,17(2): 4548.
[10]CHAMORRO M, AGUADO A, SANTOS B D L. First report of root and crown rot caused by Pestalotiopsis clavispora (Neopestalotiopsis clavispora) on strawberry in Spain[J]. Plant Disease, 2016, 100(7): 1495.
[11]SHARON M, FREEMAN S, KUNINAGA S, et al. Genetic diversity, anastomosis groups and virulence of Rhizoctonia spp. from strawberry [J].European Journal of Plant Pathology, 2007, 117(3): 247265.
[12]MANICI L M, BONORA P. Molecular genetic variability of Italian Binucleate Rhizoctonia spp. isolates from strawberry [J]. European Journal of Plant Pathology, 2007, 118(1): 3142.
[13]胡彦江,张茹琴.烟台地区草莓根腐病病原鉴定及致病性测定[J].北方园艺,2012,10:141144.
[14]王中武,臧慧明.草莓根腐病病原鉴定及生物学特性研究[J].广东农业科学,2011(8):6364.
[15]ZHONG S, ZHANG G Z. First Report of root rot on strawberry caused by binucleate Rhizoctonia AG-A in China[J]. Plant Disease, 2016, 100(1): 225.
[16]邓之亮,杨新东,蒋莉莉.8种杀菌剂对棉花立枯丝核菌的室内毒力测[J].世界农药,2015,37(3):5861.
[17]曾向萍,王三勇,王会芳,等.红麻立枯丝核病病菌生物学特性[J].中国植保导刊,2013,33(5):1215.
[18]王中武,邹致强,胡延生.草莓根腐病的药剂筛选[J].安徽农业科学,2009,37(17):8046.
[19]方中达.植病研究方法[M].2版.北京:中国农业出版社,1998.
[20]XU J R, HAMER J E. MAP kinase and cAMP signaling regulate infection structure formation and pathogenic growth in the rice blast fungus Magnaporthe grisea[J]. Genes and Development, 1996, 10:26962706.
[21]陈延熙,张敦华,段霞瑜,等.关于Rhizoctonia solani菌丝融合分类和有性世代的研究[J].植物病理学报,1985(3):139143.
[22]张敦华,陈延熙.双核丝核菌的菌丝融合分类[J].植物病理学报,1986(3):1318.
[23]MARTIN F N. Rhizoctonia spp. recovered from strawberry roots in central coastal California [J]. Phytopathology, 2000, 90: 345353.
[24]BOTHA A, DENMAN S, LAMPRECHT S C, et al. Characterisation and pathogenicity of Rhizoctonia isolates associated with black root rot of strawberries in the Western Cape Province, South Africa[J]. Australasian Plant Pathology, 2003, 32: 195201.
[25]FANG X L, FINNEGAN P M, BARBETTI M J. Wide variation in virulence and genetic diversity of binucleate Rhizoctonia isolates associated with root rot of strawberry in Western Australia [J/OL]. PLoS ONE, 2013, 8, 2: e55877.
(責任编辑:田 喆)

