6种梨果实对轮纹病的抗性差异及4种杀菌剂对轮纹病菌的抑菌作用
张璐 刘奇志 张国珍

摘要 由葡萄座腔菌Botryosphaeria dothidea引起的梨轮纹病是梨生产中重要的真菌性病害,主要造成树势早衰和果实腐烂,严重影响梨的产量和品质。本研究选取市售的6个品种的梨果实,用分离自梨枝干的轮纹病菌进行了离体果实接种,测定不同品种果实对梨轮纹病的抗性差异。接种后6 d,按照病斑直径从大到小的顺序,品种排序依次为‘丰水梨>‘南果梨>‘库尔勒香梨>‘皇冠梨>‘雪花梨>‘砀山酥梨,随病斑减小抗性依次增强。测定了4种杀菌剂对梨轮纹病菌菌丝生长的抑制作用,结果表明,咯菌腈、氟啶胺和咪鲜胺对梨轮纹病菌的菌丝生长有很强的抑制作用,EC50分别为0.010 3、0.022 4 μg/mL和0.034 3 μg/mL;代森锰锌的EC50为3.860 7 μg/mL,也有较好的抑菌效果。本试验结果为了解不同梨品种对轮纹病的抗性及杀菌剂的选用提供了依据,具有一定的指导意义。
关键词 梨轮纹病; 品种抗性; 杀菌剂
中图分类号: S 436.612.1
文献标识码: A
DOI: 10.16688/j.zwbh.2018368
葡萄座腔菌Botryosphaeria dothidea是引起农林业重要真菌病害的病原菌,在生态系统中占有重要的地位[1]。B.dothidea属子囊菌门,葡萄座腔菌属[2]。我国最早于1928年在辽宁省发现该病原菌引起苹果轮纹病[3]。B.dothidea寄主广泛,可侵染梨、苹果、桃、李、杏、海棠、板栗、枣等至少45个属的植物,导致木材品质下降,花朵观赏价值降低,水果质量变差[47]。
我国是梨生产大国,梨种类繁多,栽培面积仅次于苹果,梨果生产在我国占有重要的经济地位[8]。由B.dothidea引起的梨轮纹病是造成梨减产的重要病害。梨树树干、叶片、果实等部位均可被侵染,导致树势早衰、叶片干枯脱落、果实腐烂,尤其是贮藏期或多雨的年份,病害发生严重时烂果率超过80%,造成无法挽回的损失[9]。近年来,梨轮纹病不仅在中国发生严重,在日本、韩国等周边国家的发病率也逐年升高[10]。因此,有必要加强对梨轮纹病的相关研究。
利用抗病品种是防治植物病害的有效途径之一。不同梨品种枝干或果实对轮纹病的抗性存在差异。如山东地区种质资源中‘金秋、‘毛杜梨和‘秋白梨较抗枝干轮纹病[11]。田路明等[12]采用幼果期无伤接种,比较了13份梨品种在果实成熟期和室温贮藏期的轮纹病发生情况,表明不同品种果实对轮纹病抗性不同,室温贮藏期的果实发病率较成熟期显著提高。江苏省的14个品种中,‘金水秋、‘晚三吉和‘砀山梨对果实轮纹病表现为抗病[9]。由此可见,基于自然发病条件下对梨品种果实抗轮纹病的测定易受环境条件的影响,在有利于果实轮纹病发生的时期接种,测定果实对轮纹病的抗性能更好地反映品种间的抗性。
本研究分别从白梨系统、砂梨系统和秋子梨系统中选取不同代表品种,在实验室相对一致的可控条件下,测定了6种梨果对轮纹病的抗性差异,避免了田间环境多变对试验结果的影响。同时,试验还测定了4种杀菌剂对轮纹病菌的抑菌作用。旨在为充分利用不同梨品种果实对轮纹病的抗性以及为梨生产上选用有效的杀菌剂提供科学依据。
1 材料与方法
1.1 试验材料
轮纹病菌分离自2016年从北京市海淀区采集的表现典型轮纹病症状的梨树树干。
梨果实品种:白梨系统‘库尔勒香梨、‘砀山酥梨和‘雪花梨;砂梨系统‘皇冠梨和‘丰水梨;秋子梨系统‘南果梨。梨果实均购自北京市海淀区的超市。
供试杀菌剂原药:90%代森锰锌、95.2%咯菌腈、97%氟啶胺和98.1%咪鲜胺,由中国农业大学种子病理学实验室刘西莉教授提供。
1.2 试验方法
1.2.1 病原菌的分离和纯化
采用常规组织分离法对表现有瘤状凸起病斑的梨轮纹病树皮病样进行分离。在病健交界处取约5 mm见方的组织块,在3.3% NaClO溶液中表面消毒1 min,用无菌蒸馏水漂洗3次,再用灭菌吸水纸吸干表面水分,置于PDA培养基上,25℃,光照培养。3 d后从病组织块周围长出的菌落边缘挑取少量菌丝转皿培养,待病原菌产孢后,配制孢子悬浮液,采用单孢分离法获得纯化的单孢菌株。对菌株进行編号保存备用。
1.2.2 分离菌株的形态学观察
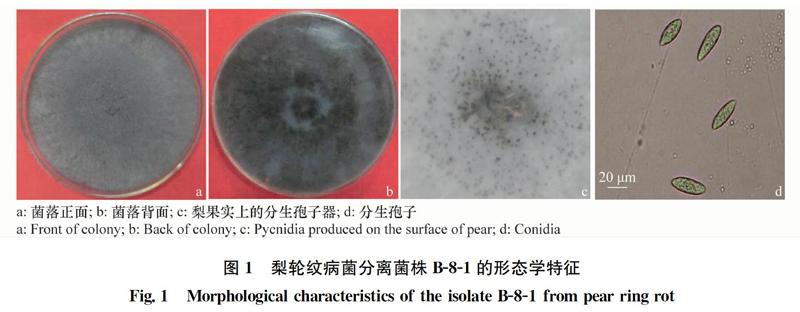
将纯化的菌株B-8-1接种于PDA平板上,25℃,光照培养15 d,观察菌落的颜色、形态、质地以及气生菌丝的生长情况,是否产生分生孢子等。
1.2.3 分离菌株的分子生物学鉴定
DNA提取:将菌株B-8-1接种于铺有灭菌玻璃纸的PDA平板,25℃,光照培养5 d,刮取菌落表面适量菌丝,采用CTAB法提取基因组DNA。
PCR扩增及序列分析:用3对引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)/ITS4(5′-TCC-TCCGCTTATTGATATGC-3′)、Bt-2a(5′-GGTAACCAAATCGGTGCTGCTTTC-3′)/Bt-2b(5′-AC-CCTCAGTGTAGTGACCCTTGGC-3′)和EF1-728F(5′-CATCGAGAAGTTCGAGAAGG-3′)/EF1-986R(5′-TACTTGAAGGAACCCTTACC-3′)分别对菌株B-8-1的rDNA-ITS、β-tubulin基因和EF1-α基因进行PCR扩增[13]。扩增产物经1.5%琼脂糖凝胶电泳后,送北京擎科新业生物技术有限公司测序。测序结果在GenBank中进行BLAST比对分析。
1.2.4 梨果实接种
采用室内离体接种法测定不同梨品种的果实对梨轮纹病的抗性差异。将菌株B-8-1于PDA平板上进行活化,25℃,光照培养5 d,在菌落边缘打取直径2 mm的菌块用于接种。
选购市售的无伤、健康的6种梨果实,用75%乙醇表面消毒,无菌水冲洗3次,自然晾干,在每个果实的赤道部打1个直径2 mm的小孔,接种梨轮纹病菌菌丝块,以接种PDA培养基块的处理为对照。每个处理接种10个果实。25℃,黑暗放置48 h后,在L∥D=12 h∥12 h光照黑暗交替条件下培养6 d,每24 h观察1次发病进程,6 d后测量病斑直径。计算各品种梨果实病斑直径平均值,评价各品种的抗性。
1.2.5 杀菌剂的毒力测定
采用菌丝生长抑制法测定杀菌剂对轮纹病菌菌株B-8-1的抑制作用。
用分析天平準确称量杀菌剂原药分别放入5 mL保存管中,加入一定体积的二甲基亚砜(DMSO),在QL-901振荡仪(海门市其林贝尔仪器制造有限公司)上振荡至药剂充分溶解,配制成105 mg/L的母液,4℃黑暗保存备用。
为确保所设置每种药剂的浓度对轮纹病菌的抑制率处于5%~95%之间,90%代森锰锌设置7个浓度梯度,分别为0.1、1.0、5.0、25.0、50.0、75.0 mg/L和100.0 mg/L;95.2%咯菌腈设置6个浓度梯度,分别为0.002、0.005、0.01、0.02、0.05 mg/L和0.1 mg/L;97%氟啶胺设置7个浓度梯度,分别为0.001、0.005、0.01、0.05、0.1、0.5 mg/L和1.0 mg/L;98.1%咪鲜胺设置7个浓度梯度,分别为0.000 5、0.002、0.01、0.05、0.1、0.5 mg/L和1.0 mg/L。
将药液加入60℃左右的PDA培养基中,充分混匀后倒入培养皿(直径90 mm)中,制成系列浓度的含药平板,以加入DMSO的培养基作为对照。在菌落边缘打取直径5 mm的菌饼,接种到含药平板中央,每处理3次重复。25℃,黑暗培养。待对照菌落直径长至约60 mm时,用十字交叉法测量菌落直径,计算菌丝生长抑制率。
菌丝生长抑制率=(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)×100%;
数据处理:使用DPS 7.05数据分析软件,将菌丝生长抑制率换算成几率值(y),药剂浓度换算成浓度对数(x),求得浓度对数与几率值的线性回归方程y=ax+b,并计算出药剂对梨轮纹病菌的抑制中浓度(EC50)、几率值和相关系数r。
2 结果与分析
2.1 病原菌的形态学鉴定
菌株B-8-1在PDA培养基上25℃下培养,呈圆形辐射状生长。菌丝体初期白色,随着培养时间的延长,气生菌丝呈灰黑色,20 d左右菌落完全变为暗黑色(图1a和b)。在梨果实上产生黑色扁球形的分生孢子器(图1c),从分生孢子器中释放出无色、单胞、纺锤形或椭圆形、大小(24~30)μm×(6~8)μm的分生孢子(图1d)。根据菌落形态和颜色、分生孢子颜色、大小、形状等形态特征[1],可将菌株B-8-1鉴定为葡萄座腔菌属Botryosphaeria。
2.2 分离菌株的分子生物学鉴定
用3对引物ITS1/ITS4、Bt-2a/Bt-2b、EF1-728F/EF1-986R对菌株B-8-1的基因组DNA进行PCR扩增,分别得到大小约为550、500和250 bp的条带。扩增产物经测序后在NCBI上进行BLAST分析,发现菌株B-8-1的ITS序列与B.dothidea(登录号为MG595271.1、KF516940.1、KC960911.1、JF800138.1、JF800137.1、GQ870286.1等)的相似性均为99%;β-tubulin基因的序列与B.dothidea(登录号为KU565871.1、KR260833.1、KC961011.1、JF441078.1、HQ660476.1、KX281147.1等)的相似性为100%;EF1-α基因的序列与B.dothidea(登录号为KC961067.1、KC961053.1、KC961047.1、KC961041.1、JQ900341.1、GU251233.1等)的相似性为100%。序列分析表明,菌株B-8-1为葡萄座腔菌B.dothidea。
2.3 不同品种梨果实对轮纹病的抗性
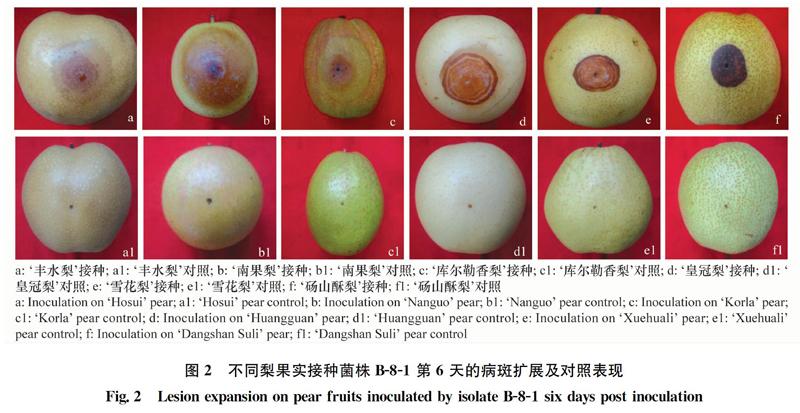
用梨轮纹病菌菌株B-8-1接种健康梨果实引起果实腐烂发病。果实表皮组织最初变软,然后以接种点为中心向外扩展,病斑近圆形,水渍状,最后变为浅褐色、褐色或黑褐色大病斑;‘皇冠梨和‘雪花梨还伴有深浅相间的褐色同心轮纹(图2a~f)。病部果肉腐烂伴有酸臭味。
从病斑大小看,不同品种果实对轮纹病的抗性存在明显差异。‘丰水梨病斑直径最大,为49.7 mm,相对最为感病;其次为‘南果梨和‘库尔勒香梨,病斑直径分别为40.0 mm和36.1 mm;‘皇冠梨和‘雪花梨病斑直径较小,分别为25.9 mm和24.4 mm;‘砀山酥梨病斑直径最小,为15.1 mm,在所测试的6个品种中表现最为抗病。同一梨系统的不同品种对轮纹病的抗性也不相同,如砂梨系统的‘皇冠梨和‘丰水梨、白梨系统的‘库尔勒香梨和‘砀山酥梨品种间的病斑大小有显著差异,对轮纹病的抗性明显不同(表1)。对照梨果均未发病,接种点表现为失水干缩或失水变褐(图2a1~f1)。
2.4 杀菌剂对梨轮纹病菌的毒力测定
室内毒力测定结果表明,供试4种杀菌剂代森锰锌、咯菌腈、氟啶胺和咪鲜胺对梨轮纹病菌菌丝生长均具有较好的抑制作用。根据EC50,咯菌腈、氟啶胺和咪鲜胺对梨轮纹病菌菌株B-8-1菌丝生长的抑制作用很强,代森锰锌的抑制作用相对较弱,按照由强到弱依次为:咯菌腈>氟啶胺>咪鲜胺>代森锰锌。4种杀菌剂的毒力回归方程、相关系数、EC50结果列于表2。
3 讨论
梨轮纹病菌是一种弱寄生菌[14]。明确梨果品种间抗性,有利于对轮纹病的防控和梨果增产保质,提高经济效益。李树玲和黄礼森[15]对秋子梨、白梨和洋梨3个梨系统果实轮纹病在田间的自然发生情况进行了调查,发现秋子梨系统的果实大部分抗病,‘南果梨最抗病;白梨和洋梨系统的果实大部分不抗病。曹玉芬等[16]采用喷雾接种法对梨树上的幼果进行接种,在成熟期鉴定了28个梨品种果实对轮纹病的抗性,其中白梨系统最抗病,8个品种中有5个表现高抗或抗病;砂梨为中间类型,西洋梨最差。本试验结果发现不同梨系统果实对轮纹病的抗性有明显差异,其中白梨系统的‘砀山酥梨抗性最强,砂梨系统的‘丰水梨抗性最差,秋子梨系统的‘南果梨不抗轮纹病。本试验结果与前人调查结果[1516]有出入,其原因可能与测定方法不同有很大关系。本试验采用的是室内离体接种法,接种后温湿度控制在一致的条件下,避免了外在环境因素多变而造成的影响。
有研究表明,梨品种的抗性差异可能与梨品种的成熟期早晚[9]、糖酸含量[17]等因素有关。赵梅等[18]发现果肉中石细胞和酚类物质的含量与梨果对轮纹病的抗扩展能力呈正相关。梨品种所表现出的抗病性,除自身组织结构外,是否存在相关抗性基因,是否与相关基因表达的产物有关[7],还需更深入的研究来进一步证明。
传统上多用波尔多液、石硫合剂等无机杀菌剂防治梨轮纹病,后来出现了多菌灵、甲基硫菌灵等苯并咪唑类杀菌剂。但近些年随着病原菌抗药性的产生,很多药剂的药效逐年降低[7, 19]。有结果表明,25%吡唑醚菌酯乳油和80%戊唑醇可湿性粉剂均为防治梨轮纹病较为理想的低毒、低残留、持效期长的内吸治疗性杀菌剂,田间喷洒时不仅可杀死植株表面的病原菌,还可被植株迅速吸收传导至体内发挥作用[2022]。本试验测定了有机硫类的代森锰锌、二硝基苯胺类的氟啶胺、吡咯类的咯菌腈和酰胺类的咪鲜胺4种杀菌剂对轮纹病菌菌丝生长的抑制作用,发现氟啶胺、咪鲜胺和咯菌腈均有很好的抑菌作用。试验结果为梨轮纹病的化学防治提供了候选药剂,也为药剂的轮换使用提供了科学依据。
参考文献
[1] 李文英, 庄文颖. 中国葡萄座腔菌属分类研究概况[J]. 菌物学报, 2013, 32(S1): 108114.
[2] CROUS P W, SLIPPERS B, WINGFIELD M J, et al. Phylogenetic lineages in the Botryosphaeriaceae [J]. Studies in Mycology, 2006, 55: 235253.
[3] 康玲, 郝红梅, 杨振英,等. 苹果轮纹病研究进展[J]. 中国农学通报, 2009, 25(9):188191.
[4] SLIPPERS B, WINGFIELD M J. Botryosphaeriaceae as endophytes and latent pathogens of woody plants: diversity, ecology and impact [J]. Fungal Biology Reviews, 2007, 21(2/3):90106.
[5] 吴小芹, 何月秋, 刘忠华. 葡萄座腔菌属所致树木溃疡病发生与研究进展[J]. 南京林业大学学报, 2001, 25(1): 6166.
[6] CUNNINGTON J H, PRIEST M J, POWNEY R A, et al. Diversity of Botryosphaeria, species on horticultural plants in Victoria and New South Wales [J]. Australasian Plant Pathology, 2007, 36(2): 157159.
[7] 田路明, 周宗山, 董星光, 等. 梨轮纹病研究进展[J]. 中国果树, 2013(4): 7477.
[8] WU Jun, WANG Zhiwen, SHI Zebin, et al. The genome of the pear (Pyrus bretschneideri Rehd.)[J].Genome Research,2013,23(2):396408.
[9] 张丽丽, 常有宏, 蔺经, 等. 不同梨品种果实对梨轮纹病菌的抗性[J]. 江苏农业学报, 2010, 26(2): 440442.
[10]ZHAI Lifeng, ZHANG Meixin, LV Gang, et al. Biological and molecular characterization of four Botryosphaeria species isolated from pear plants showing stem wart and stem canker in China [J]. Plant Disease, 2014, 98(6): 716726.
[11]魏树伟,张勇,王少敏.43份山东地方梨种质资源对枝干轮纹病、腐烂病的抗性评价[J].落叶果树,2016,48(1):1516.
[12]田路明,董星光,周宗山,等.梨品种果实人工接种轮纹病的抗性评价[J].辽宁农业科学,2013(3):1517.
[13]SLIPPERS B, CROUS P W, DENMAN S, et al. Combined multiple gene genealogies and phenotypic characters differentiate several species previously identified as Botryosphaeria dothidea [J]. Mycologia, 2004, 96(1): 83101.
[14]赵杰,赵宝明,陆晓莉,等.梨轮纹病菌的生物学特性及药剂的毒力测定[J].上海交通大学学报(农业科学版),2016,34(3):7984.
[15]李树玲,黄礼森.梨轮纹病抗性调查初报[J].北方果树,1993(4):2526.
[16]曹玉芬,孙秉钧,李美娜,等.梨品种果实对轮纹病的抗性鉴定[J].果树科学,1999,16(3):180184.
[17]MCGLOHON N E. Botryosphaeria dothidea-where will it stop?[J]. Plant Disease, 1982, 66(12): 12021203.
[18]赵梅,陶书田,齐开杰,等.梨成熟果实对炭疽病菌和轮纹病菌抗扩展能力的评价[J].植物保护,2013,39(4):6571.
[19]文克俭,周玉锋.几种常用杀菌剂对梨轮纹病的室内毒力测定[J].湖北植保,2001(1):2728.
[20]祁之秋,周明国.戊唑醇对小麦纹枯病菌的抑菌作用[J].農药学学报,2003,5(3):8084.
[21]曲健禄,李晓军,张勇,等.戊唑醇对苹果斑点落叶病菌及轮纹病菌的毒力和药效评价[J].农药学学报,2007,9(2):149152.
[22]蒋军喜,戴兆基,唐自文,等.5种杀菌剂对梨轮纹病菌的毒力测定和田间药效试验[J].江西农业大学学报,2010,32(4):710713.
(责任编辑:杨明丽)

