DC-CIK与化疗、射频消融联用治疗结直肠癌术后肝转移疗效
赵海燕 云升 李超 苏乌云 张雪琳


[摘要]目的:观察树突状细胞一细胞因子诱导杀伤细胞(DC-CIK)联合化疗、射频消融治疗结直肠癌术后肝转移疗效。方法:回顾性分析我院2012年8月至2015年8月收治的结直肠癌术后肝转移患者临床资料,全身化疗联合射频消融治疗者归入对照组,化疗、射频之外再联合DC-CIK治疗者归入观察组,比较两组患者肝转移灶切除率、治疗效果以及治疗前后T细胞亚群变化情况、生存率及生活质量。结果:治疗后观察组肝转移灶切除率24.66%高于对照组的10.67%,差异有统计学意义(P<0.05)。观察组客观控制率(ORR)64.38%高于对照组的29.33%,差异有统计学意义(P<0.05)。治疗前T细胞亚群各指标组间比较差异无统计学意义(P>0.05)。治疗后观察组CD4*与CD4*/CD8*均高于对照组,差异有统计学意义(P<0.05)。治疗后CD8*组间比较差异无统计学意义(P>0.05)。治疗前两组肿瘤标志物水平组间比较差异无统计学意义(P>0.05)。治疗后观察组CEA及CA125水平较对照组低,差异有统计学意义(P<0.05)。观察组1年生存率、2年生存率及3年生存率均高于对照组,差异有统计学意义(P<0.05)。观察组情感功能、生理功能、社会生活与日常生活评分均高于对照组,差异有统计学意义(P<0.05)。结论:常规治疗基础上联合DC-CIK治疗可提高结直肠癌术后肝转移患者免疫功能及肝转移灶切除率,改善生存率及生活质量。
[关键词]结直肠癌;肝转移;树突状细胞;细胞因子诱导的杀伤细胞;化疗
中图分类号:R735.3
文献标识码:A
文章编号:2095-5200(2019)02-057-05
DOI:10.11876/mimt201902015
结直肠癌是常见的胃肠道恶性肿瘤,其病死率与发病率在消化系统恶性肿瘤居于第四位川。该病早期症状不明显,发病时多进展至中晚期。结直肠癌根治术目前是治疗结直肠癌的首选方式,术后5年生存率通常在40%以上,早期患者可达到90%~95%日。但根治术后肝转移的发生率高达20%~50%,是影响预后的重要原因间。结直肠癌肝转移患者预后极差,采用伊利替康等新一代化学药物治疗的中位生存期为21个月,而未经治疗者中位生存期仅为6.9个月4。放化疗及外科手术治疗无法彻底解决癌细胞扩散、转移的问题,放化疗的毒副作用甚至可能加速病情进展。DC-CIK是一种肿瘤生物治疗手段,利用同源树突状细胞(DC)与杀伤细胞(CIK)杀伤肿瘤细胞,改善免疫功能,以达到改善预后的目的6。为探讨DC-CIK的应用效果,本次研究分析了73例采用DC-CIK治疗的结直肠癌术后肝转移患者临床资料,现将结果报道如下。
1资料与方法
1.1一般资料
将我院2012年8月至2015年8月治疗的结直肠癌術后肝转移患者纳人研究。入组标准:年龄18~79岁;结直肠癌根治术后;符合《结直肠癌肝转移诊断和综合治疗指南(2016版)》[7]中诊断标准;治疗前签署知情同意书;人组前3个月内未进行抗肿瘤治疗;Karnofsky评分≥70分;接受2个以上治疗疗程。排除标准:合并其他部位转移;合并腹水;合并重要脏器器质性病变。按治疗方案分组,全身化疗联合射频消融治疗者归人对照组,化疗、射频之外再联合DC-CIK治疗者归人观察组。两组患者一般资料见表1,组间比较差异无统计学意义(P>0.05)。
1.2治疗方案
所有患者首先进行肝转移灶射频消融,经B超定位后,采用美国RITA多极射频针消融。初始化疗方案为FOLFOX6:给予奥沙利铂+亚叶酸钙+5-氟尿嘧啶联合化疗,按体表面积给药,第1d奥沙利铂85mg/m2静脉滴注2~3h,5-氟尿嘧啶400mg/m2静脉滴注2h,亚叶酸钙400mg/m2静脉滴注2h,后续奥沙利铂与亚叶酸钙用量不变,5-氟尿嘧啶每天按1200mg/m2给药,采用微量泵持续泵入,均重复用药2周。2周为1个疗程。每个疗程结束2周后判断是否进行手术,是否调整化疗方案。效果欠佳者可更换为FOLFIRI(初始方案奥沙利铂替换为伊利替康)与FOLFOXIRI(初始方案基础上增加伊利替康)治疗。观察组在此基础上采用DC-CIK治疗,化疗当天抽取50mL静脉血,离心提取单个核细胞并置于GT-T551培养基中培养,然后将贴壁细胞与悬浮细胞诱导分化为DC细胞与CIK细胞,将DC细胞致敏后与CIK细胞共培养形成成熟DC-CIK细胞,将制备好的DC-CIK细胞加人100mL2%白蛋白生理盐水回输。1个疗程结束后第7d时进行1次DC-CIK治疗,连续3d将总数超过1x100个的DC-CIK细胞经静脉回输体内,每天输注细胞数不少于3x10°个。通常治疗2~3个疗程。
1.3观察指标
治疗效果:按照《实体瘤疗效评价标准1.1版》8]进行评价,分为完全缓解(CR)、部分缓解(PR)、进展(PD)与稳定(SD)。病灶消失为CR,病灶直径,总和缩小≥30%为PR,病灶直径总和增幅≥20%为PD,其余情况为SD。客观控制率(ORR)=(CR+PR)/总例数x100.00%。
T细胞亚群:检测治疗前及末次治疗结束2周后外周血CD4*与CD8*表达水平,以及CD4/CD8*比值,均采用流式细胞仪进行检测。
肿瘤标志物:检测治疗前及末次治疗结束2周后检测患者血清CA125及CEA表达水平,采用Elecsys1010全自动电化学发光免疫分析仪进行检测。
生存情况:治疗结束后每3个月随访1次,以治疗开始当日为起点,统计两组患者生存率。生活质量采用KPS评分量表评定,在末次治疗结束2周后进行。
1.4统计学分析
對本临床研究的所有数据采用SPSS18.0进行分析,计数资料以[n(%)]表示,并采用x2检验,计量资料以(x士s)表示,并采用t检验,采用Log-Rank检验比较两组患者生存情况,以P<0.05为差异有统计学意义。
2结果
2.1两组患者治疗效果比较
治疗后观察组18例(24.66%)患者切除肝转移灶,对照组8例(10.67%)患者切除,切除率比较差异有统计学意义(x2=5.000,P<0.05)。观察组ORR率高于对照组,差异有统计学意义(P<0.05)。见表2。
2.2两组患者T细胞亚群比较
治疗前T细胞亚群各指标组间比较差异无统计学意义(P>0.05)。治疗后观察组CD4*与CD4*/CD8*均高于对照组,差异有统计学意义(P<0.05)。治疗后CD8*组间比较差异无统计学意义(P>0.05)。见表3。
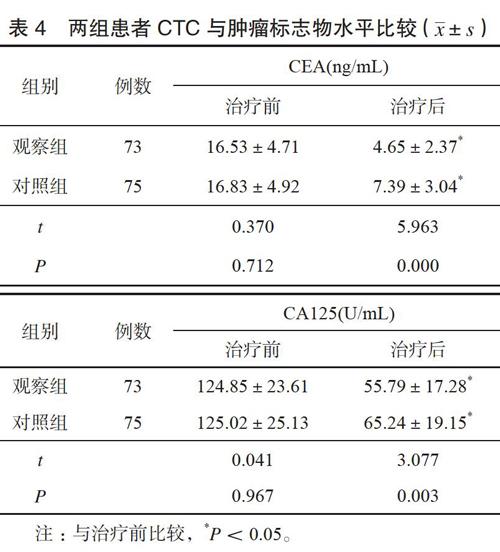
2.3两组肿瘤标志物水平比较
治疗前肿瘤标志物水平组间比较差异无统计学意义(P>0.05)。治疗后观察组CEA及CA125水平较对照组低,差异有统计学意义(P<0.05)。见表4。
2.4两组患者生存率比较
观察组1年生存率、2年生存率及3年生存率均高于对照组,差异有统计学意义(P<0.05)。见表4。
2.5两组患者生存质量比较
观察组情感功能、生理功能、社会生活与日常生活评分均高于对照组,差异有统计学意义(P<0.05)。见表5。
3讨论
DC-CIK治疗是一种较为成熟的生物疗法,通过回输自体免疫细胞提高机体免疫功能,以促进癌细胞的清除。DC细胞是启动细胞免疫应答的关键因素,通过MHCI类及II类分子捕获外源性抗原并提呈给细胞毒性T淋巴细胞或辅助性T淋巴细胞9。CIK细胞包括细胞毒性T淋巴细胞、自然杀伤T淋巴细胞及辅助性T淋巴细胞等多种细胞类型,其中起到主要抗肿瘤效应的细胞是CD3*CD56*T淋巴细胞[10]。CD3*CD56*T淋巴细胞兼具T细胞的细胞毒性与自然杀伤细胞的非MHC限制性,而癌细胞转移、增殖的主要原因正是缺乏非MHC性细胞介导主动免疫川。因此,DC细胞与CIK细胞混合培养能够有效提升抗肿瘤活性[12]。同时,DC-CIK细胞在机体内可存续14d以上,且具有扩增能力强、获取方便等特点,适合临床抗肿瘤治疗[13]。改善免疫功能是DC-CIK治疗抗肿瘤的关键,且化疗对细胞免疫有抑制作用,可导致CD4*与CD4*/CD8*下降14。本次研究发现治疗后观察组CD4*与CD4*/CD8*均高于对照组,表明DC-CIK治疗可有效恢复机体免疫活性。这有利于提高DC功能,指导CIK细胞杀灭癌细胞。
近年来DC-CIK治疗在乳腺癌、非小细胞肺癌、胃癌等多种实体肿瘤以及白血病中均有应用,在结直肠癌的姑息治疗及术后的辅助治疗中也有较好效果[5-1。本次研究发现,治疗后观察组肝转移灶切除率高于对照组及ORR率高于对照组,表明DC-CIK治疗可有效缩小结直肠癌术后肝转移患者病灶,提高肝转移灶切除率。目前认为DC-CIK治疗在肿瘤负荷较低时疗效较好,因此本次研究在DC-CIK治疗前采用化疗及射频消融等常规治疗治疗降低肿瘤负荷17。同时,常规治疗与DC-CIK治疗还可发挥协同作用[18]:DC-CIK疗法通过提高免疫功能杀灭常规治疗后残留的肿瘤细胞,而常规治疗中的化疗药物对部分免疫抑制细胞数量有选择性清除作用,共同作用下可进一步提升免疫功能、减少肿瘤细胞。但需要注意的是,化疗药物对DC-CIK细胞也有杀伤作用,因此化疗与DC-CIK治疗应保持适当时间间隔[19。本次研究对两组患者生存情况进行观察,结果发现观察组生活质量与生存率均优于对照组,表明DC-CIK治疗可有效改善结直肠癌肝转移患者生存情况,这主要与免疫功能改善后肿瘤进展得到控制有关。
综上所述,常规治疗基础上联合DC-CIK治疗可提高结直肠癌术后肝转移患者免疫功能及肝转移灶切除率,改善生存率与生活质量,疗效优于常规治疗。
参考文献
[1] suN J, KATO I. Gut microbiota, in flammation andcolorectal cancer[J]. Annu Rev Microbiol, 2016, 3(2):130-143.
[2] LIC X, AN X X, ZHAO B, et al. Impact of operationtiming on post-operative infections following colorectalcancer surgery[J]. ANZ J Surg, 2016, 86(4):294-298.
[3] KAHI C J, POHL H, MYERS L, et al. Colonoscopy isAssociated with Decreased Colorectal Cancer Mortalityin the Veterans Affairs System[J]. Gastroenterology,2017, 152(5):S22.
[4] BENAVENTE S B T, COSTA A L S. Chemotherapytreatment: Colorectal cancer patients' perception[J].Oncol Nurs Forum, 2018, 42(2):E190-E191.
[5] GOVAERT J A, VAN DIJK W A, FIOCCO M, et al.Nationwide Outcomes Measurement in ColorectalCancer Surgery: Improving Quality and ReducingCosts[J]. J Am Coll Surg, 2016, 222(1):19-29.e2.
[6]蔡凱,艾月琴,张闯,等.DC-CIK细胞治疗局部晚期和晚期胰腺癌患者的临床疗效[J].中国肿瘤生物治疗杂志,2013,20(4):449-455.
[7]中华医学会外科学分会胃肠外科学组.结直肠癌肝转移诊断和综合治疗指南(2016版)[J].中华消化外科杂志,2016,15(8):755-767.
[8]石力夫,雷振.不同疗效评价标准对结肠癌肝转移瘤疗效评价的一致性研究[J].解放军医学院学报,2014,35(1):25-27.
[9] ROSENBLATT J, VASIR B, UHL L, et al. Vaccinationwith DC/tumor fusion cells results in cellular andhumoral anti[J]. Blood, 2010, 117(2):393-402.
[10] CHANG B, SHEN L, WANG K, et al. High number ofPD-1 positive intratumoral lymphocytes predict survivalbenefit of CIK cells for hepatocellular carcinomapatients[J]. Liver Int, 2018,38(8):1449-1458.
[11] LI D P, LI W, FENG J, et al. Adjuvant ChemotherapyWith Sequential Cytokine-Induced Killer (CIK) Cellsin Stage IB Non-Small Cell Lung Cancer[J]. Oncol Res,2015, 22(2):67.
[12] ZHAO X, ZHANG Z, LI H, et al. Cytokine inducedkiller cells-based immunotherapies in patients withdifferent stages of renal cell carcinoma[J]. Cancer Lett.2015, 362(2):192-198.
[13] REN P T, ZHANG Y. Comparative investigation of theeffects of specific antigen-sensitized DC-CIK and DC-CTL cells against B16 melanoma tumor cells[J]. MolMed Rep, 2017, 15(4):1533-1538.
[14] RAWAL S, YANG Y P, COTE R, et al. Identification andQuantitation of Circulating Tumor Cells[J]. Annu RevAnal Chem, 2017, 10(1):321.
[15] MU Y, ZHOUC H, CHEN S F, et al. Effectivenessand safety of chemotherapy combined with cytokine-induced killer cell /dendritic cell-cytokine-induced killercell therapy for treatment of gastric cancer in China: Asystematic review and meta-analysis[J]. Cytotherapy,2016, 18(9):1162-1177.
[16]CHENCL,PANQZ,WENGDS,etal.Safetyand activity of PD-1 blockade-activated DC-CIKcells in patients with advanced solid tumors[J].Oncoimmunology, 2018,7(4):e1417721
[17] WU F H, MU L, LI X L, et al. Characterization andfunctional analysis of a slow-cycling subpopulation incolorectal cancer enriched by cell cycle inducer combinedchemotherapy[J]. Oncotarget, 2017, 8(45):78466-78479.
[18] SUN W W, DOU J X, ZHANG L, et al. Killing effectsof Huaier Granule combined with DC-CIK on nudemice transplanted w ith colon carcinoma cell line[J].Oncotarget, 2017, 8(28):46081-46089.
[19] LIN M, LIANG S, JIANG F, et al. 2003-2013, avaluable study: autologous tumor lysate-pulsed dendriticcell immunotherapy with cytok ine-induced killercells improves survival in stage IV breast cancer[J].Immunology Letters, 2017, 183(06):37-43.

