镇痛泵不同剂量右美托咪定联合舒芬太尼对胸科手术术后镇痛的影响
田昀

[摘要]目的:探讨不同剂量右美托咪定联合舒芬太尼对胸科手术患者术后镇痛的临床效果。方法:择期行开胸手术患者96例,根据术后镇痛情况随机分为A、B、C组,每组各32例(A组:盐酸右美托咪定0.05μg/kg'h+舒芬太尼0.05μgkg'+生理盐水共120mL进行术后静脉自控镇痛;B组:盐酸右美托咪定0.075μg/kg.h+舒芬太尼0.05μg/kg°h+生理盐水共120mL进行术后静脉自控镇痛;C组:盐酸右美托咪定0.1μg/kg°h+舒芬太尼0.05μg/kg.h+生理盐水共120mL行术后静脉自控镇痛)。采用疼痛视觉模拟评分(VAS)和改良警觉/镇静(OAA/S)评分,评价3组患者术后疼痛和镇静情况,记录各组患者镇痛泵按压次数、额外使用补救镇痛药物情况及术后自控镇痛期间不良反应发生情况。结果:术后2h3组患者VAS及OAA/S评分差异无统计学意义,B、C两组患者术后4h、8h、12h、24h、48h的VAS及OAAS评分显著低于A组(P<0.05);B、C两组患者术后自控镇痛按压次数及追加镇痛药次数均显著低于A组(P<0.05);A、B两组患者术后静脉自控镇痛期间不良反应发生率明显低于C组(P<0.05)。结论:胸科手术患者采用盐酸右美托咪定0.075μg/kg.h联合舒芬太尼0.05μgkg.h进行术后静脉自控镇痛可以取得良好的术后镇痛效果。
[关键词]右美托咪定;胸科手术;术后镇痛
中图分类号:R614
文献标识码:A
文章编号:2095-5200(2019)02-066-04
DOI:10.11876/mimt201902017
胸外科手术主要包括肺部和食管的手术,手术常需要开胸进行,手术伤口大,术后疼痛剧烈。而胸外科手术患者多为老年患者,术前身体状态差,基础疾病多,常伴有高血压、冠心病、糖尿病、慢性支气管炎肺气肿等多种疾病"。良好的术后疼痛不仅能够减少患者围术期心脑血管等并发症的发生,而且能够促进患者术后早期呼吸功能的恢复,减少肺部并发症的发生,有利于患者术后早期下床及尽早拔出胸腔闭式引流管,促进患者早期康复。临床上常采用椎管内镇痛和静脉自控镇痛来抑制胸外科:手术术后疼痛,由于椎管内镇痛并发症的影响,静脉自控镇痛在临床中得到了广泛的使用。舒芬太尼是一种强效的阿片类镇痛药,是常用的静脉镇痛药物,具有起效快,镇痛作用强等优点。但术后大量使用舒芬太尼,也可能会抑制患者術后咳嗽,不利于患者肺部分泌物的排出同时还会引起恶心、呕吐等不良反应的发生。右美托咪定是一种选择性的a2受体激动剂,具有镇静、镇痛、抗焦虑及抗交感神经反应的作用。有研究表明右美托咪定可减少阿片类镇痛药的使用及其所产生的副作用的发生。因而本研究将探讨不同剂量的右美托咪定联合舒芬太尼对胸外科手术患者术后镇痛效果的影响,为患者术后镇痛提供参考。
1资料与方法
1.1一般资料
选择2016年2月至2018年2月在我院择期行胸外科手术的患者96例,ASAI-II级,48~60岁,根据术后镇痛泵用量不同随机分为3组,各32例,A组采用盐酸右美托咪定0.05μgkg.h+舒芬太尼0.05μg/kg.h+生理盐水共120mL行术后静脉自控镇痛;B组采用盐酸右美托咪定0.075μg/kg.h+舒芬太尼0.05μg/kg°h+生理盐水共120mL行术后静脉自控镇痛;C组采用盐酸右美托咪定0.1μg/kg.h+舒芬太尼0.05μg/kg.h+生理盐水共120mL术后静脉自控镇痛。排除有严重高血压、心功能不全、精神异常、肝肾功能异常、长期使用镇痛药、抗抑郁药物等患者。本研究经本院伦理委员会批准,且所有参加患者均知情同意。
1.2方法
所有患者术前禁食禁饮,开放外周静脉通道,常规监测生命体征(心电图、心率、无创动脉血压、脉搏血氧饱和度)。静脉输注咪达唑仑0.05mg/kg,丙泊酚2~3mg/kg,舒芬太尼0.5μg/kg,顺阿曲库铵0.2mg/kg,待肌肉完全松弛后快速行支气管内插管。术中以丙泊酚、瑞芬太尼、七氟烷吸人、顺阿曲库铵维持合适的麻醉深度。关胸前给予格拉司琼3mg静脉注射,预防恶心呕吐。两组患者手术结束缝皮后立即连接PCIA镇痛泵(参数设置为首次剂量2.5mL,背景剂量2mL.h,单次给药量2mL,锁定时间15min)。
3组患者手术均由同组外科医生进行,术中顺利,术后患者苏醒脱氧观察15min后生命体征平稳,拔出双腔支气管导管送胸外科监护室,术后常规吸氧及生命体征监测,如按压PCA装置后仍无法达到满意的效果,予以莫非氏管缓慢滴注100mg盐酸曲马多注射液进行补救镇痛,记录追加次数。
1.3观察指标
所有数据采集均由同一位麻醉医师负责但该医生不参加手术麻醉,统计3组患者围术期出血量、手术时间及苏醒期拔管时间;采用VAS评分量表评估患者术后4、8、12、24、48小时的疼痛评分;采用OAA/S评分量表评估患者术后的镇静情况记录患者术后48小时患者镇痛泵按压次数、额外使用补救镇痛药物情况;记录患者术后48小时内不良反应(恶心呕吐、头晕、呼吸抑制、皮肤瘙痒)的发生情况。0AA/S评分如下:5分:完全清醒;4分:意识清醒,一般反应减慢;3分:嗜睡,对大声或反复呼喊有反应;2分:昏睡,言语刺激物反应;1分:轻度刺激无反应。
1.4统计学方法
采用SPSS19.0统计学软件进行统计学分析,计量资料以均数土标准差(mean+SD)表示,采用t检验或方差分析,计数资料采用x2检验,P<0.05为差异有统计学意义。
2结果
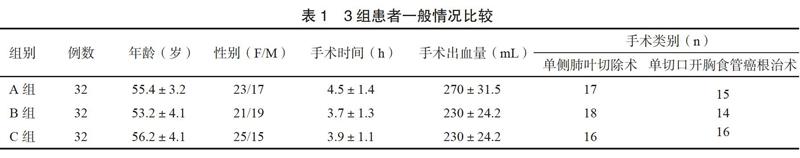
2.13组患者一般情况的比较
3组患者一般情况、手术时间、手术出血量及手术类别情况差异无统计学意义,P>0.05,见表1。2.23组患者术后疼痛评分情况的比较
B、C组患者术后4、8、12、24和48小时VAS疼痛评分均低于A组患者,差异有统计学意义(P<0.05),见表2。
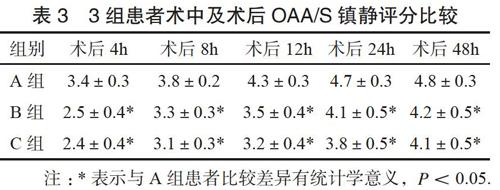
2.33组患者术中及术后镇静评分情况的比较
B、C两组患者术后OAA/S镇静评分优于A组患者,差异有统计学意义(P<0.05),见表3。
2.43组患者术后48小时内PCIA用药量及追加镇痛药次数的比较
B、C两组患者术后48小时内PCIA用药量及追加镇痛药次数均少于A组患者,且差异有统计学意义(P<0.05),见表4。
2.53组患者术后镇痛不良反应的发生情况
3组患者术后48小时内头晕和皮肤瘙痒的发生率差异没有统计学意义,P>0.05;A、B两组患者术后恶心呕吐及心动过缓的发生率显著低于C组患者,差异有统计学意义,P<0.05,见表5。
3讨论
胸外科手术术后剧烈的创伤疼痛会引起患者术后呼吸变弱变浅,不利于患者术后痰液的排出,进而诱发肺部炎症、高碳酸血症、肺不张等并发症的发生以。良好的术后镇痛不仅能够减少患者麻醉围术期心脑管并发症的发生,而且能够减少苏醒期的躁动,促进患者术后的早期康复。舒芬太尼是临床上常用的阿片类镇痛药物,其镇痛作用与剂量大小呈正相关。但随着用药剂量的增加,也增加了术后恶心、呕吐、呼吸抑制、嗜睡等副作用的发生率。如何获得良好的术后镇痛并减少相关副作用的发生率是目前臨床医生的关注重点。有研究表明采用右美托咪定联合用药可以大好良好的镇静镇痛效果。但有关不同剂量右美托咪定复合舒芬太尼用于术后镇痛的研究并不多见,因而本研究探讨了不同剂量右美托咪定联合舒芬太尼在胸外科手术患者术后的应用。
本研究结果表明,与低浓度右美托咪定(0.05μg/kg:h)相比,中浓度右美托咪定(0.075μg/kg.h)、高浓度右美托咪定(0.1μg/kg°h)联合舒芬太尼(0.05μg/kg°h)用于胸科手术术后镇痛能提供更好的镇静镇痛效果,且差异有统计学意义。右美托咪定是一种肾上腺素受体激动剂,通过抑制去甲肾上腺素的释放来抑制疼痛的传导,并能通过激动突触后膜的a2受体来抗交感神经作用并产生良好的镇静作用,大量研究表明右美托咪定的镇静、镇痛效果与剂量有关,随着药物剂量的增加,镇静镇痛效果具有“封顶效应”。本研究表明与中等浓度右美托咪定相比,高浓度右美托咪定联合舒芬太尼并不能为胸科手术患者提供更好的术后镇静镇痛效果,两组患者术后VAS及OAA/S评分、术后48小时内PCIA用药量及追加镇痛药次数的差异均没有统计意义;高浓度右美托咪定组患者术后恶心呕吐和心动过缓发生率明显高于中低浓度组患者。研究表明当右美托咪定镇静镇痛效果达“封顶效应”后,会增加不良反应发生率,尤其在术后24h以后患者的应激反应逐渐减弱,而大量的右美托咪定可增加患者的迷走神经反应,进而出现心动过缓,血压下降。本研究结果表明0.1μg/kg.h右美托咪定可能已接近或者已经超过“封顶效应”值,安全性较低。
综上所述,中等浓度右美托咪定(0.075μg/kg.h)联合舒芬太尼(0.05μg/kg°h)用于胸科手术术后镇痛在产生较好镇静镇痛效果的同时降低不良反应发生率,值得临床推广。
参考文献
[1] SOTO N, FAUBER AE, KO JC, et al. Analgesiceffext of intra-articularly administeredmorphin, dexmedetomidine, or a morphine-dexmedetomidinecombination immediately followingstifle joint surgery in dogs[J]. J Am Vet Med Assoc,2014,244(11):1291-1297.
[2] EL SHAMAA HA, IBBRAHIM M. A comparativestudy of the effect of caudal dexmedetomidine versusmorphine added to bupuvacaine inpediatric infra-umbilical surgery[J]. Saudi J Anaesth, 2014,8(2):155-160.
[3] NIE Y, LIU Y, LUO Q, et al. Effect of dexmedetomidinecombined with sufentanil for post-caesarean sectionintravenous analgesia: a randomised, placebo-controlledstudy.Eur J Anesthesiol, 2014, 31(4):2197-203.
[4] ALZABEN KR, QUDAISAT IY, ALGHANEM SM, etal. Intraoperative administration of dexmedetomidinereduces the anlgesic requirements for childrenundergoing hypospadius surgery[J]. Eur J Anaesthesiol,2010,27(3):247-252.
[5] SITILCI AT, OZYUVACLLI E, ALKAN Z, et al. Theeffect of perioperative infused dexmedetomidine onpostoperative analgesic consumption in mastoidctomyoperations[J]. Agri, 2010,22(3):109-116.
[6] WU CL, RAJA SN. Treatment of acute postoperativepain[J]. Lancet,2011,377(9784):2215-2225.
[7] KULO A, VANDEVELDE M, VANCALSTER ENK, et al. Pharmacokinetics of intravenous ketorolacfollowing caesarean delivery[J]. Int J Obstet Anesth,2012,21(4):334-338.
[8] ZENG Y, XIN M. Postoperative patient controlledintravenous analgesia with sufentanil in patients undergoing vertebral operation[J]. Chinese J New Drugs,2007,16(18):1523-1525.
[9] LIROLA T, IHMSEN H, LAITIO R, et al. Populationphar macokinetics of dex medetomidine during long-trem sedation in intensive care patients[J]. Br J Anaesth,2012,108(3):460-468.
[10] ALZABEN KR, QUDAISAT IY, ALGHANEM SM, etal. Intraoperative administration of dexmedetomidinereuces the analgesic requirements for children undergoing hypospadius surgery[J]. Eur J Anaesthiol,2010,27(3):247-252.
[11] SUN Q, ZHOU W, WU B, et al. Dezocine: a noveldrug to prevent fentanyl-induced cough during generalanesthesia induction[]. J Anesth, 2012,26(3):470.
[12] TSURUTA S, SATSUM T, MIZUTANI T, et al.Minimum alveolar concentrations of sevoflurane formaintaining bispectral index below 50 in children[J].Paediatr Anaesth, 201 1,21(11):1124-1127.
[13] SWATHI N, ASHWINI N, SHUKLA MI. Comparativestudy of epidural bupivacaine with butophanol andbupivacaine with tramodol for postoperative relifin abdominal surgeries[J]. Anesth Essays Res,2016:10(3):462-467.
[14] DONG CS, LU Y, ZHANG J, et al. The optimal dose ofdexmedetomidine added to an sufentanil-based analgesicregimen for postoperative pain control in spine surgery:a probit analysis study[J]. Medicine, 2016,95(39):4776.
[15] XIAO WM, HAN XC, et al. Clinical study ofdexmedetomidine used in anesthesia during percutaneousnerphrolithotomy[J]. China J Modern Medicine, 2011,21(36):4595.
[16] RAMSAY MA, NEWMAN KB, LEEPER B, et al.Dexmedetomidine infusion for analgesia up to 48 hoursagter lung surgery performed by lateral thoracotomy[J].Proceedings, 2014,27(1):3-10.
[17] HIROTSUGU K, TAKAYUKI K, ATSUSHI K, et al.Effect of dexmedetomidine on anesthetic requirementsin cardiovascular surgery[J]. Masui the Japanese Jouralof Anesthesiol, 2009,58(12):1496-1500.

