金花茶组植物花色与细胞内重要环境因子的关系
姜丽娜 李纪元 童冉 何丽波 张蕾 李志辉 黄晓娜

摘要: 为研究金花茶组植物花色与细胞内重要环境因子的关系,该研究以花色不同的8个金花茶组物种的9个居群为材料,测定了其花瓣的颜色、总黄酮含量、含水量、细胞pH、7种金属离子浓度。结果表明:所测金花茶组植物的花色平均明度L*为80.82、色相a*为-2.88、色相b*为53.97、彩度C*为54.10、色相角h为93.19°,故金花茶花色为明度较亮的黄色,其中色相b*为描述黄色的主要指标,据此可将所测植物分为金黄、黄、浅黄3类。花瓣总黄酮含量为20.17%,花瓣含水量为88.14%,物种间均达到差异显著,且均与花色呈弱相关,对黄色呈现影响较小。花瓣细胞偏弱酸性,pH平均值为6.19,不同物种间差异显著,细胞pH与花色呈显著正相关,即中偏弱酸性细胞环境有利于金花茶花瓣黃色的呈现。金属离子浓度中,K+含量最高(12.61 mg·g-1),其他依次为Ca2+(3.91 mg·g-1)、Mg2+(1.28 mg·g-1)、Al3+(0.98 mg·g-1)、Na+(0.17 mg·g-1)、Fe3+(0.07 mg·g-1),Cu2+含量最低(0.003 8 mg·g-1),7种金属离子在所测植物间均存在显著差异,其中Al3+、Fe3+和Ca2+对金花茶黄色花的形成具有不同程度的干扰作用,随着这3种金属离子浓度升高,黄度降低,花色变淡。因此,较低浓度的Al3+、Fe3+、Ca2+可能更有利于金花茶黄色花的呈现。
关键词: 金花茶, 花色, 总黄酮含量, 细胞pH, 金属离子浓度
中图分类号: Q945文献标识码: A文章编号: 1000-3142(2019)12-1605-08
作者简介: 姜丽娜(1989-),女,山东临沂人,博士研究生,主要从事园林植物育种研究,(E-mail)1562637702@qq.com。
Abstract: In order to study the relationship between the flower color and cellular environment in yellow Camellia, nine populations of eight yellow Camellia species with different petal colors in Chrysantha sect. of genus Camellia were used as experimental materials to measure their petal color, total flavonoids content, water content, cell pH as well as seven kinds of metal ion contents. The results showed that the average value of lightness L*, hue a*, hue b*, saturation C*, hue angle h was 80.82, -2.88, 53.97, 54.10, 93.19°, respectively, and the petal color of yellow Camellia was regarded as a kind of color of bright yellow in flowers, and the species could be divided into three categories in terms of hue b* value as the major index of measurement of yellow color, golden yellow, yellow and light yellow. The contents of total flavonoids and water in petals were 20.17% and 88.14% respectively. Both of them were significant among different species and not closely related to petal color, and thus they were not be regarded as the fatal factors in determining color of yellow Camellia. The pH in petal cells was 6.19 in average and significant among the species. But the pH in petal cells was found to be positively correlated with petal colors, which indicates that the slightly weak acidic environment may be helpful to phenotypic expression of yellow color in these Camellia flowers. The metal ion concentration of K+ was found to be the highest (12.61 mg·g-1), and then ranked by Ca2+(3.91 mg·g-1), Mg2+(1.28 mg·g-1), Al3+ (0.98 mg·g-1), Na+ (0.17 mg·g-1), Fe3+ (0.07 mg·g-1), the lowest value was Cu2+ (0.003 8 mg·g-1). There were significant differences for seven kinds of metal ions among these species. Besides the three kinds of Al3+, Fe3+ and Ca2+ interfere with petal colors to some extent, and it seems that the higher the concentration, the lighter the yellow color in high concentration. Therefore, low concentration of Al3+, Fe3+ and Ca2+ may be beneficial for the color appearance of yellow Camellia.
Key words: yellow Camellia, petal color, total flavonoids content, pH in cells, metal ion content
金花茶组(Sect. Chrysantha Chang)植物属于山茶科(Theaceae)山茶属(Camellia L.),为常绿灌木或小乔木,高可达5 m,花色金黄,形态美观(张宏达和任善湘,1998)。在山茶属中,黄花物种仅占7.14%,在国际山茶学会登录的近三万个茶花品种中,几乎全为红花类和白花类品种,黄花种类十分稀少和珍贵,具有极高的观赏价值及科学研究价值(Savige,1993,1997;Haydon,2011)。植物花色呈现在根本上是由于花瓣细胞中存在的特定呈色物质如类黄酮、类胡萝卜素、生物碱等,同时又受多种细胞内环境因子的影响,如pH值、金属离子等(Lapidot et al., 1999;Yoshida,2006)。滇山茶的花色与细胞环境内在关系曾有过研究(薛英利等,2015)。
前人多是对金花茶的营养价值进行测定,如总黄酮(黄永林等,2009;苏建睦等,2014)、总多酚(唐健民等,2017;苏建睦等,2014)、常量微量元素和營养成分(唐健民等,2017;林华娟等,2010)等,但其花色与细胞重要环境因子内在关系的系统研究尚未见报道。本研究首次综合性地对金花茶组部分植物的花瓣的颜色、总黄酮含量、含水量、细胞pH、重要金属离子浓度等进行了测定分析,以研究金花茶花色与花瓣细胞内重要环境因子的关系,为深入解析金花茶金黄花色形成的生理生化机制提供新的视角。
1材料与方法
1.1 试材及取样
2018年1月份,在广西南宁市金花茶公园(108°20′53″ E, 22°49′11″ N,海拔75 m)国家级金花茶种质资源库内,采集金花茶全开期的花瓣,冰袋保鲜保存,当天空运回实验室备用。从黄色表观形态上,选取金花茶组8个物种9个居群的3类如下,金黄类:金花茶凤凰山居群(Camellia nitidissima of Fenghuang Mountain population)、多瓣金花茶(C. multipetala)、金花茶防城居群(C. nitidissima of Fangcheng population);黄色类:潘氏金花茶(C. phanii)、箱田金花茶(C. hakodae)、毛瓣金花茶(C. pubipetala);浅黄类:中东金花茶(C. achrysantha)、东兴金花茶(C. tunghinensis)、凹脉金花茶(C. impressinervis)。潘氏金花茶和箱田金花茶系从越南引进,其余物种均为本地物种,树龄为20~30 a,长势旺盛,上层乔木为高大的松树和阔叶树,营造了一定的荫凉环境。肥水、病虫害管理等栽培措施一致。
1.2 研究方法
使用英国皇家园艺比色卡(RHS,英国)和色差计(NF555,日本)从外轮花瓣到内层花瓣依次测定其花色,每个种设6个生物学重复,取平均值。参照国际照明委员会(CIE)制定的CIE L*、a*、b*扩表色系法,测定花瓣的明度L*、色相a*和b*、彩度C*和色相角h(°)。通过比色卡定性和色差计三维坐标量化,对所测植物进行分类(Gonnet,1998,1999)。
参照杨树平等(2011)的方法,选取最优方法,测定花瓣总黄酮含量。以芦丁作为标准品,绘制标准曲线。求得回归方程为y = 9.6862x-0.0195,R2=0.995 3。新鲜金花茶花瓣研磨后,称取1.0 g,加提取液(65%的乙醇)10 mL,65 ℃浸提12 h,过滤得到提取液。吸1 mL提取液,进行显色反应后,用65%乙醇定容至10 mL。使用全波长酶标仪(Multiskan GO,美国)于510 nm处测定吸光度A。代入回归方程,计算总黄酮的浓度C(mg·mL-1)。
参照薛英利等(2015)的方法,稍加修改,测定花瓣细胞pH。取适量新鲜花瓣,剪成小片后立即放到洗净并干燥的研钵中,将其研磨成匀浆,立即用pH计(PHS-3C,上海),让匀浆包埋探头,测定其pH值。每个种设生物学重复3次,取平均值作为该种的pH。
参考食品安全国家标准GB 5009.3-2016,使用电热恒温鼓风干燥箱(DHG-914385-Ⅲ,上海)对金花茶花瓣中的含水量进行测定。
参考林业行业标准LY/T 1270-199,使用电感耦合等离子体质谱仪(NexION 300D,美国)、电感耦合等离子体光谱仪(ICP-OES 7400,美国)分别对金花茶花瓣内Na+、K+、Ca2+、Mg2+、Al3+、Fe3+、Cu2+的浓度进行测定。
1.3 数据分析
应用 Microsoft Office Excel 2007 进行数据分析及作图,用 SPSS-Statistics 17.0 对结果进行相关性等统计分析。
2结果与分析
2.1 金花茶组植物的花色特征
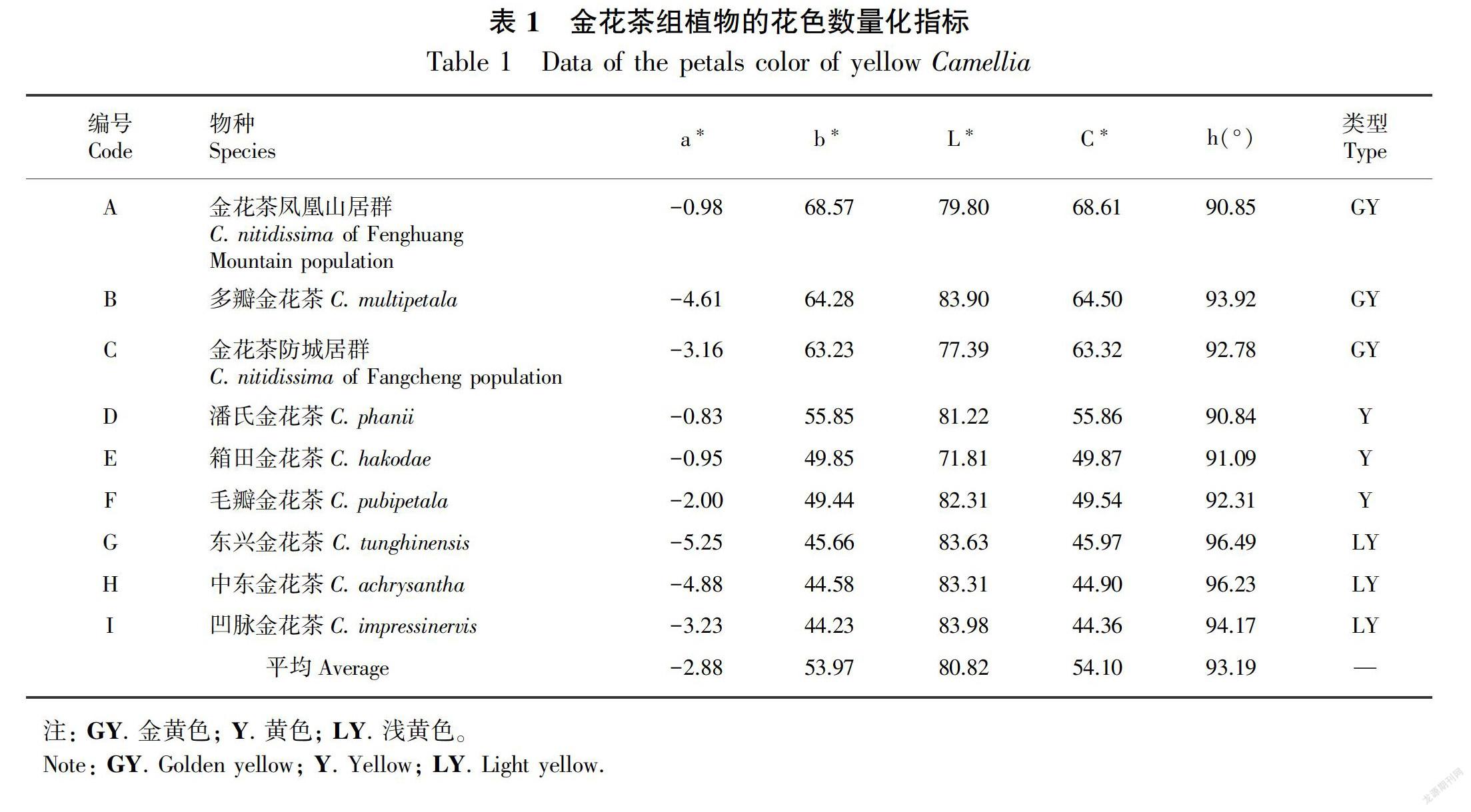
8个金花茶物种9个居群全开期(图1)花瓣比色卡测定介于GreenYellow 1-C至Yellow 9-A之间。色差计测量数据(表1),可知金花茶花色色相a*在0附近,介于红绿相交处,因物种而异;色相b*值在40~70之间(>0)为黄色,且较深;亮度L*值在70~90之间,花色较亮;彩度C*在40~70之间,花色为较鲜艳;色相角h在90°附近,为黄色。
进行相关性分析(表3)后发现,金花茶花色彩度C*与色相b*存在极显著正相关关系,故金花茶彩度主要受黄度的影响,即随黄度增加,花瓣鲜艳程度增加,色相b*是金花茶花色描述的主要指标。
按照色相a*、 b* 值坐标法,对所测植物进行分类,可分为3类:金花茶凤凰山居群、多瓣金花茶、金花茶防城居群为金黄色类型;潘氏金花茶、箱田金花茶、毛瓣金花茶为黄色类型;东兴金花茶、中东金花茶、凹脉金花茶为浅黄色类型,结果与表观形态观测结果一致(表1)。
2.2 金花茶组植物花瓣总黄酮含量与含水量变异
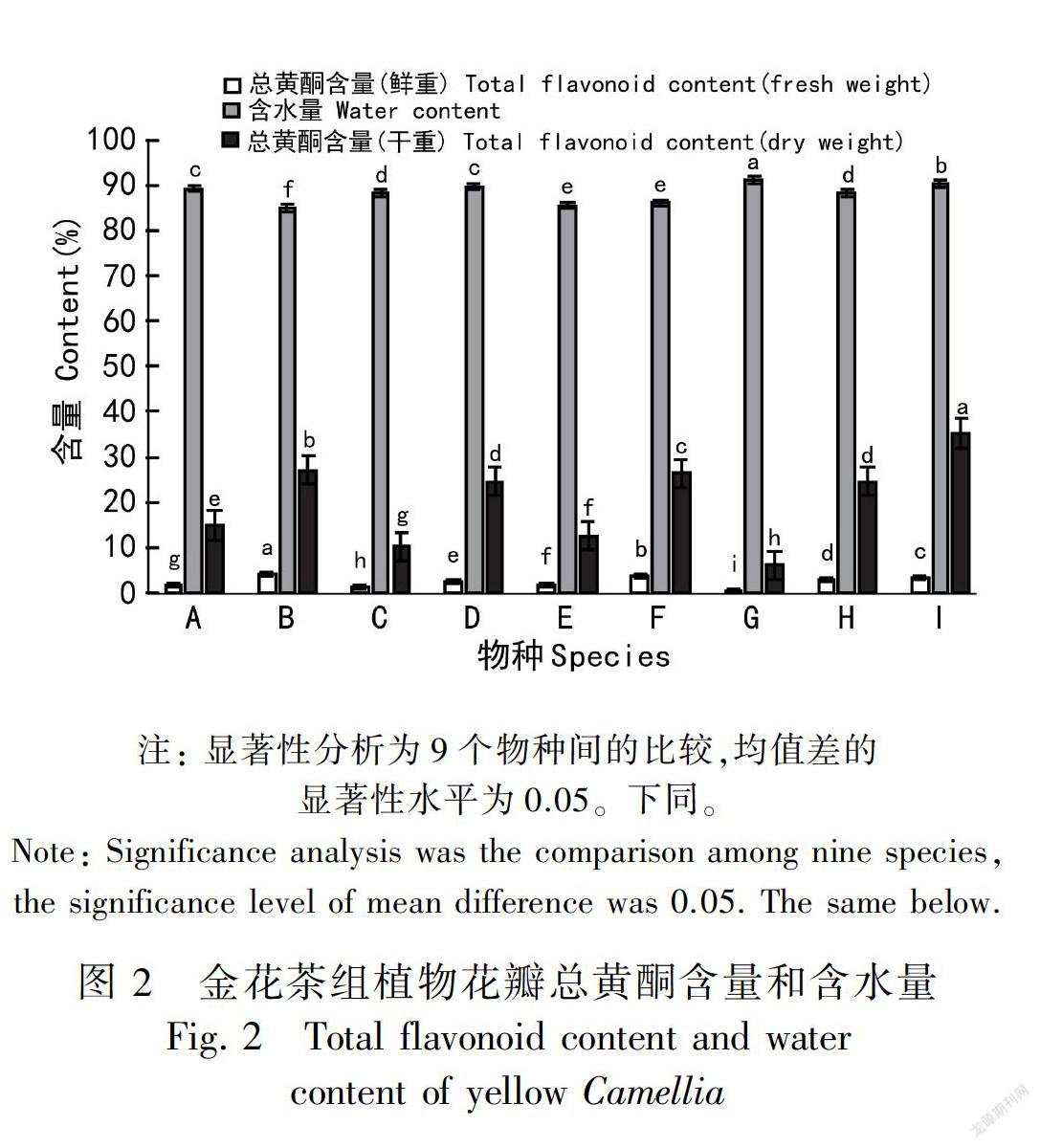
如图2所示,金花茶花瓣的总黄酮含量物种间差异极显著。多瓣金花茶最高(4.09%,鲜重),东兴金花茶最低(0.55%,鲜重),平均值为2.42%;干重时略有变化,凹脉金花茶最高(35.28%),东兴金花茶最低(6.09%),平均为20.17%,约为鲜重的8.3倍。所测植物的总黄酮含量由高至低为凹脉金花茶>多瓣金花茶>毛瓣金花茶>潘氏金茶花>中东金花茶>金花茶凤凰山居群>箱田金茶花>金花茶防城居群>东兴金花茶。
花瓣的含水量测定结果表明,东兴金花茶含水量最高(91.04%),多瓣金花茶含水量最低(84.89%),平均值为88.14%,金花茶花瓣含水量在早春仍处于较高水平,且不同物种间差异显著。
与金花茶黄色程度(色相b*)进行相关分析(表3)发现,花瓣的总黄酮含量(干重)(r=-0.222, P=0.566)、含水量(r=-0.241, P=0.532)均与花色呈弱负相关,即花瓣的总黄酮含量和含水量对花色差异影响较小。注: A. 金花茶凤凰山居群; B. 多瓣金花茶; C. 金花茶防城居群 ;D. 潘氏金花茶; E. 箱田金花茶; F. 毛瓣金花茶; G. 东兴金花茶; H. 中东金花茶; I. 凹脉金花茶。下同。
2.3 金花茶组植物花瓣细胞pH分析
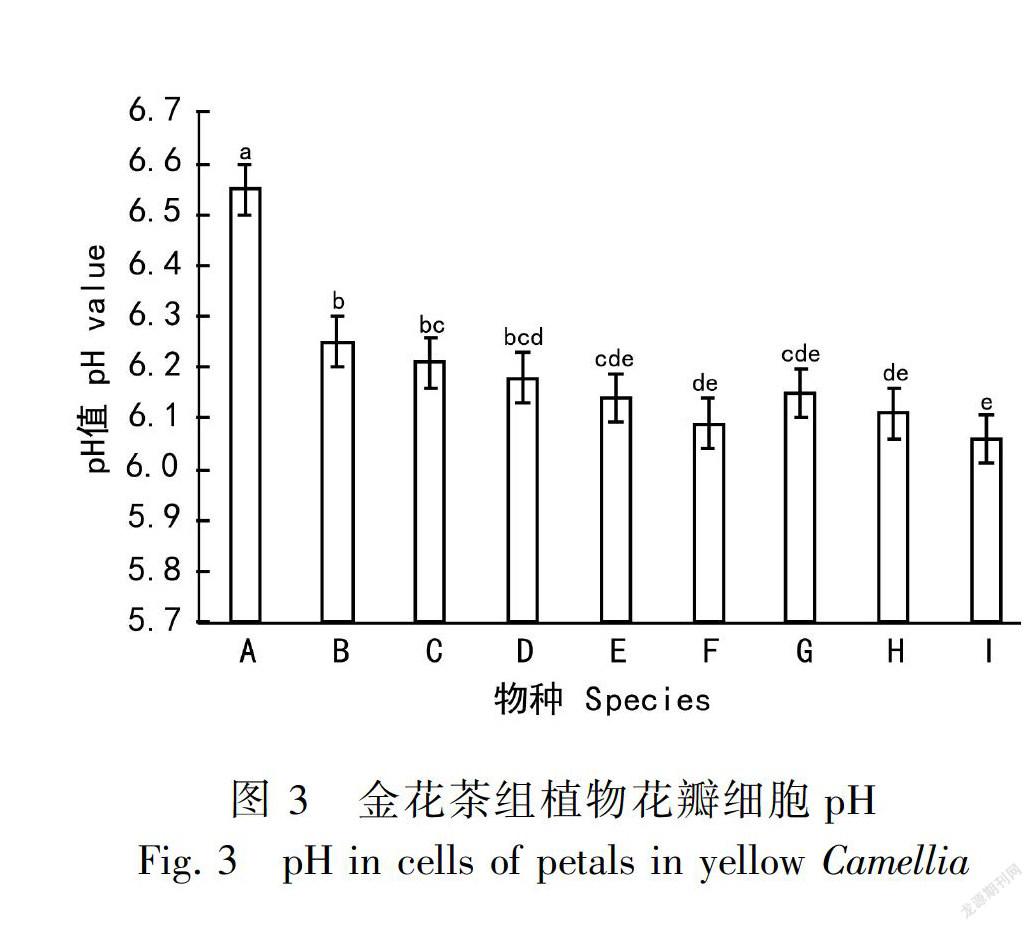
金花茶凤凰山居群花瓣细胞液pH值接近中性(6.55),东兴金花茶pH值处于中偏弱酸性(6.06),所测植物的pH平均值为6.19,中偏弱酸性。各物种花瓣细胞pH值的种间差异明显(图3)。与金花茶黄色程度(色相b*)进行相关分析(表3)发现,细胞pH对花色的影响显著,细胞pH与花色呈正相关(r=0.819, P=0.007),即pH越大,即越接近中性,花瓣颜色越黄,随着酸性增强,黄色变浅,黄度也随着下降。
2.4 金花茶组植物花瓣金属离子浓度
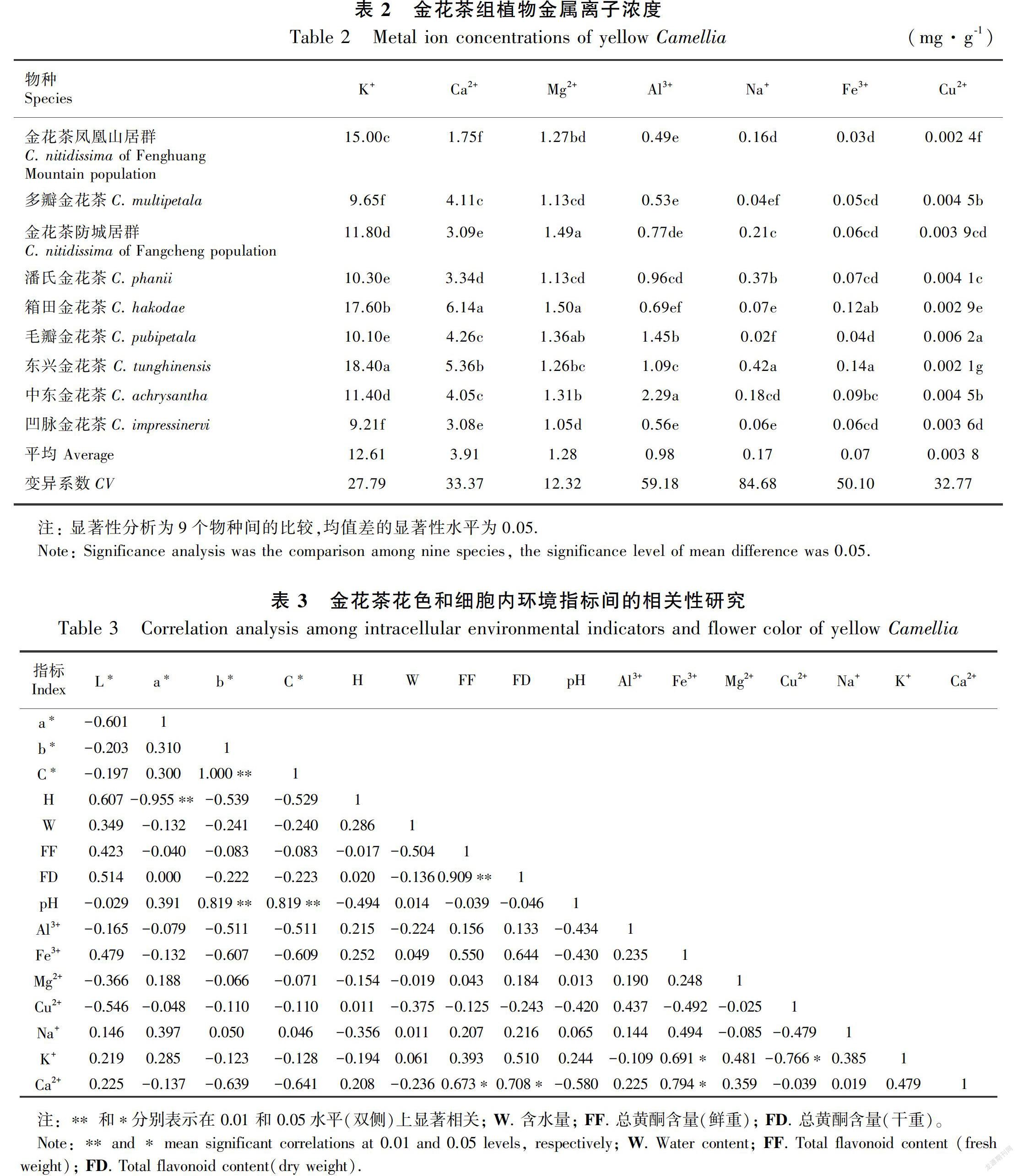
金花茶物种7种金属离子浓度如表2所示,在金花茶花瓣中,K+含量最高,为9.21~18.40 mg·g-1,平均为12.61 mg·g-1,是其他6種离子浓度总和的1.97倍。其次为Ca2+,含量为1.75~6.14 mg·g-1,平均为3.91 mg·g-1。第三为Mg2+,含量为1.05~1.50 mg·g-1,平均为1.28 mg·g-1。其他4种金属离子浓度较低,依次为Al3+(0.49~2.29 mg·g-1,平均为0.98 mg·g-1)、Na+(0.02~0.42 mg·g-1,平均为0.17 mg·g-1)、 Fe3+(0.03~0.14 mg·g-1,平均为0.07 mg·g-1),Cu2+含量则最低,在0.002 1~0.006 2 mg·g-1之间,平均为0.003 8 mg·g-1。所测的7种金属离子浓度在所测植物间均差异显著。
与金花茶黄色程度(色相b*)进行相关分析(表3)发现,7种金属离子对黄色的影响较复杂,Al3+(r=-0.511)、Fe3+(r=-0.607)、Ca2+(r=-0.639)浓度与花色呈负相关,即随Al3+、Fe3+、Ca2+浓度的升高,金花茶组植物花瓣的黄色变浅;浓度下降,花瓣黄色反而加深。K+、Mg2+、Na+、Cu2+浓度与黄色深浅仅呈现极弱相关性。
2.5 花色相关性分析
进行逐步回归分析,在0.05的显著水平下,逐个淘汰不显著的自变量,选出偏回归系数达到显著或极显著水平的因子,建立花色(色相b*)的回归方程如下:b*=-270.291+52.356x1,R=0.819,P=0.007 (x1: 细胞pH)。可知花色(色相b*)的逐步回归方程中,只保留了细胞pH 1个因子,其余因子全部被剔除。
3讨论与结论
3.1 花瓣总黄酮含量对金花茶花色的影响
金花茶组植物花瓣总黄酮含量与花瓣颜色(色相b*)之间仅呈现弱相关性,未达显著水平,与前人多项报道研究结果一致。黄永林等(2009)曾测定了5种金花茶花瓣鲜重总黄酮含量,花色金黄的金花茶、显脉金花茶分别为0.64%、0.50%,而花色浅黄的凹脉金花茶和毛瓣金花茶为0.86%和2.70%,花色更淡的平果金花茶为0.72%,虽然总黄酮含量数据略低于本研究,但也未呈现明显的相关性。苏建睦等(2014)也测定了3种金花茶花瓣干重总黄酮含量,其中金黄花色的金花茶为4.80%、浅黄花色的毛瓣金花茶和中东金花茶为13.78%和6.12%,其总黄酮含量略高于本实验结果,但与花色的相关性也不显著。
植物黄色花呈现主要与类黄酮中的黄色色素相关,总黄酮物质中还含有无色物质,如表儿茶素、儿茶素等,这些物质的相对含量在不同程度上对黄色呈现造成了干扰(Tanaka et al., 2010)。不过不同显色物质的构成及相对比例是如何决定黄色呈现的还需做更精细的研究。花瓣含水量对金花茶的花色呈现极弱的相关,这可能与所测植物花瓣均含有较高水分有关,满足了全部可溶性黄酮成分的饱和溶解条件,另外也可能溶解了大量可溶性糖类,对黄色形成了一定的干扰,这在红花类滇山茶(Camellia reticulata)研究中得到证实(薛英利等,2015)。本实验中也发现,金黄花色的金花茶凤凰山居群、金花茶防城居群等虽然花瓣金黄,但花瓣研磨粉末和花瓣提取液颜色较浅,故推测其花瓣内无色、白色的其他成分物质含量较高,因此降低了花瓣总黄酮的含量,这些都还需要进一步研究证明。
3.2 花瓣细胞pH对金花茶花色的影响
本研究发现,金花茶花瓣细胞pH在6.06~6.55之间,为弱酸性,但其花色为黄色,且pH越大,越接近中性,花色越黄。这也为黄色花细胞pH的研究打下了基础,中性偏酸的环境可能为黄色色素提供了稳定存在的环境,从而利于黄色花的显现。
在各个影响植物花色呈现的因子中,细胞pH对呈色物质如类黄酮、类胡萝卜素等的影响最大,植物细胞pH会使花色素的存在形式发生改变,从而改变花色。通常情况下,红色花的pH较蓝色花要低,pH为酸性时,花朵呈现红色。在19个滇山茶的研究中发现,红色花山茶的细胞pH在3.6~4.0之间(薛英利等,2015)明显比黄色花的金花茶要低,深红色月季花瓣中液泡的 pH 值也在4左右(Tanaka et al., 2010)。蓝色花的矮牵牛(Petunia hybrida)细胞pH增加会使花色的蓝色加深(Yoshida et al., 2009)。对于既有红色花,又有蓝色花的绣球花(Hydrangea macrophylla)中,红色花的细胞pH比蓝色花要低0.8左右(Ito et al., 2009)。也有研究认为,强酸性环境中植物花色苷呈红色,碱性环境中呈蓝色,而在弱酸性至中性的环境中呈红紫色(Faraco et al., 2009)。综合分析,可发现pH在不同物种间存在较大差异,不过同一物种中,pH的变化幅度并不大,但其对花色的影响却十分显著。
3.3 花瓣金属离子浓度对金花茶花色的影响
在金花茶花瓣中,K+浓度虽较高,但对金花茶花色形成的影响并不显著;Mg2+浓度在不同物种间差异较小,且与花色相关性也不显著,对黄色花的影响较弱;Cu2+与Na+浓度较低,与花色形成也无太大关联;Al3+、Fe3+和Ca2+则对金花茶黄色花色的形成具有不同程度的抑制作用,随着3种金属离子浓度升高,金花茶花色減弱,黄度降低,即低浓度时Al3+、Fe3+、Ca2+更利于金花茶黄色的呈现。
金属离子对花色的影响,主要通过与黄酮类等成分的络合而发挥作用,使花色素稳定性增强。在蓝色花的研究中发现,Al3+、Mg2+、Fe3+等均可与植物类黄酮物质络合形成蓝色复合物,如蓝色的鸭跖草苷是一种Mg2+与翠雀草素等形成的花色苷复合物(Hayashi et al., 1958),蓝花的矢车菊(Centaurea cyanus)形成原因是矢车菊素-3-5-葡萄糖苷与Fe3+络合,并与黄酮醇一起形成了蓝色的共色复合体(Takeda & Tominaga,1983);蓝色的绣球花(Hydrangea macrophylla)则是Al3+与翠雀草素糖苷和5-咖啡酰喹宁酸构成了复合的蓝色素(Ito et al., 2009)。红色系品种的菊花(Chrysanthemum morifolium)中发现Fe3+、Mg2+、Al3+、Ca2+对花青素有增色作用,对白色系品种黄酮类化合物无明显影响(白新祥,2007)。黄色花的非洲菊(Gerbera hybrid)的研究中发现,Fe2+和Ca2+对花色的影响显著,而Mg2+的影响并不显著(Razieh et al., 2013)。另外,从紫色花变到蓝色花的野生型牵牛花(Ipomoea tricolor)是在开花前Na+和K+反向转运体蛋白的作用使液泡内pH升高导致的(Verweij et al., 2008)。可见,同一种金属离子对不同物种、不同色系、或同一物种的不同色系的影响并不相同。因此,金花茶内金属离子与黄酮类物质的不同络合机制也需作更深入的研究。
参考文献:
BAI XX, 2007. Phenotype analysis of flower coloration of Chrysanthemum × morifolium Ramat [D]. Beijing: Beijing Forestry University: 86-92. [白新祥, 2007. 菊花花色形成的表型分析 [D]. 北京:北京林业大学: 86-92.]
CHANG HT, REN SX, 1998. Flora of China [M]. Beijing: Science Press, 49(3). [张宏达, 任善湘, 1998. 中国植物志 [M]. 北京: 科学出版社, 49(3).]
FARACO M, SPELT C, BLIEK M, et al., 2014. Hyperacidification of vacuoles by the combined action of two different P-ATPases in the tonoplast determines flower color [J]. Cell Rep, 6(1): 32-43.
GONNET JF, 1998. Colour effects of co-pigmentation of anthocyanins revisited-1. A colorimetric definition using the CIELAB scale [J]. Food Chem, 63(3): 409-415.
GONNET JF, 1999. Colour effects of co-pigmentation of anthocyanins revisited-2. A colorimetric look at the solutions of cyanin co-pigmented byrutin using the CIELAB scale [J]. Food Chem, 66 (3) : 387-394.
HAYASHI K, ABE Y, MITSUI S, 1958. Blue anthocyanin from the flowers of Commelina, the crystallization and some properties thereof [J]. Proc Jpn Acad, 34: 373-378.
HAYDON N, 2011. The international Camellia register [M]. Second supplement, 1990-2010, INT CAME SCI. Wimborne Dorset, U. K: The Minster Press: 1-472.
HUANG YL, WEN YX, LIU JL, et al., 2009. Determination of total flavonoids in 5 kinds of yellow Camellia [J]. Chin J Med Sci Technol, 16(1): 38-39. [黄永林, 文永新, 刘金磊, 等, 2009. 5种金花茶中总黄酮含量的测定 [J]. 中国中医药科技, 16(1): 38-39.]
ITO D, SHINKAI Y, KATO Y, et al., 2009. Chemical studies on different color development in blue-and red-colored sepal cells of Hydrangea macrophylla [J]. Biosci Biotechnol Biochem, 73(5): 1054-1059.
LAPIDOT T, HAREL S, AKIRI B, et al., 1999. pH-dependent forms of red wine anthocyanins as antioxidants [J]. J Agric Food Chem, 47(1): 67-70.
LIN HJ, QIN XM, ZENG QW, et al., 2010. Analysis on chemical and bioactive components in flower of Camellia chrysantha (Hu) Tuyama [J]. Food Sci Technol, 35(10): 89-91. [林華娟, 秦小明, 曾秋文, 等, 2010. 金花茶茶花的化学成分及生理活性成分分析 [J]. 食品科技,35(10): 89-91.]
RAZIEH A, ABODOLLAH H, REYHANEH S, et al., 2013. Analysis of petal pH and metal ions to investigate the mechanism of colour development in Gerbera hybrid [J]. AJCS, 7(7):941-947.
SAVIGE T, 1993. The international Camellia register [M]. Vol. 1. INT CAME SCI. NSW,Australia: Fine Arts Press PTY: 1-1104.
SAVIGE T, 1997. The international Camellia register [M]. Supplement to Vol. one and two, INT CAMESCI.Sydney, Australia: Fine Arts Press PTY: 1-386.
SU JM, WANG XM, MU ZZ, et al., 2014. Determination and analysis the content of tea polyphenols and total flavonoids in flower of three Camellia chrysantha [J]. J Yulin Norm Univ, 35(5): 64-68. [苏建睦, 王小敏, 莫昭展, 等, 2014. 金花茶茶花中茶多酚和总黄酮含量分析 [J]. 玉林师范学院学报, 35(5): 64-68.]
TAKEDA K, TOMINAGA S, 1983. The anthocyanin in blue flowers of Centaurea cyanus [J]. J Plant Res, 96 (4): 359-363.
TANAKA Y, BRUGLIERA F, KALC G, et al., 2010. Flower color modification by engineering of the flavonoid biosynthetic pathway: Practical perspectives [J]. Biosci Biotechnol Biochem, 74(9): 1760-1769.
TANG JM, SHI YC, LIAO YQ, et al., 2017. Analysis of chemical components in flowers of Camellia nitidissima [J]. Guihaia, 37 (9):1176-1181. [唐健民, 史艳财, 廖玉琼, 等, 2017. 金花茶茶花的营养成分分析 [J]. 广西植物, 37(9): 1176-1181.]
VERWEIJ W, SPELT C, DI SANSEBASTIANO GP, et al., 2008. A novel type of tonoplast localized H+-ATPase is required for vacuolar acidification and coloration of flowers and seeds [J]. Nat Cell Biol, 10: 1456-1462.
XUE YL, ZHAO QS, HUANG YA, et al., 2015. Research on relationship between flower colors and intracellular environment of Camellia reticulata Lindl. [J]. J Yunnan Agric Univ (Nat Sci Ed), 30(3): 455-463. [薛英利, 赵庆师, 黄由安, 等, 2015. 滇山茶的花色类型与细胞内环境关系初探 [J]. 云南农业大学学报(自然科学版), 30(3): 455-463.]
YANG SP, HAN LJ, LIU LP, et al., 2011. Optimization of extraction process for total flavonoids from flowers of Rosa xanthina Lindle [J]. Food Chem, 32 (24): 111-113. [杨树平, 韩立军, 刘乐鹏, 等, 2011. 野生黄刺玫花总黄酮的提取工艺优化 [J]. 食品科学, 32 (24): 111-113.]
YOSHIDA K, KITAHARA S, ITO D, et al., 2006. Ferric ions involved in the flower color development of the Himalayan blue poppy, Meconopsis grandis [J]. Phytochemistry, 67(10): 992-998.
YOSHIDA K, MIKI N, MOMONOI K, et al., 2009. Synchrony between flower opening and petal-color change from red to blue in morning glory, Ipomoea tricolor cv. heavenly Blue [J]. Proc Jpn Acad B, 85(6): 187-197.
ZHOU XW, 2012. Clonging and function reasearch of pigment genes from Camallia nitidissma [D]. Beijing: Chinese Academy of Forestry Sciences: 39-58. [周兴文, 2012. 金花茶花色相關基因的克隆及其功能验证 [D]. 北京: 中国林业科学研究院: 39-58.]

