加速溶剂萃取/超高效液相色谱-荧光法检测鸽蛋和鹤鹑蛋中氟苯尼考和氟苯尼考胺残留
刁志祥 王波 张培杨 王旭堂 谢恺舟 赵霞
摘要:【目的】建立鸽蛋和鹤鹑蛋中尼考(florfenicol,FF)及其主要代谢产物氟苯尼考胺(florfenicol amine,FFA)残留检测的加速溶剂萃取/超高效液相色谱-荧光检测(ASE/UPLC-FLD)法,为动物源性食品中FF和FFA残留检测提供新的安全可靠的方法。【方法】采用加速溶剂萃取(ASE)法,用乙腈:氨水(98:2,V/V)为提取剂萃取样品,用乙腈饱和的正己烷去脂进行纯化,使用由0.005mol·L-1NaH2PO4,0.003mol·L-1十二烷基硫酸钠和0.05%三甲胺组成的流动相供UPLC-FLD检测。【结果】鸽蛋和鹌鹑蛋中FF和FFA在定量限(LOQ)~400μg·kg-1范围内,目标物的峰面积与其浓度均呈现良好的线性关系,相关系数(R2)均大于0.9992。样品在LOQ、50.0、100.0、200.0μg·kg-1的加标水平下的平均回收率为84.69%~98.04%,相对标准偏差(RSD)均低于3.7%。鸽蛋中FF的检测限(LOD)和LOQ为4.8μg·kg-1和11.2μg·kg-1,FFA的LOD和LOQ为1.9μg·kg-1和4.8μg·kg-1;鹌鹑蛋中FF的LOD和LOQ为4.7μg·kg-1和10.6μg·kg-1,FFA的LOD和LOQ为1.8μg·kg-1,和4.6μg·kg-1。【结论】该方法快速、簡单、灵敏度高,适合禽蛋中FF及其代谢产物FFA的检测。
关键词:鸽蛋;鹤鹑蛋;氟苯尼考;氟苯尼考胺;加速溶剂萃取;超高效液相色谱-荧光法
中图分类号:S859.79+6 文献标志码:A 文章编号:1008-0384(2019)11-1315-08
0 引言
【研究意义】氟苯尼考(florfenicol,FF)是甲矾霉素和氯霉素的氟化类似物,是抗生素类药物家族中具有广泛抗菌谱的新型半合成成员,对众多革兰氏阳性、阴性菌和支原体等具有显著的抑制效果,且有着抗菌活性强、廉价高效等优点,被广泛用于水产养殖业和畜牧业的疾病治疗中[1]。欧盟规定FF药物在禽蛋中的最高残留限量(Maximumresidue limit,MRL)为100μg·kg-1[2]。禽蛋作为来源最广、蛋白质含量较高的动物性食品,人们对其日常需求量非常大,近年来随着生活水平的提高,鸽蛋和鹌鹑蛋也渐渐走上餐桌,占据禽蛋市场不小的份额,而许多不法养殖者为了提高经济效益,将FF等药物不合理使用,以致FF及其主要代谢产物氟苯尼考胺(florfenicol amine,FFA)过量残留在鸽蛋和鹌鹑蛋中,增加了消费者患再生障碍性贫血和耐药性细菌产生的潜在风险,严重威胁消费者的健康[3-4]。因此建立鸽蛋和鹤鹑蛋中FF和FFA残留的检测方法对于保障消费者身体健康和进出口贸易顺利进行具有重要的实际意义。【前人研究进展】目前,国内外对FF及FFA残留检测的方法主要包括:酶联免疫法(ELISA)[5-6]、液相色谱法(LC)[7-8]、液质联用法(LC-MS/MS)[9-12]和气质联用法(GC-MS/MS)[13-14]等,有的方法[9,12]只检测FF一种药物,而FFA作为FF的标志性残留物,欧盟规定FF的残留量以其自身和FFA的总量计;虽然液一液提取法不需要复杂的提取设备,仪器成本低,但其操作过程繁琐,耗时费力且误差较大,浪费大量的有机溶剂,同时对实验人员身体健康有一定的损害。加速溶剂萃取(ASE)在高温高压条件下减小了目标物和样品基质之间的相互作用力,实现了提取剂与目标物更好的接触,提高萃取效率,因此ASE法具有快速全自动、回收率高、溶剂使用量小、重现性好、可批量处理样品等优点,故本试验采用ASE提取法进行样品前处理[15]。使用最多的检测方法就是质谱法(MS)[10],MS虽然定性定量准确,灵敏度高,但仪器价格昂贵,检测成本高;在满足检测要求的前提下开发新的、低成本检测方法十分必要。【本研究切入点】综合国内外研究,目前采用加速溶剂萃取结合超高效液相色谱一荧光检测法(ASE/UPLC-FLD)对鸽蛋和鹤鹑蛋中FF和FFA残留同时检测的方法尚未见报道,且我国也尚未建立蛋品中同时检测FF和FFA残留的国家标准检测方法。【拟解决的关键问题】本试验采用ASE法提取样品,再用乙腈饱和的正己烷去脂,以乙腈:氨水(98:2,VN)为提取剂,建立鸽蛋、鹤鹑蛋中FF和 FFA残留检测的UPLC-FLD法,为鹤鹑蛋和鸽蛋中FF和FFA残留检测提供新的检测方法、技术手段和科学依据。
1 材料与方法
1.1 试验材料
1.1.1 试验样品 试验样品为35周龄产蛋家鸽50只(江苏江南鸽业有限公司)和20周龄产蛋鹤鹑30只(兴化市安丰镇鹤鹑养殖有限公司),试验前预饲2周不添加任何药物的全价饲料,每天取蛋放入低温蛋库中,最后将全蛋匀浆后分装保存于-34℃冰箱中备用。
1.1.2 仪器及试剂 Acquity UPLC超高效液相色谱仪(配有荧光检测器,Waters公司);ASE350型加速溶剂萃取仪(Thermo Fisher公司);58108型高速冷冻离心机(Eppendof公司);离心浓缩仪(LaboGene公司);Mettler Toledo FE20型pH计(梅特勒一托利多仪器有限公司)。
FF标准品(纯度≥99.0%,Dr.Ehrenstorfer GmbH有限公司);FFA标准品(纯度>99.8%,WITEGALaboratorien Berlin-Adlershof GmbH有限公司;乙腈、三乙胺均为色谱纯;磷酸二氢钠、磷酸、己烷、氨水、十二烷基硫酸钠等均为分析纯;试验用水为超纯水。
1.2 试验方法
1.2.1 标准溶液的配制 FF标准溶液配制:准确称取FF标准品4.04mg(因纯度≥99.0%,故实际FF含量为4.00mg),用乙腈定容至10mL,配制成400.0mg·L-1的FF标准溶液。FFA标准溶液配制:准确称取FFA标准品1.01mg(纯度>99.8%,故实际FFA含量为1.00mg),先用1mL超纯水溶解后用乙腈定容至10mL,配制成100.0mg·L-1的FFA标准溶液。
1.2.2 样品的提取与净化 准确称取鸽蛋和鹤鹑蛋空白样品(2.0±0.02)g放入适量硅藻土中,研磨混合均匀后装入萃取池中进行加速溶剂萃取,使用的萃取剂为乙腈:氨水(98:2,V/V),萃取压力为1500psi,80℃下萃取3min,萃取剂的用量控制在萃取池体积的40%左右,样品间自动冲洗1次,氮气吹扫60s并静态循环2次。使用离心浓缩仪将收集的萃取液浓缩近干,分别向其中加入1mL乙腈涡旋震荡溶解残渣,再加入8mL乙腈饱和的正己烷去脂,再次浓缩至干备用。用2.0mL流动相将浓缩干后的样品复溶并涡旋1min,12100g转速下离心15min后过0.22μm聚偏氟乙烯针式滤器,滤液供UPLC-FLD系统检测。
1.2.3 超高效液相色谱条件 色谱柱为AcquityUPLC?BEH C18柱(2.1mm×100mm,1.7μm);流动相A:超纯水(含0.005mol·L-1NaH-1PO4溶液,0.05%的三乙胺和0.003mol·L-1十二烷基硫酸钠,用85%H3PO4调pH至5.3±0.1);流动相B:乙腈;洗脱方式:流動相A:B=64:36等度洗脱;荧光检测器的激发波长与发射波长分别为233nm和284nm;流速:0.2mL·min-1;进样体积:10μL;柱温:30℃。
1.2.4 标准曲线的绘制 取适量鸽蛋和鹤鹑蛋空白样品按1.2.2的方法处理并添加一定浓度的FF和FFA标准工作液,使得对应鸽蛋和鹌鹑蛋基质中FF的添加质量比为LOQ、20.0、50.0、100.0、200.0、300.0、400.0μg·kg-1,FFA的添加质量比为LOQ、10.0、20.0、50.0、100.0、200.0、400.0μg·kg-1,再将各浓度样品通过UPLC-FLD系统检测并绘制出标准曲线。
1.2.5 样品回收率测定 准确称取匀浆好的鸽蛋和鹤鹑蛋空白样品(2.0±0.02)g,与适量硅藻土混合研磨均匀,加入FF和FFA标准工作液使得对应鸽蛋基质中FF的添加质量比为11.2、50.0、100.0、200.0μg·kg-1,FFA的添加质量比为4.8、50.0、100.0、200.0μg·kg-1;对应鹤鹑蛋基质中FF的添加质量比为10.6、50.0、100.0、200.0μg·kg-1,FFA的添加质量比为4.6、50.0、100.0、200.0μg·kg-1,每个添加水平设置6个平行,搅拌混匀填入萃取池,经萃取净化后供UPLC-FLD检测,最后代入标准曲线中求得浓度,并计算样品回收率。
1.2.6 精密度测定 精密度可用来表示测量方法的再现性,是试验准确性的重要参数之一。在同一天内进行6次重复测定,求出日内RSD;在不同天重复进行试验,求出日间RSD。
1.2.7 检测限和定量限测定 在本试验建立的方法条件下,取空白样品进行添加回收分析试验,每个浓度分析3次,当信噪比值大于等于3(S/N≥3)时所对应的添加浓度即为分析方法的检测限(limit ofdetection,LOD);当信噪比值大于等于10(S/N≥10)时所对应的添加浓度即为分析方法的定量限(limit of quantitation,LOQ)。
2 结果与分析
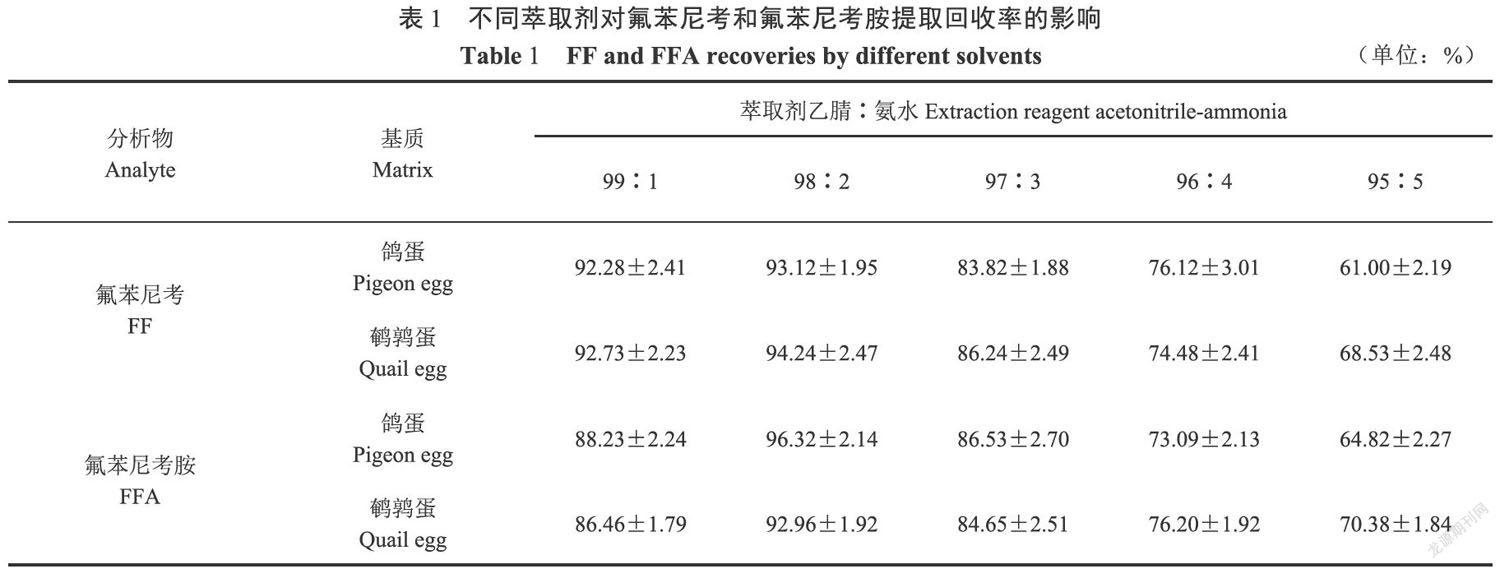
2.1 不同萃取剂提取FF和FFA的回收率
本试验对鸽蛋和鹤鹑蛋样品基质中不同比例氨水氨化的乙腈(99:1,98:2,97:3,96:4,95:5)对目标物提取效果进行对比,其结果见表1。表明萃取剂乙腈:氨水(98:2,V/V)时提取效果最好,两种目标药物回收率均大于92.00%。
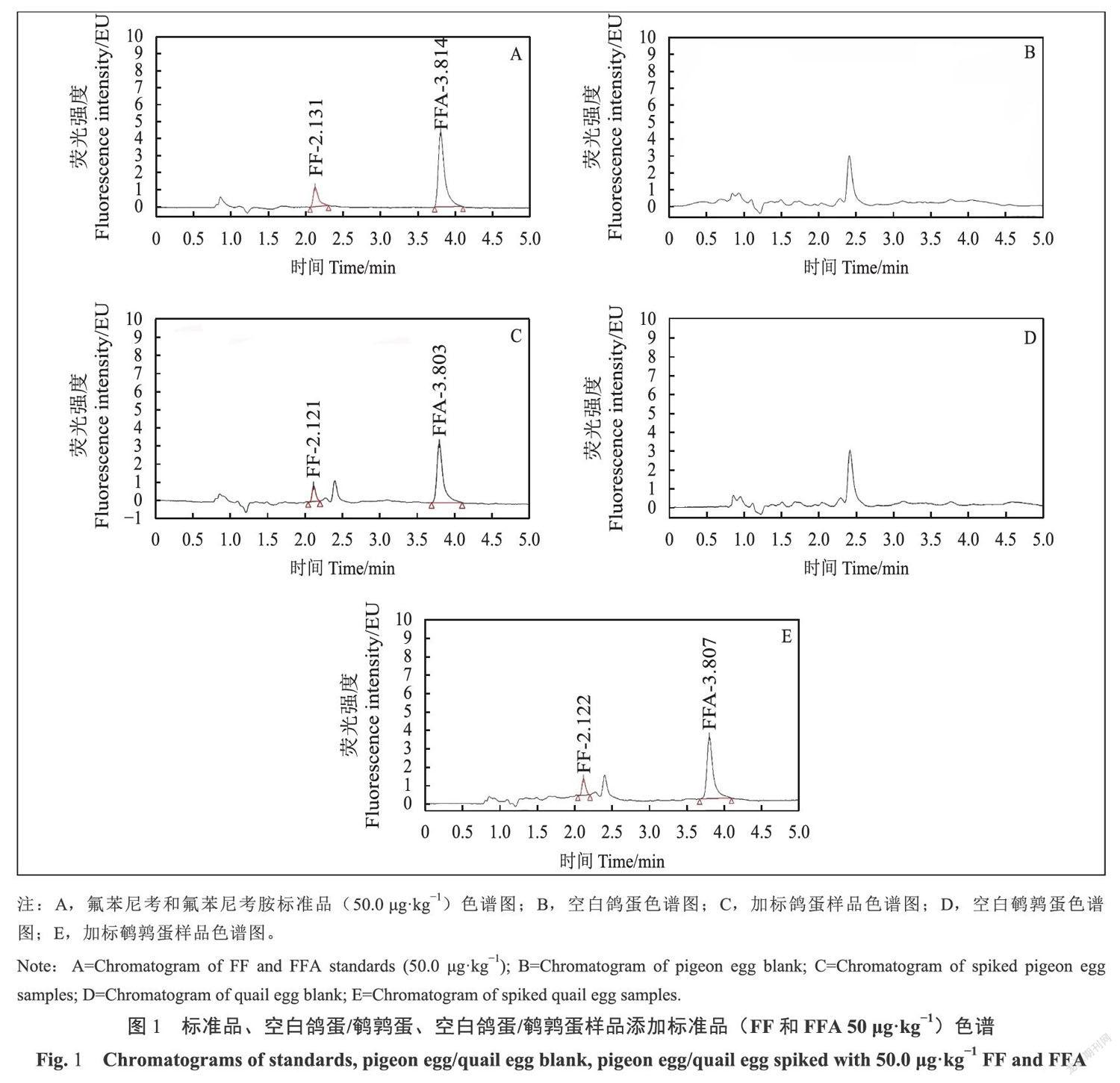
2.2 色谱图
如图1A-E所示,在UPLC-FLD检测条件下,目标物FF和FFA在鸽蛋和鹤鹑蛋样品基质中均与杂质分离,峰形较好,出峰时间分别在2.1min和3.8min左右,无干扰杂峰。
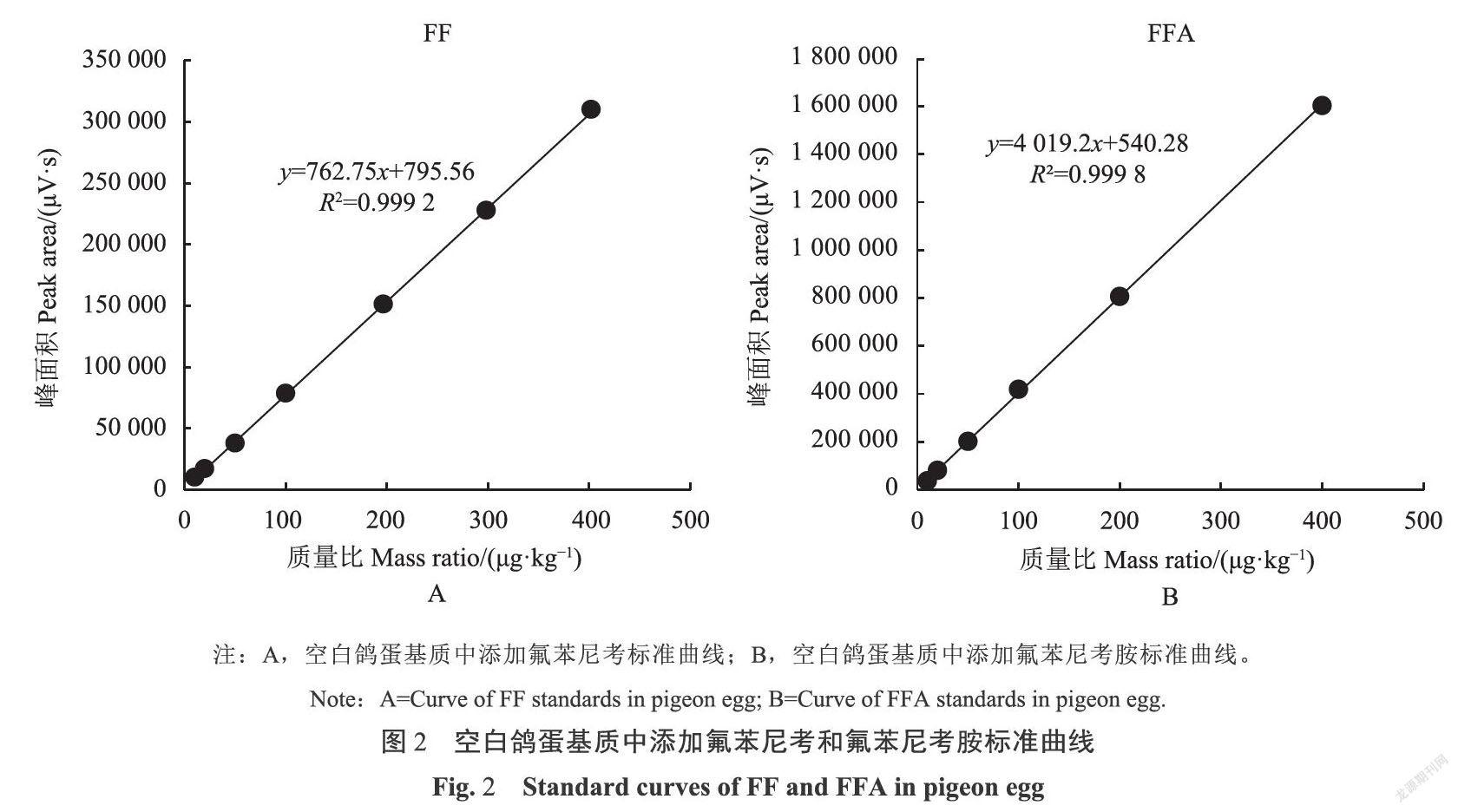
2.3 标准曲线、检测限、定量限的确定
如图2和图3可得,在空白鸽蛋样品中,FF和FFA的添加质量比分别在11.2~400.0μg·kg-1和4.8~400.0μg·kg-1,其峰面积与质量比呈良好的线性关系,线性回归方程分别为y=762.75x+795.56和y=4019.2x+540.28,相关系数分别为0.9992和0.9998 ;在空白鹤鹑蛋样品中,FF和FFA的添加质量比分别在10.6~400.0μg·kg-1和4.6~400.0μg·kg-1,其峰面积与质量比呈良好的线性关系,线性回归方程分别为y=753.91x-163.29和y=4824.5x-184.02,对应相关系数分别为0.9999和0.9994。在鸽蛋中,FF的LOD为4.8μg·kg-1,LOQ为11.2μg·kg-1;FFA的LOD为1.9μg·kg-1,LOQ为4.8μg·kg-1;鹌鹑蛋中FF的LOD为4.7μg·kg-1,LOQ为10.6μg·kg-1;FFA的LOD为1.8μg·kg-1,LOQ为4.6μg·kg-1。结果表明,此方法灵敏度高,完全满足鹤鹑蛋和鸽蛋中FF和FFA残留检测的要求,满足欧盟2002/675/EC[2]决议关于多种药物残留检测中方法论证参数的要求。
2.4 空白基质添加FF和FFA的回收率和精密度
空白鸽蛋和鹤鹑蛋中FF和FFA的加标回收率及精密度见表2和表3。在鸽蛋样品中,当FF和FFA添加质量比分别为11.2、50.0、100.0、200.0μg·kg-1和4.8、50.0、100.0、200.0μg·kg-1时,其添加的回收率分别为85.33%~98.04%和84.69%~96.82%;在鹤鹑蛋样品中,当FF和FFA添加质量比分别为10.6、50.0、100.0、200.0μg·kg-1和4.6、50.0、100.0、200.0μg·kg-1时,其添加的回收率分别为87.26%~96.95%和86.32%~96.84%。说明本试验运用的ASE技术对样品进行前处理效果较好,所测得的样品回收率在84.69%~98.04%,添加质量比为LOQ水平时,回收率在84.69%~87.26%,RSD在3.7%以下,说明本试验所采用的方法自动化程度高、萃取效率高、重复性好。
2.5 标准溶液的稳定性考察
标准溶液的稳定性考察不仅可以节省开支,节约时间人力,大大缩减试验成本,同时对试验结果的准确性也十分重要。本试验对FF和FFA标准溶液进行稳定性考察试验,结果表明标准溶液在-70℃环境下避光保存3个月,4℃环境下保存1个月,或室温下保存24h,其稳定性均较好。
3 讨论
3.1 样品前处理方法的优化
在已报道文献中,对于氯霉素类药物的提取多采用液一液提取的方法,使用的萃取剂多为乙腈、乙酸乙酯或两者的混合物[16-17]。采用自動提取设备提取基质中的报道很少,而使用加速溶剂萃取仪同时萃取禽蛋中的FF和FFA的方法未见报道。样品前处理效果直接关系到后续检测结果的好坏,液-液萃取繁琐的手动操作增加了样品污染和目标物丢失等风险,而ASE提取法样品回收率高、高效快速全自动,重复性好,所以本试验采用ASE提取法减少手动操作的误差,提高目标物回收率。另外,萃取剂的选择对目标物的提取效率的影响也很大,乙腈的去蛋白效果较好,而禽蛋中最主要的干扰物质就是蛋白质,为了获得更高的提取效率,最终选择氨水氨化的乙腈作为萃取剂。因为FFA带有氨基,是弱碱性化合物,根据相似相融的提取原理,对比不同比例氨水氨化的乙腈的提取效果,最终选择2%的氨水氨化的乙腈,效果最好,所有目标物的回收率均在90.00%以上。
3.2 色谱条件的优化
流动相的组成、色谱柱的类型等因素很大程度上影响目标物的分离和峰形的好坏。在已有报道中,Wang[18]、Moretti[19]等研究中采用C18色谱柱,均获得了较高的分离度,故本试验选用ACQUITYUPLC?BEH C18柱作分析柱。但是由于FFA中含有氨基,其属于弱碱性物质,在C18柱上基本不保留,随死体积一起被洗脱出来。常采取的解决办法就是在流动相体系中加入甲酸铵或乙酸铵。Xie等以乙睛:NaH2PO4溶液(0.01mol·L-1,含0.005mol·L-1十二烷基硫酸钠和0.10%三乙胺,用85%H3PO4调pH至4.5)=32:68(V/V)为流动相,能够很好地分离鸡蛋中甲砜霉素、FF和FFA。本试验在先前的研究基础上,针对离子对试剂(十二烷基硫酸钠)、缓冲体系(磷酸盐-磷酸)、三乙胺的用量和pH进行进一步的优化。试验考察了1、3、5、10mmol·L-1的十二烷基硫酸钠的影响,发现随其用量的增加,FFA出峰时间后延,3mmol·L-1的用量即可保证FFA出峰时间在前面:比较了0、3、5、10、20mmol·L-1的NaH2PO4的影响,发现随其用量的增加,FFA出峰时间略有提前,但盐的使用对仪器寿命有一定影响,且易造成色谱柱堵塞,在兼顾FFA出峰和维护仪器的条件下,选用5mmol·L-1的用量;考察了不同用量(0.01%、0.03%、0.05%和0.1%)的三乙胺的影响,发现0.01%的用量可改善峰拖尾的现象,但随其用量的增加FFA的出峰时间提前,综合考虑最终确定三乙胺用量为0.05%;pH对于出峰时间也有一定影响。试验发现FFA的响应值随着pH的降低逐渐增强、出峰时间逐渐后延,当pH为5.4时,FFA的响应值达到最高,再降低pH对其响应值影响不大。但出峰时间太靠后会延长检测时间,降低检测效率,因此,最终确定pH为5.3±0.1。为使目标物与杂质分开,调节流动相比例,当流动相比例为64:36时,目标物与杂质分离效果好且峰形良好。因此综合考虑选定流动相条件为:NaH2PO4溶液(5mmol·L-1,含3mmol·L-1十二烷基硫酸钠、0.05%的三乙胺,调pH为5.3±0.1):乙腈=64:36(V/V)。此外,本试验采用的UPLC法具有高分离度和高速度等优点,在提高柱效的同时也提高了系统的灵敏度,目标物均在5min内被检测到,大大缩短了检测时间,提高了检测效率,符合实际生产中检测应用的要求。
3.3 基质效应的评价
在试验过程中,基质效应只能通过各种方法降低其影响,但不可消除。本研究采用加速溶剂萃取法降低前处理过程中内源性物质的影响,同时优化色谱分析条件,适当地延长待测组分的保留时间,以降低基质效应的影响。此外,本试验采用10μL的较小进样量和0.2mL·min-1的较低流速,既保证灵敏度又能降低基质效应对检测结果的影响。
4 结论
本研究首次建立并优化了超高效液相色谱一荧光检测法检测鸽蛋和鹤鹑蛋中FF、FFA残留的分析方法,并将ASE法提取目标物与之结合,优化萃取条件和色谱条件以提高回收率及试验的准确性。在本试验的方法及条件下,鸽蛋及鹤鹑蛋中FF和FFA的相对标准偏差均小于3.7%,回收率均在85%以上。该方法快速、方便、自动化程度高,且定量准确回收率高,满足欧盟兽药残留检测的要求,对于保障消费者健康和打破贸易壁垒具有重要的实际意义。
参考文献:
[1]刁志样,张培杨,王旭堂,等.加速溶剂萃取/超高效液相色谱-荧光法检测猪肉中氟苯尼考和氟苯尼考胺残留[J].中国畜牧兽医,2019,46(9):2753-2759.
[2]The European Medicines Agency.COMMISSION REGULATION(EU)No.37/2010 of 22 December 2009 on pharmacologically activesubstances and their classification regarding maximum residue limitsin foodstuffs of animal origin[CP/DK].(2019-03-03)[2019-06-20].https://eur-lex.europa.eu/legal-content/EN/TXT/?uri=uriserv:OJ.L_.2010.015.01.0001.01.ENG&toc=OJ:L:2010:015:TOC.
[3]李先强.氟苯尼考研究进展[J].中国兽药杂志,2016,50(11):5-8.
[4]KONG A,DENG A,WU X,et al.Determination of fforfenicol aminein swine muscle by hydrophilic interaction liquidchromatography-tandem mass spectroscopy[J].Journal of LiquidChromatography & Related Technologies,2014,37(18):2698-2710.
[5]GUO L,SONG S,LIU L,et al.Comparsion of animmunochromatographic strip with ELISA for simultaneous detectionof thiamphenicol,florfenicol and chloramphenicol in foodsamples[J].Biomedical Chromatography,2015,29(9):1432-1439.
[6]TAO X,HE Z,CAO X,et al.Approaches for the determination offlorfenicol and thiamphenicol in pork using a chemiluminescentELISA[J].Analytical methods,2015,7(19):8386-8392.
[7]AMELIN V G,VOLKOVA N M,REPIN N A,et al.Simultaneousdetermination of residual amounts of amphenicols in food by HPLCwith UV-detection[J].Journal of Analytical Chemistry,2015,70(10):1282-1287.
[8]谢恺舟,姚宜林,徐东,等.高效液相色譜荧光检测法同时检测鸡蛋中氟苯尼考及其代谢物氟苯尼考胺残留[J].中国兽医杂志,2011,47(8):74-77.
[9]CHANG K C,TSAI C E.Bioequivalence evaluation of florfenicolpharmaceutics in pigs using liquid chromatography-tandem massspectrometry[J].Journal of Liquid Chromatography & RelatedTechnologies,2018,41(8):445-450.
[10]BARRETO F,RIBEIRO C,HOFF R B,et al.Determination ofchloramphenicol,thiamphenicol,florfenicol and florfenicol amine inpoultry,swine,bovine and fish by liquid chromatography-tandem
mass spectrometry[J].Journal of Chromatography A,2016,1449:48-53.
[11]ZHANG S,LIU Z,GUO X,et al.Simultaneous determination andconfirmation of chloramphenicol,thiamphenicol,florfenicol andflorfenicol amine in chicken muscle by liquid chromatography tandemmass spectrometry[J].Journal of Chromatography B AnalyticalTechnologies in the Biomedical & Life Sciences,2008,875(2):399-404.
[12]PAN X D,WU P G,JIANG W,et al.Determination ofchloramphenicol,thiamphenicol,and florfenicol in fish muscle bymatrix solid-phase dispersion extraction(MSPD)and ultra-highpressure liquid chromatography tandem mass spectrometry[J].FoodControl,2015,52:34-38.
[13]AZZOUZ A,SOUHAIL B,BALLESTEROS E.Determination ofresidual pharmaceuticals in edible animal tissues by continuous solid-phase extraction and gas chromatography-mass spectrometry[J].Talanta,2011,84(3):820-828.
[14]AZZOUZ A,BALLESTEROS E.Multiresidue method for thedetermination of pharmacologically active substances in egg andhoney using a continuous solid-phase extraction system and gaschromatography-mass spectrometry[J].Food Chemistry,2015,178:63-69.
[15]王波,赵霞,谢恺舟,等.加速溶剂萃取/腋相色谱-串联质谱法测定鹌鹑蛋和鸽蛋中氯霉素类药物残留[J].分析科学学报,2019,25(4):443-448.
[16]RIZZETTI T M,DE SOUZA M P,PRESTES O D,et al.Optimizationof sample preparation by central composite design for multi-classdetermination of veterinary drugs in bovine muscle,kidney and liverby ultra-high-performance liquid chromatographic-tandem massspectrometry[J].Food Chemistry,2018,246:404-413.
[17]XIE K,JIA L,YAO Y,et al.Simultaneous determination ofthiamphenicol,florfenicol and florfenicol amine in eggs by reversed-phase high-performance liquid chromatography with fluorescencedetection[J].Journal of Chromatography B,2011,879(23):2351-2354.
[18]WANG L,LI Y Q.Simultaneous determination of ten antibioticresidues in milk by uplc[J].Chromatographia,2009,70(1-2):253-258.
[19]MORETTI S,DUSI G,GIUSEPPONI D,et al.Screening andconfirmatory method for multiclass determination of 62 antibiotics inmeat[J].Journal ofChromatographyA,2016,1429(5):175-188.
(責任编辑:张梅)
收稿日期:2019-07-13初稿;2019-10-04修改稿
作者简介:刁志祥(1996-),男,硕士,研究方向:畜产品品质与安全(E-mail:1178257857@qq.com)
通信作者:谢恺舟(1964-),男,博士,研究员,研究方向:畜产品品质、安全与兽药残留检测方法(E-mail:yzxkz168@163.com)
基金项目:国家现代农业产业技术体系建设专项(CARS-41-G23);扬州大学“高端人才支持计划”项目(201801)

