白及PMM基因cDNA序列克隆及甘露糖合成相关基因的表达特性分析
许娟 石云平 苏祖祥 林茜 李小泉 韦绍龙 桂杰 胡一凤



摘要:【目的】克隆白及磷酸甘露糖变位酶(PMM)基因(BsPMM)cDNA序列,并检测甘露糖合成相关基因的表达特性,为研究甘露糖合成相关基因的调控功能及白及多糖合成机制提供理论依据。【方法】采用RT-PCR克隆BsPMM基因cDNA序列,對其进行生物信息学分析,并采用实时荧光定量PCR(qRT-PCR)检测BsPMM和GDP-甘露糖焦磷酸化酶基因(BsGMP)在不同品种(桂及1号和桂及2号)、生育期(苗期、生长旺期和成熟期)和组织(叶片、茎、假鳞茎和根)中的表达特性,同时测定不同生育期假鳞茎的多糖和甘露糖含量。【结果】克隆获得的BsPMM基因cDNA全长1062 bp,包含一个759 bp的开放阅读框(ORF),编码252个氨基酸,该基因编码的蛋白BsPMM定位于细胞质,含一个从细胞内部到外部的跨膜螺旋区;不稳定系数为41.67,为不稳定蛋白;总平均疏水指数为-0.304,为亲水性蛋白,含植物PMM蛋白特有的4个保守结构域,属于HAD超家族成员。BsPMM蛋白与单子叶植物尤其是兰科植物铁皮石斛和蝴蝶兰PMM蛋白的亲缘关系较近,与罂粟、葡萄和芦笋等双子叶植物PMM的亲缘关系较远。BsPMM和BsGMP基因在不同品种、组织和生育期均有表达,且二者在假鳞茎中表达量显著高于其他组织(P<0.05),区别在于桂及1号在生长旺期的表达量最高,而桂及2号在苗期的表达量最高。桂及1号和桂及2号假鳞茎中甘露糖含量和多糖含量均随生育期推移呈逐渐升高的变化趋势。【结论】BsPMM和BsGMP基因表达具有时空、组织和品种特异性,可能是调控多糖合成代谢途径中的关键基因,参与白及甘露糖和多糖的合成。
关键词: 白及;甘露糖;多糖;磷酸甘露糖变位酶(PMM);GDP-甘露糖焦磷酸化酶基因(GMP);表达特性
中图分类号: S567.239 文献标志码: A 文章编号:2095-1191(2019)09-1913-09
Abstract:【Objective】Phosphomannomutase(PMM) gene(BsPMM) cDNA sequence of Bletilla striata was cloned,the expression characters of Mannose synthesis related genes were determined. This would provide the theory basis for regulation functions of mannose synthesis related genes and synthesis mechanism of B. striata polysaccharides. 【Method】The cDNA sequence of BsPMM gene was cloned by RT-PCR, and its bioinformatic analysis was conducted. Real-time quantitative PCR(qPCR) was performed to detect the expressionof BsPMM and GDP-mannose pyrophosphorylase gene(BsGMP) in different species(Guiji No.1 and Guiji No.2), growing stage(seeding stage, booming stage and maturing stage) and various tissues(leaf, stem, pseudobulb and root). Meanwhile, the content of polysaccharide and mannose in pseudobulb was determined during growing stages. 【Result】The full length of BsPMM gene was 1062 bp,which contained 759 bp open reading frame(ORF) and encoded 252 amino acids. Its encoded protein BsPMM was distributed in cytoplasm with a transmembrane structures from the inside-out. Its instability index was 41.67 and therefore it was an unstable protein. The total average hydrophobic index was -0.304,so it was a hydrophilic protein with conserved domain shared by plant PMM proteins and it belong to HAD superfamily. The relationship between BsPMM protein and PMM protein of monocotyledon especially Orchidaceae such as Dendrobium officinale and butterfly orchid, and its relationship with dico-tyledon such as poppy, grape and asparagus. BsPMM and Bs GMP genes expressed in different varieties, tissues and growth stages, but their expressions in pseudobulb both were significantly higher than other tissues(P<0.05), and the difference was that the expression of Guiji No.1 reached the peak at booming stage but that of Guiji No.2 reached the maximum at seeding stage. Meanwhile, the contents of polysaccharide and mannose in pseudobulb increased with growth time either in Guiji No.1 and Guiji No.2. 【Conclusion】The BsPMM and BsGMP genes expressed specifically in tissue, variety and during space and time, and maybe involve in the polysaccharide synthesis of B. striata as key genes in regulating polysaccharide synthesis and metabolism.
Key words: Bletilla striata; mannose; polysaccharide; phosphomannomutase(PMM); GDP-mannose pyrophosphorylase gene(BsGMP); expression characteristics
0 引言
【研究意義】白及多糖又称白及胶,是从药用植物白及[Bletilla striata(Thunb.) Reichb.f.]的假鳞茎中提取出的一种水溶性多糖,由多个单糖(甘露糖和葡萄糖)以糖苷键连接而成的聚合物(又称甘露聚糖),分子量从几万至几十万不等(Kong et al.,2015),其作为一种高分子生物材料,在医药领域广泛应用,如临床上促进伤口愈合、抗菌、抗老化、抗肿瘤、抗纤维化等(Li et al.,2014;Posocco et al.,2015;孙爱静等,2016;Zafar et al.,2016)。由于白及多糖的合成是由GDP-甘露糖开始,而磷酸甘露糖变位酶(PMM)和GDP-甘露糖焦磷酸化酶(GMP)是GDP-甘露糖合成的关键酶(Qian et al.,2007;Reiter,2008)。因此,从白及中克隆PMM和GMP基因,并对其进行生物信息学分析,揭示其基因结构、进化关系和时空表达特征等,对白及多糖合成途径的遗传改良及白及多糖含量提高具有重大意义。【前人研究进展】GDP-甘露糖是甘露糖的一种活化形式,直接为多糖的合成提供单糖,还可作为甘露糖供体参与到抗坏血酸、含甘露糖的多糖、细胞壁多糖及糖基化蛋白等生物合成过程中(Michel,2010;Lukowitz et al.,2001;Smirnoff et al.,2001)。目前,真菌、哺乳动物和植物均有研究获得PMM。1959年Glaser等首次从酵母面包中分离获得PMM,并发现该酶在体外也能催化甘露糖-6-磷酸与甘露糖-1-磷酸间的转化。在植物中,最早从魔芋的球茎中分离获得PMM(Murata,1976),而后相继从西葫芦(Hancock et al.,2003)、拟南芥(Hoeberichts et al.,2008)、烟草(Badejo et al.,2009)和霍山石斛(林榕燕等,2017)等植物中分离获得PMM,其编码基因也被成功克隆。此外,有研究发现,斑马鱼MM2基因缺乏会造成先天性糖基化紊乱从而导致其死亡(Cline et al.,2012)。拟南芥pmm-2突变体(温度敏感型)在高温条件下因无法合成GDP-甘露糖而引起蛋白糖基化紊乱导致细胞死亡(Hoeberichts et al.,2008)。将拟南芥PMM基因转入烟草后过表达,烟草中的抗坏血酸含量增加(Badejo et al.,2009)。上述研究结果表明,PMM参与N-糖基化过程,可促进GDP-甘露糖合成并增加抗坏血酸的含量。【本研究切入点】目前,有关白及GDP-甘露糖合成研究相对滞后,仅许娟等(2018)克隆白及GMP基因并对其进行生物信息学分析,鲜见有关白及PMM基因cDNA序列克隆及甘露糖合成相关基因表达分析的研究报道。【拟解决的关键问题】克隆白及PMM基因(BsPMM)cDNA序列全长,对其进行生物信息学分析,并采用实时荧光定量PCR(qRT-PCR)检测甘露糖合成相关基因(BsPMM和BsGMP)在不同品种、生育期和组织中表达情况,为研究甘露糖合成相关基因的调控功能及白及多糖合成机制提供理论依据。
1 材料与方法
1. 1 试验材料
供试白及品种为桂及1号和桂及2号,种植于广西农业科学院生物技术研究所白及种植基地(南宁上林县),均为组培苗移栽,移栽时间为2017年3月5日。主要试剂:RNAprep Pure多糖多酚植物总RNA提取试剂盒、反转录试剂盒和QuantiNova SYBR Green PCR Master Mix Kit购自宝生物工程(大连)有限公司;KOD FX高保真PCR酶购自东洋纺(上海)生物科技有限公司;其他生物试剂和引物合成均购自生工生物工程(上海)股份有限公司。
1. 2 样品采集
采集生长1年以上的白及植株新鲜叶片,用于BsPMM基因cDNA序列克隆。2018年分别于白及苗期(3月25日)、生长旺期(5月25日)和成熟期(倒苗期初始,9月25日)采集其叶片、茎、假鳞茎(块茎)和根,每时期分别取两个品种生长健壮植株各3株作为1个生物学重复,设3次重复,用于定量表达分析。取样时用清水洗净,纸巾吸干水分,再混匀样株各组织,立即用液氮速冻,于-80 ℃保存备用。将不同生育期采集的假鳞茎用于多糖和甘露糖含量测定。
1. 3 引物设计
基因克隆和qRT-PCR所用引物(表1)由Primer 5和Oligo 6.0设计,委托生工生物工程(上海)股份有限公司合成。
1. 4 BsPMM基因cDNA序列克隆
按照RNA提取试剂盒说明提取叶片总RNA,以其为模板,利用5'端锚定引物(表1),参照反转录试剂盒PrimeScript 1st Strand cDNA Synthesis Kit说明合成第一链cDNA。以cDNA为模板进行PCR扩增。PCR反应体系为50.0 μL:10×KOD Buffer 5.0 μL,2.0 mmol/L dNTPs 5.0 μL,10 μmol/L上、下游引物(PMM-F和PMM-R)(表1)各1.0 μL,1 U/µL KOD酶1.0 μL,cDNA模板1.0 μL,25 mmol/L MgCl2 3.0 μL,用ddH2O补足至50.0 μL。扩增程序:98 ℃预变性30 s;98 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min,进行30个循环;72 ℃延伸7 min。PCR产物加A尾反应:取PCR产物50.0 μL,加入2×Taq PCR Master Mix 50.0 μL,72 ℃下反应60 min。将加A尾的PCR产物经胶回收试剂盒纯化回收,并与pUC57载体连接后转化大肠杆菌DH5α感受态细胞,涂布于含100 μg/mL氨苄青霉素(Amp)的LB固体培养基上培养12~16 h,筛选出阳性克隆,随机挑取单菌落进行PCR鉴定(黄珑等,2015),并送至生工生物工程(上海)股份有限公司测序。
1. 5 生物信息学分析
基于BsPMM基因cDNA序列的测序结果,利用NCBI的ORF Finder在线工具查找分析其开放阅读框(ORF)。利用BioXM 2.6和TMpred預测BsPMM蛋白的理化性质。利用Softberry和TMpred对BsPMM蛋白进行亚细胞定位和跨膜区预测,并利用SWISS-MODEL和RasMol 2.7.5进行三级结构预测及建模,运用NCBI的Conserved Domain Database(CDD)在线工具进行功能结构域分析,最后运用MEGA 5.0的近邻相接法(Neighbor-joining,NJ)构建系统发育进化树。
1. 6 qRT-PCR检测
参照QuantiNova SYBR Green PCR Master Mix Kit说明配制定量反应体系,所用引物序列见表1,在荧光定量PCR仪ABI7500上进行qRT-PCR检测。以Actin基因为内参,经内参基因标准化后再进行目的基因检测。反应体系10.00 μL:2×SYBR Green PCR Master Mix 5.00 μL,QN ROX Reference Dye 0.05 μL,10 μmol/L上、下游引物各0.70 μL,cDNA模板(≤100 ng)1.0 μL,用RNase-free水补足至10.00 μL。扩增程序:95 ℃预变性2 min;95 ℃ 5 s,60 ℃ 30 s,进行40个循环,最后分析熔解曲线。每个反应体系设3个重复。
1. 7 多糖和甘露糖含量的测定
多糖含量测定参照蒽酮—硫酸显色法(李德旺等,2018);甘露糖含量测定采用HPLC法测定(张宁南等,2017)。
1. 8 统计分析
采用2-ΔΔCt法(Livak and Schmittgen,2010)换算目的基因相对表达量,并利用Origin 8.0作图。多糖和甘露糖含量利用Excel 2007进行统计整理作图,并利用SPSS 11.0进行差异显著性分析。
2 结果分析
2. 1 BsPMM基因cDNA序列克隆结果
以白及叶片总RNA反转录获得的cDNA为模板,PCR扩增获得约800 bp的单一条带(图1-A),与预期结果相符。PCR产物经加A尾后,通过胶回收、连接转化及菌落PCR检测后,挑取阳性克隆进行测序,结果显示,PCR产物加A尾后的长度为1062 bp(图1-B)。将该序列在NCBI上进行BLAST比对分析,结果发现,其与其他植物的PMM基因核苷酸序列同源性较高,尤其与铁皮石斛PMM基因序列(KF195558.1)相似度达94%,表明该序列为白及PMM基因cDNA序列。
2. 2 生物信息学分析结果
2. 2. 1 BsPMM基因cDNA序列及其推导氨基酸序列分析 在NCBI的ORF Finder上查找BsPMM基因的ORF,结果发现该基因的ORF为759 bp,位于163~921 bp区间,编码252个氨基酸(图2),蛋白分子量为28.61 kD,理论等电点为5.92。TMpred预测结果显示,该蛋白含一个从细胞内部到外部的跨膜螺旋区,位于第169~188位氨基酸,但无从细胞外到细胞内的跨膜螺旋区。预测结果还显示,该蛋白不稳定系数为41.67,为不稳定蛋白;总平均疏水指数为-0.304,疏水性最高值(2.122)出现在第43位氨基酸处,亲水性最高值(-2.956)出现在第143位氨基酸处,推测该蛋白为亲水性蛋白。亚细胞定位分析结果表明,BsPMM蛋白主要定位于细胞质中。功能结构域分析结果显示,BsPMM蛋白属于HAD超家族成员(图3)。
2. 2. 2 BsPMM蛋白三级结构预测结果 利用SWISS-MODEL和RasMol 2.7.5对BsPMM蛋白的三级结构进行预测及建模,结果如图4所示。BsPMM蛋白主要结构元件为α-螺旋、β-折叠和β-转角(卷曲),分别含有24个典型的α-螺旋、26个β-折叠和52个β-转角。
2. 2. 3 BsPMM蛋白同源性比对及进化分析 将BsPMM蛋白氨基酸序列提交至NCBI上进行BLAST同源性比对分析,结果发现,BsPMM蛋白的氨基酸序列与铁皮石斛(Dendrobium officinale)PMM蛋白的同源性最高,达94%。利用DNANAN对7种植物PMM蛋白的氨基酸序列进行多重比对分析,结果如图5所示。不同植物的PMM蛋白氨基酸序列具有较高的同源性,在84%以上,且BsPMM蛋白的功能域氨基酸种类与其他植物大致相同,均含植物PMM蛋白特有的4个保守结构域,即DVDGTLT的区域Ⅰ、VGGSD的区域Ⅱ、DKTY的区域Ⅲ和GGND的区域Ⅳ。这4个保守结构域与PMM的催化作用密切相关。
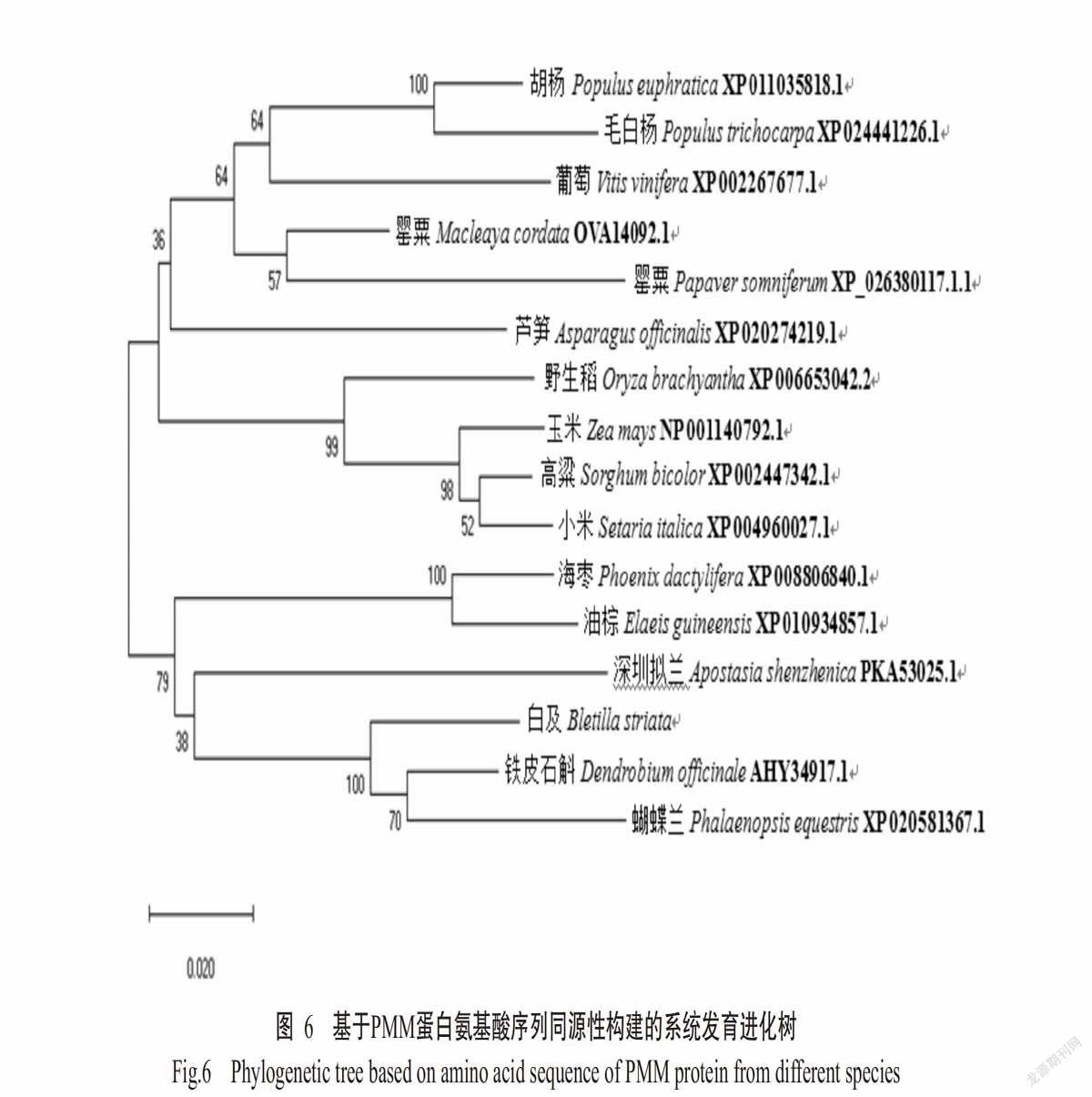
利用MEGA 5.0构建不同物种PMM蛋白的系统发育进化树,结果如图6所示。不同物种PMM蛋白主要聚成两大分支(Ⅰ和Ⅱ)。Ⅰ分支中,BsPMM蛋白与兰科植物铁皮石斛(D. officinale)和蝴蝶兰(Phalaenopsis equestris)PMM蛋白最先聚在一起,表明三者亲缘关系较近,再与兰科植物深圳拟兰(Apostasia shenzhenica)、棕榈科植物油棕(Elaeis guineensis)和海枣(Phoenix dactylifera)的PMM蛋白聚在一起。Ⅱ分支又可分为2个小分支,其中玉米(Zea mays)、高粱(Sorghum bicolor)、小米(Setaria italica)和野生稻(Oryza bachyantha)等单子叶植物为一个小分支,罂粟(Macleaya cordate)、葡萄(Vitis vini-fera)、芦笋(Asparagus officinalis)和胡杨(Populus euphratica)等双子叶植物为另一个小分支。综上所述,BsPMM蛋白与单子叶植物尤其是兰科植物PMM蛋白的亲缘关系较近,与双子叶植物PMM蛋白的亲缘关系较远。
2. 3 BsPMM和BsGMP基因表达情况的检测结果
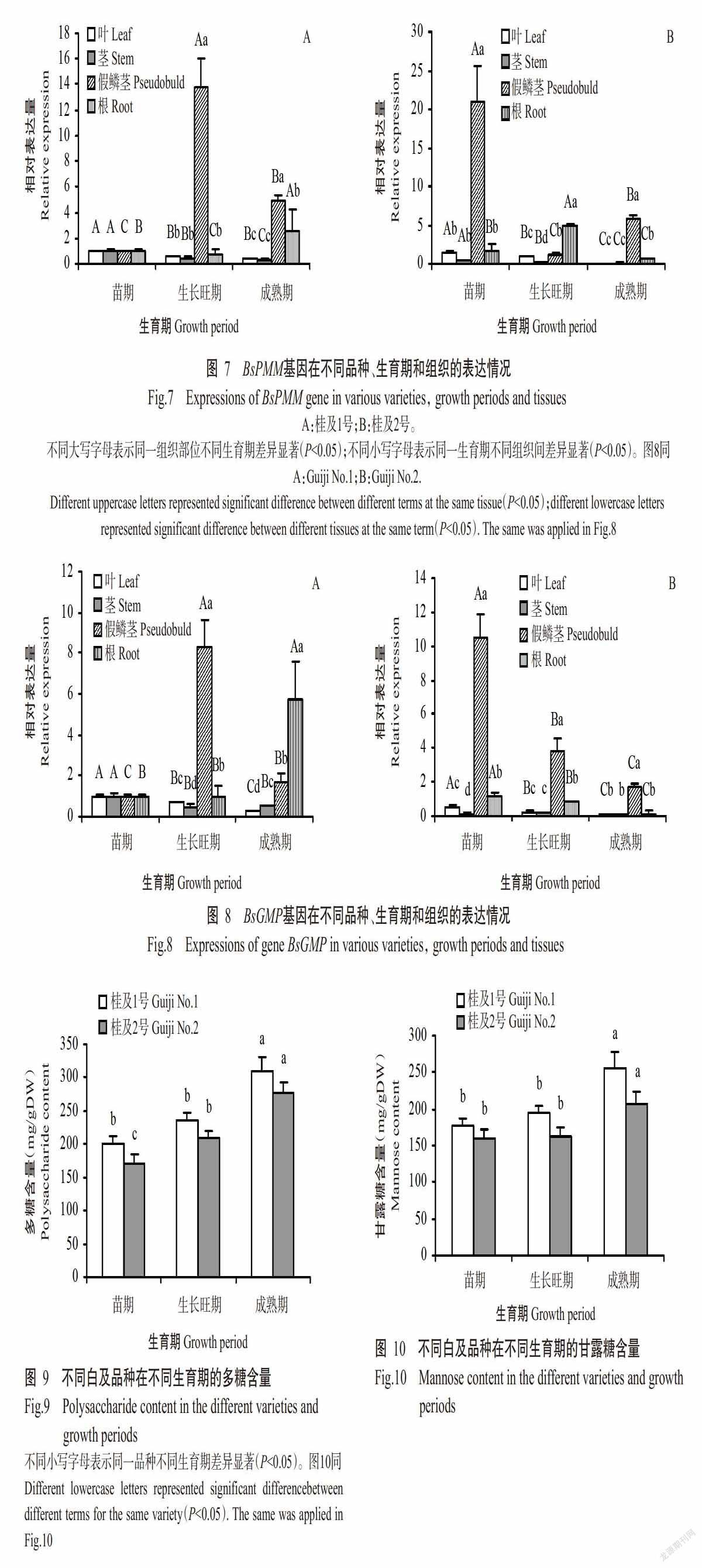
2. 3. 1 BsPMM基因的表达情况 从图7-A可知,在桂及1号中,苗期BsPMM基因在叶片、茎、假鳞茎和根中表达量无显著差异(P>0.05,下同);生长旺期BsPMM基因在假鳞茎中表达量显著高于其他组织的表达量(P<0.05,下同);成熟期BsPMM基因在假鳞茎中的表达量显著高于根中的表达量,且二者均显著高于叶片和茎中的表达量。可见,BsPMM基因表达具有组织特异性,参与调控白及生长发育机制,且由于假鳞茎为多糖储藏部位,推测BsPMM基因参与白及多糖的合成。从图7-A还可知,在同一组织中,不同生育期(苗期、生长旺期和成熟期)BsPMM基因表达量的变化趋势不同,其中,BsPMM基因在叶片和茎部中的表达量均随生育期推移呈降低的变化趋势,即在苗期表达量最高;在假鳞茎中呈先升高后降低的变化趋势,即在生长旺期表达量最高;而在根中呈先降低后升高的变化趋势,即在成熟期表达量最高。
由图7-B可知,BsPMM基因在桂及2号的表达规律与桂及1号存在异同,即均在假鳞茎表达量最高,区别在于其在桂及2号苗期的表达量最高,且在根中以生长旺期的表达量最高,表明BsPMM基因表达具有组织、时空和品种特异性。
2. 3. 2 BsGMP基因的表达情况 由图8-A可知,在桂及1号中,苗期BsGMP基因在叶片、茎、假鳞茎和根中表达量也无显著差异,且BsGMP基因在不同生育期的叶片和茎中的表达规律与BsPMM基因相似,均随生育期推移其表达量呈降低趋势,即在苗期表达量最高;同样,BsGMP基因在假鳞茎中表达量也较高,尤其是生长旺期,显著高于其他组织。可见,BsGMP基因为特异性表达,参与调控白及生长发育机制。
由图8-B可知,桂及2号中BsGMP基因的表达规律与BsPMM基因相似,与桂及1号BsGMP基因的表达规律存在异同:在两个品种中BsGMP和BsPMM基因均在假鳞茎表达量最高,区别在于桂及2号中BsGMP基因在苗期各组织(除叶片外)的表达量较高,表明BsGMP基因表达存在品种间差异。
综上所述,BsPMM和BsGMP基因均具有组织和时空表达特异性,存在品种间差异,且在多糖储藏部位(假鳞茎)表达量较高,推测BsPMM和BsGMP基因均参与白及多糖生物合成。
2. 4 桂及1号和桂及2号假鳞茎中多糖和甘露糖含量比较
由图9可知,桂及2号的多糖含量随生育期推移呈顯著升高变化趋势,桂及1号的多糖含量也随生育期推移呈逐渐升高的变化趋势,但苗期与生长旺期无显著差异。从图10可知,桂及1号和桂及2号假鳞茎中甘露糖含量的变化趋势与多糖含量的变化趋势相同,均随生育期推移呈逐渐升高的变化趋势,但苗期与生长旺期无显著差异,生长旺期与成熟期差异显著。比较图9和图10可知,整个生育期内,桂及1号假鳞茎多糖含量和甘露糖含量均高于桂及2号。综上所述,桂及1号和桂及2号在生长过程中甘露糖和多糖的积累量逐渐增加,且不同品种间存在明显差异。
3 讨论
本研究克隆获得的BsPMM基因cDNA序列全长1062 bp,包含一个759 bp的ORF,编码252个氨基酸,该蛋白与兰科植物铁皮石斛和蝴蝶兰同源性较高,在90%以上,与海枣、油棕和深圳拟兰等植物PMM蛋白的同源性较高,在84%以上,证明不同植物PMM蛋白的氨基酸序列具有高度的保守性,推测其在不同植物中发挥相似生理功能。此外,本研究通过BsPMM蛋白的理化性质和结构域分析结果显示,该蛋白为亲水性蛋白,属于HAD超家族成员,与林榕燕等(2017)对霍山石斛PMM蛋白的研究结论相似。前人研究表明,HAD超家族是一个巨大的蛋白家族(Schmidberger et al.,2007),参与磷酸甘露糖、磷酸酯和卤代物等合成代谢途径。BsPMM蛋白含植物PMM蛋白特有的4个保守结构域,其是HAD超家族极保守的基序,可参与Asp亲核试剂对底物磷酸基团的定向并与Mg2+结合(Seifried et al.,2013)。
本研究还发现,BsPMM和BsGMP基因在不同品种、组织和生育期均有表达,且二者在假鳞茎中表达量显著高于其他组织,区别在于桂及1号在生长旺期的表达量最高,而桂及2号在苗期的表达量最高,表明两个基因的表达具有时空、品种和组织特异性。由于假鳞茎是白及多糖的储藏部位,推测BsPMM和BsGMP基因与白及多糖和甘露糖合成密切相关。前人研究表明,PMM基因参与抗坏血酸(Qian et al.,2007;何春梅,2015;高利芬等,2016)和岩藻聚糖(张朋艳等,2016)的合成,同时提高多糖含量并参与胁迫反应(He et al.,2017)。GMP基因除了具有上述生物学功能外,还参与甘露聚糖的合成(Davis et al.,2010)。本研究发现,BsPMM和BsGMP基因在桂及2号苗期假鳞茎中表达量最高,推测BsPMM和BsGMP基因不仅参与白及多糖生物合成,还可能参与其他物质的合成。另外,BsGMP基因在桂及1号成熟期根中的表达量也较高,该时期假鳞茎中多糖和甘露糖含量最高。由于在白及成熟期,地上部分叶片已经衰老,地下部分组织将甘露糖转化为多糖,将多糖转移到根部组织,推测BsGMP基因与多糖转运密切相关。这与铁皮石斛中PMM和GMP基因表达模式和多糖累积规律(何春梅,2015;俞振明,2017)一致。综上所述,BsPMM和BsGMP基因可能参与白及多糖的合成。在今后的研究中,可通过RNAi干扰技术或过表达技术深入研究BsPMM和BsGMP基因对多糖生物合成的分子调控机理。
4 结论
BsPMM和BsGMP基因表达具有时空、组织和品种特异性,可能是调控多糖合成代谢途径中的关键基因,参与白及甘露糖和多糖的合成。
参考文献:
高利芬,夏志辉,张继,王道文,翟文学. 2016. 转磷酸甘露糖变位酶基因提高水稻维生素C含量[J]. 中国水稻科学,30(4):111-116. [Gao L F,Xia Z H,Zhang J,Wang D W,Zhai W X. 2016. Transgenosis of the phosphomannomutase transgene increases vitamin C content in rice[J]. Chinese Journal of Rice Science,30(4):111-116.]
何春梅. 2015. 铁皮石斛多糖生物合成分子机制研究[D]. 广州:中国科学院大学. [He C M. 2015. Study on biosynthesis of polysaccharides of Dendrobium officinale[D]. Guangzhou:University of Chinese Academy of Sciences.]
黄珑,苏炜华,张玉叶,黄宁,凌辉,肖新换,阙友雄,陈如凯. 2015. 甘蔗CIPK基因的同源克隆与表达[J]. 作物学报,41(3):499-506. [Huang L,Su W H,Zhang Y Y,Huang N,Ling H,Xiao X H,Que Y X,Chen R K. 2015. Clo-ning and expression analysis of CIPK gene in sugarcane[J]. Acta Agronomica Sinica,41(3):499-506.]
李德旺,邓芳,汪胜. 2018. 蒽酮-硫酸显色法测定栽培白及的白及多糖含量[J]. 中国药业,27(7):5-6. [Li D W,Deng F,Wang S. 2018. Content determination of polysaccharide in cultivated rhizoma bletillae by anthrone sulfuric acid colorimetry[J]. China Pharmaceuticals,27(7):5-6.]
林榕燕,钟淮钦,叶秀仙,黄敏玲. 2017. 霍山石斛PMM基因的克隆及其表达分析[J]. 热带作物学报,38(12):2326-2333. [Lin R Y,Zhong H Q,Ye X X,Huang M L. 2017. Cloning and quantitative expression analysis of PMM gene from Dendrobium huoshanense[J]. Chinese Journal of Tropical Crops,38(12):2326-2333.]
孙爱静,庞素秋,王国权. 2016. 中藥白及化学成分与药理活性研究进展[J]. 环球中医药,9(4):507-511. [Sun A J,Pang S Q,Wang G Q. 2016. Advances of chemical constituents and pharmacological activities of Bletilla striata[J]. Global Traditional Chinese Medicine,9(4):507-511.]
许娟,石云平,韦绍龙,苏祖祥,林茜,桂杰,胡一凤,李小泉. 2018. 白及GMP基因cDNA全长克隆及生物信息学分析[J]. 西南农业学报,31(6):1104-1110. [Xu J,Shi Y P,Wei S L,Su Z X,Lin Q,Gui J,Hu Y F,Li X Q. 2018. Cloning and bioinformatics analysis of GMP gene in Bletilla striata[J]. Southwest China Journal of Agricultu-ral Sciences,31(6):1104-1110.]
俞振明. 2017. 铁皮石斛多糖累积规律及调控机制[D]. 广州:中国科学院大学. [Yu Z M. 2017. Accumulation and regulation mechanism of polysaccharides of Dendrobium officinale[D]. Guangzhou:University of Chinese Academy of Sciences.]
张宁南,徐兰芳,徐大平,黄松,林国雄. 2017. HPLC法测定不同附主铁皮石斛鲜品中甘露糖含量[J]. 亚太传统医药,13(12):37-39. [Zhang N N,Xu L F,Xu D P,Huang S,Lin G X. 2017. Main differences of mannose content in fresh epiphytic Dendrobium officinal attached to different materials by HPLC method[J]. Asia-Pacific Traditional Medicine,13(12):37-39.]
张朋艳,于雪,姚建亭,段德麟. 2016. 海带磷酸甘露糖变位酶(PMM)基因的克隆与表达分析[J]. 海洋科学,40(3):32-39. [Zhang P Y,Yu X,Yao J T,Duan D L. 2016. Cloning and expression of phosphomannomutase from Saccharina japonica(Laminariales,Phaeophyceae)[J]. Marine Sciences,40(3):32-39.]
Badejo A A,Eltelib H A,Fukunaga K,Fujikawa Y,Esaka M. 2009. Increase inascorbate content of transgenic tobacco plants overexpressing the acerola(Malpighia glabra) phosphomannomutase gene[J]. Plant and Cell Physiology,50(2):423-428.
Cline,A,Gao N,Flanagan-Steet H,Sharma V,Rosa S,Sonon R,Azadi P,Sadler K,Freeze H,Lehrman M A S R. 2012. Azebrafish model of PMM2-CDG reveals altered neurogenesis and a substrate-accumulation mechanism for N-linked glycosylation deficiency[J]. Molecular Biology of the Cell,23(21):4175-4187.
Davis J,Brandizzi F,Liepman A H,Keegstra K. 2010. Arabidopsis mannansynthase CSLA9 and glucan synthase CSLC4 have opposite orientations in the Golgi membrane[J]. The Plant Journal,64(6):1028-1037.
Doblin M S,Pettolino F,Bacic A. 2010. Plant cell walls:The skeleton of the plant world[J]. Functional Plant Biology,37(5):357-381.
Glaser L,Kornfeld S,Brown D H. 1959. Preparation and properties of phosphomannomutase from baker’s yeast[J]. Biochimica et Biophysica Acta,33(2):522-526.
Hancock R D,McRae D,Haupt S P,Viola R. 2003. Synthesis of L-ascorbic acid in the phloem[J]. BMC Plant Biology,3:7-20.
He C M,Zeng S J,Jaime A,Teixeira d S,Yu Z M,Tan J W,Duan J. 2017. Molecular cloning andfunctional analysis of the phosphomannomutase(PMM) gene from Dendrobium Officinale and evidence for the involvement of anabiotic stress response during germination[J]. Protoplasma,254(4):1693-1704.
Hoeberichts F A,Vaeck E,Kiddle G,Coppens E,van de Cotte B,Adamantidis A,Ormenese S,Foyer C H,Zabeau M,Inze D,Perilleux C,van Breusegem F,Vuylsteke M. 2008. A temperature-sensitive mutation in the Arabidopsis thaliana phosphomannomutase gene disrupts protein glycosylation and triggers cell death[J]. The Journal of Biological Chemistry,283(9):5708-5718.
Kong L S,Yu L,Feng T,Yin X J,Liu T J,Dong L. 2015. Physicochemical characterization of the polysaccharide from Bletilla striata:Effect of drying method[J]. Carbohydrate Polymers,125:1-8.
Li Q,Li K,Huang S S,Diao Y P. 2014. Optimization of extraction processandanti bacterial activity of Bletilla striata polysaccharides[J]. Asian Journal of Chemistry,26(12):3574-3580.
Lin L,Shi Q,Wang H,Qin A,Yu X. 2011. Over-expression of tomato GDP-Mannose pyrophosphorylase(GMPase) in potato increases ascorbate content and delays plant senescence[J]. Agricultural Sciences in China,10(4):534-543.
Livak K J,Schmittgen T D. 2010. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods,25(4):402-408.
Lukowitz W,Nickle T C,Meinke D W,Last R L,Conklin P L,Somerville C R. 2001. Arabidopsis cyt1 mutantsare deficient in a mannose-1-phosphate guanylyl transferase and point to a requirement of N-linked glycosylation for cellulosebiosynthesis[J]. Proceedings of the National Academy of Sciences of the United States of America,98(5):2262-2267.
Michel G. 2010. The cell wall polysaccharide metabolism of the brownalga Ectocarpus siliculosus. Insights into the evolution of extracellularmatrix polysaccharides in Eukaryotes[J]. New Phytologist,188(1):82-97.
Murata T. 1976. Purification and some properties of phosphomannomutase from corms of Amorphophallus konjac C. Koch[J]. Plant and Cell Physiology,17(3):1099-1109.
Posocco B,Dreussi E,de Santa J,Toffoli G,Abrami M,Musiani F,Grassi M,Farra R,Tonon F,Grassi G,Dapas B. 2015. Polysaccharides for the delivery of antitumor drugs[J]. Materials,8(5):2569-2615.
Qian W Q,Yu C M,Qin H J,Liu X,Zhang A M,Johansen I E,Wang D W. 2007. Molecular and functional analysis of phosphomannomutase(PMM) from higher plants and genetic evidence for the involvement of PMM in ascorbic acid biosynthesis in Arabidopsis and Nicotiana benthamiana[J]. The Plant Journal,49(3):399-413.
Reiter W D. 2008. Biochemical genetics of nucleotide sugar interconversion reactions[J]. Current Opinion in Plant Bio-logy,11(3):236-243.
Schmidberger J W,Wilce J A,Tsang J S H,Wilce M C J. 2007. Crystal structures of the substrate free-enzyme,and reaction intermediate of the HAD superfamily member,haloacid dehalogenase DehIVa from burk holderia cepacia MBA4[J]. Journal of Molecular Biology,368(3):706-717.
Seifried A,Schultz J,Gohla A. 2013. Human HAD phosphatases:Structure,mechanism,and roles in health and di-sease[J]. Federation of European Biochemical Societies,280(2):549-571.
Smirnoff N,Conklin P L,Loewus F A. 2001. Biosynthesis of ascorbicacid in plants:Arenaissance[J]. Annual Review of Plant Physiologyand Plant Molecular Biology,52(1):437-467.
Zafar R,Zia K M,Tabasum S,Jabeen F. 2016. Polysaccharide based bionano composites,properties and applications:A review[J]. International Journal of Biological Macromo-lecules,92(11):1012-1024.
(責任编辑 陈 燕)

