气相色谱—串联质谱法测定露地芹菜中丁硫克百威及其代谢物残留
褚能明 杨俊英 李典晏 向嘉 张雪梅 唐偲雨 柴勇
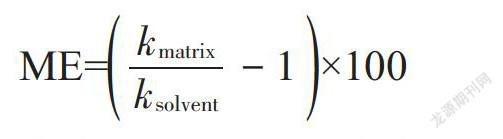





摘要:【目的】研究丁硫克百威在露地種植芹菜中的代谢残留情况,同时建立芹菜中丁硫克百威及其代谢物克百威和3-羟基克百威的检测方法,为丁硫克百威在芹菜上的用药登记工作提供参考依据。【方法】20%丁硫克百威乳油以有效成分180 g/ha的剂量(低剂量组)和有效成分1.5倍(高剂量组)分别喷雾大田芹菜,设施药1次、2次和3次3个处理,并于末次施药后1、3、5、7和14 d按五点法随机在各小区内采集芹菜样品1~2 kg。芹菜样品匀浆后用乙腈提取,离心后取上清液至注射器中,注射器装上针头式滤膜,加入分散固相吸附剂,使净化和过滤等步骤在注射器同步一次完成。在气相色谱—串联质谱仪上以定时选择反应监测模式检测,外标法定量。【结果】芹菜中的添加回收试验结果表明,丁硫克百威的添加回收率为83.8%~110.3%,相对标准偏差(RSD)为2.7%~10.2%,定量限(LOQ)为5.5 µg/kg;克百威添加回收率为90.5%~119.0%,RSD为3.7%~9.6%,LOQ为4.8 µg/kg;3-羟基克百威添加回收率为92.0%~103.5%,RSD为1.8%~5.3%,LOQ为8.0 µg/kg。大田最终残留试验结果表明,低剂量组中,末次施药后第14 d,施药1次、2次和3次处理的克百威残留量分别为未检出、0.009和0.017 mg/kg;高剂量组中,在末次施药后第14 d,施药1次、2次和3次处理的克百威残留量分别为0.026、0.056和0.089 mg/kg。【结论】建立了芹菜中丁硫克百威及其代谢物的快速检测技术,整个检测分析过程可在30 min内完成,符合农药残留分析要求;以丁硫克百威有效成分180 g/ha的剂量喷雾1次,建议安全间隔期在5 d以上,喷雾2次以上则安全间隔期在14 d以上。
关键词: 丁硫克百威;克百威;3-羟基克百威;分散固相萃取;气相色谱—串联质谱;露地芹菜
中图分类号: S481.8 文献标志码: A 文章编号:2095-1191(2019)08-1822-07
Determination of carbosulfan and its metabolitesin field celery by gas chromatography-tandem mass spectrometry
CHU Neng-ming, YANG Jun-ying, LI Dian-yan, XIANG Jia, ZHANG Xue-mei,
TANG Si-yu, CHAI Yong*
(Chongqing Academy of Agricultural Sciences/Laboratory of Agri-Food Quality and Safety,
Ministry of Agriculture and Rural Affairs(Chongqing), Chongqing 401329, China)
Abstract:【Objective】The final residue trial was carried out to study the carbosulfan residue in the celery planted in the field, and a rapid detection method was established for the carbosulfan and its metabolites(carbofuran and 3-hydroxycarbofuran) in celery. This could provide reference for the registration of carbosulfanin celery. 【Method】The low dose group and the high dose group were composed of 1 time and 1.5 times active ingredients(20% carbosulfan EC,180 g/ha), respectively. The two groups of doses were sprayed on celery in the field,with three different treatments for 1, 2 and 3 times of pesticide applied. After the last application, on the 1st, 3rd, 5th, 7th, and 14th day, celery samples were randomly collected in each plot by the five-point method for 1 to 2 kg. The celery samples were extracted by acetonitrile, and the supernatant was obtained by high speed centrifugation, which was loaded into the syringe where the optimized dispersed solid phase adsorbent in. Simultaneous completion of the purification and filtration of the sample extracted was conducted by squeezing the syringe push rod. The analytes were analyzed by gas chromatography-tandem mass spectrometry(GC-MS/MS) in timed selected-reaction monitoring(t-SRM) mode,and quantified by matrix external standard method.【Result】The recovery experiments of carbofuran in celery showed that the recoveries was 83.8%-110.3%, the relative standard deviation(RSD) was 2.7%-10.2%, and the limit of quantitation(LOQ) was 5.5 µg/kg. The recovery of carbofuran was 90.5%-119.0%, the RSD was 3.7%-9.6%, and the LOQ was 4.8 µg/kg. The recovery of 3-hydroxycarbofuran was 92.0%-103.5%, the RSD was 1.8%-5.3%, and the LOQ was 8.0 µg/kg. The results of field final residue trials showed that in the low dose group, the residues in the 1, 2 and 3 times applications were undetected, 0.009 and 0.017 mg/kg respectively after the last application of pesticide on the 14th day. In the high dose group, the residues of the 1, 2 and 3 times applications on the 14th day after the last application were 0.026, 0.056 and 0.089 mg/kg, respectively. 【Conclusion】The rapid detection method of carbosulfan and its metabolites in celery is established. The whole analysis time is completed within 30 min, which accords with the requirement of pesticide residue analysis. The results show that the 20% carbosulfan EC(180 g/ha) is sprayed with one time, the safety interval of pesticide residues is recommended to be more than 5 d, when sprayed more than two times, the safety interval of pesticide residues is more than 14 d.
Key words: carbosulfan; carbofuran; 3-hydroxycarbofuran; dispersive solid-phase extraction; gas chromatography-tandem massspectrometry; field celery
0 引言
【研究意义】丁硫克百威属于氨基甲酸酯类农药,内吸性较强,是一种广谱性杀虫、杀螨和杀线虫剂,已广泛应用于粮食、蔬菜和水果上的多种害虫防治,是高毒、高残留农药克百威的替代品之一。丁硫克百威在环境中主要代谢为毒性更大的克百威和3-羟基克百威,其中克百威已禁止生产销售,但实际农残监测调查常检出克百威,据文献报道,我国多个省(市)销售和生产的蔬菜水果中克百威检出率在0.96%~56.3%(朴秀英等,2015)。近年来,蔬菜中芹菜检出克百威的报道较多(谢小真,2016),是比较突出的问题之一,而丁硫克百威在防治芹菜蚜虫、根结线虫等虫害方面效果明显(郎朗等,2017),其普遍使用可能是造成克百威经常检出的主要原因。因此,研究丁硫克百威的检测方法及其在大田露地蔬菜的残留代谢情况对探明芹菜克百威高检出率的原因具有重要意义。【前人研究进展】蔬菜水果中丁硫克百威及其代谢物的提取方法有液液萃取法(杨爽等,2008)、加速溶剂萃取法(赵桦林等,2013)和固相萃取法(刘晓亮等,2016)等,但这些方法均不同程度的存在提取时间长、耗费溶剂、过程繁琐等弊端。仪器检测方法有高效液相色谱法(Brooks and Barros,1995)、气相色谱法(徐应明等,2003)、液相色谱—串联质谱法(Soler et al.,2006)和气相色谱—质谱法(杨清华等,2017)等。丁硫克百威在不同蔬菜中的代谢物存在差异,主要为克百威、3-羟基克百威和3-酮基克百威,有学者对其残留行为进行研究(赵桦林,2013),发现在白菜中代谢为克百威和3-羟基克百威,在黄瓜中代谢为克百威、3-羟基克百威和3-酮基克百威。丁硫克百威的残留量包括其本体和代谢物,结果均以丁硫克百威表示。有关田间最终残留量试验结果表明,在不同蔬菜中其最终残留量差别较大,如在甘蓝莲座期施药3次后采样、气相色谱检测,7 d后的最终残留量为0.25 mg/kg(秦冬梅和龚勇,2000);韭菜中按推荐剂量的2倍施药后14 d采样、气相色谱检测,其最终残留量为0.097 mg/kg(徐应明等,2003)。【本研究切入点】应用液相色谱—串联质谱和单四极气相色谱质谱检测丁硫克百威及其代谢物残留的报道较多(杨爽等, 2008;赵桦林等,2013;杨清华等,2017),而利用分散固相萃取法对芹菜中的丁硫克百威进行萃取,并使用气相色谱—串联质谱法检测的研究鲜见报道。丁硫克百威在芹菜中的代谢行为,以及大田芹菜的最终残留试验目前文献报道也较少。【拟解决的关键问题】以气相色谱—串联质谱为基础,研究芹菜中丁硫克百威快速检测方法;同时,针对实际生产中丁硫克百威应用较多和不合理的情况,评估其在露地大田芹菜中应用的安全性,进行田间最终残留试验,旨在探明芹菜中克百威檢出率较高的原因,验证丁硫克百威在露地芹菜中的最终残留量和最终代谢物,为该农药在芹菜上的用药登记工作提供参考依据。
1 材料与方法
1. 1 试验材料
供试芹菜样品由重庆市农业科学院试验基地提供。丁硫克百威、克百威和3-羟基克百威标准溶液(纯度≥95%,浓度均为1000 mg/L)购自农业农村部环境保护科研监测所,乙腈(色谱纯)购自天津四友精细化学品有限公司,氯化钠和无水硫酸镁(优级纯)购自上海国药化学试剂有限责任公司,实验用水均为一级水(美国Millipore公司,实验室制水系统),散装吸附剂乙二胺-N-丙基硅烷(PSA)和石墨化碳(GCB)购自Agilent公司。主要仪器设备:TSQ Quantum GC气相色谱—串联质谱仪(美国Thermo Fisher公司);Elix5超纯水系统(美国Millipore公司);SK-1快速混匀器(金坛市科析仪器有限公司);移液枪(德国Eppendorf公司);T18-B-S25匀浆仪(德国IKA公司);TP-402天平(美国Denver公司)。
1. 2 标准溶液配制
分别准确吸取1.0 mL 1000 mg/L的丁硫克百威、克百威和3-羟基克百威标准溶液,置于10 mL棕色容量瓶中,乙腈定容,稀释成100 mg/L单标溶液。分别取适量上述母液,用乙腈和空白基质溶液分别配制成丁硫克百威及其代谢物质量浓度为0.02、0.05、0.10、0.50、1.00和2.00 mg/L的混合系列标准工作溶液,置于4 ℃冰箱中保存,现配现用。
1. 3 基质效应计算
分别配置相同浓度梯度的溶剂标曲和基质标曲,浓度点位不少于5个。溶剂标曲和基质标曲采用同一个标准储备液进行稀释配制,两者仅配制溶剂不同,溶剂标曲采用仪器对应使用的纯溶剂进行配制,基质标曲采用对应前处理方法制备好的样品上机试液进行配制。溶剂和基质浓度点分别为10.0、25.0、50.0、100.0、200.0和1000.0 µg/L的基质效应按以下公式进行计算:
ME=[kmatrixksolvent-1]×100
式中,ME为基质效应(%),kmatrix为基质标曲斜率,ksolvent为溶剂标曲斜率。
1. 4 样品前处理
样品经食品料理机粉碎后密封备用。分别称取10 g样品置于50 mL离心管中,加入10.0 mL乙腈,匀浆2 min左右,加入2 g无水硫酸镁和2 g氯化钠,加盖剧烈振荡1 min左右,6000 r/min离心3min,吸取1.0 mL上清液备用。将上清液移入已装好针头式滤膜(混合尼龙膜,0.22 μm)的一次性医用注射器中(内装100 mg PSA、50 mg GCB),盖上注射器活塞推杆振摇1 min左右,再缓慢均匀地推动注射器推杆将提取液经滤膜挤压出针筒,收集滤液待测。
按照上述步骤,对GCB和PSA的用量组合(组合1:20 mg+50 mg;组合2:50 mg+50 mg;组合3:20 mg+100 mg;组合4:50 mg和100 mg)进行优化,考察其对农药回收率的影响。
1. 5 方法准确度和精密度
采用基质匹配标液和外标法定量。选择空白芹菜样品,进行3个水平的添加回收试验,每个水平重复5次,计算得到方法的相对标准偏差(RSD),即精密度。选择较低浓度的基质标准溶液进样,由化学工作站计算出各农药的信噪比(S/N),根据方法的定量限(LOQ)为10倍的信噪比(S/N=10)推算得出定量限LOQ。
1. 6 最终残留试验
参考农业行业标准NY/T 788—2004《农药残留试验准则》中的最终残留试验方法,于2016年10月在重庆市巴南区选取露地种植的芹菜,每处理小区面积20 m2,重复3次,同时设空白对照区,小区间设保护行。当芹菜生长至20 cm左右,用20%丁硫克百威乳油(20%好年冬乳油,美国富美实公司)以有效成分180 g/ha的剂量喷雾为低剂量组,设施药1次、施药2次和施药3次3个处理,分别于末次施药后1、3、5、7和14 d随机在各小区内采集芹菜1~2 kg。高剂量组为低剂量组的1.5倍,试验处理、采样时间和方法与低剂量组相同。
1. 7 仪器条件
毛细管色谱柱为HP-5MS石英毛细柱(30 m×0.25 mm×0.25 µm,美国Agilent公司);载气为氦气(纯度≥99.999%);恒流模式,流速1.0 mL/min;进样口温度250 ℃;不分流进样。柱程序升温:初始温度70 ℃,保持1 min,以10 ℃/min的速度上升至280 ℃,保持3 min;进样体积1.0 µL。
离子源为电子轰击(EI)源;轰击能量70 eV;碰撞气为氩气(纯度≥99.999%);传输线温度280 ℃;离子源温度250 ℃;发射电流50 μA;扫描模式为timed-SRM(定时选择性反应监测);扫描周期0.2 s;峰宽:Q1 0.7 Da,Q3 0.7 Da;碰撞气压力1.5 mTorr。
2 结果与分析
2. 1 质谱条件的优化
优化丁硫克百威及其代谢物气相色谱—串联质谱的定性定量离子对和碰撞能量,具体数据与标准图谱见表1和图1,表明丁硫克百威主要代谢物为克百威和3-羟基克百威,3种物质的色谱分离度很好,所选离子对丰度良好。
2. 2 丁硫克百威在样品基质中的稳定性
丁硫克百威的稳定性较差,在新配置的标准溶液中即有部分降解,主要降解产物为克百威。在实际农业生产中,使用丁硫克百威农药制剂进行喷雾后,2 h内即降解为克百威和微量的3-羟基克百威(赵桦林, 2013),最后其代谢产物趋于稳定,并缓慢降解。本研究以乙腈和芹菜基质分别配制100 µg/L的丁硫克百威标准溶液,采用所建立的仪器方法分别扫描两种标准标液。在乙腈中,丁硫克百威的稳定性较好,储存1 d后丁硫克百威向克百威的转化率仅为5%左右,未檢出3-羟基克百威;在芹菜基质中,3 d内丁硫克百威较稳定,随后绝大部分转化为克百威,转化率高达90%以上,同样未检出3-羟基克百威(图2)。
2. 3 净化填料的优化
在农药添加浓度为50.0 µg/kg的情况下,净化填料的优化结果如表2所示。当GCB用量达50 mg,样品溶液的色素几乎完全被吸附,同时发现PSA用量的增加对每种农药的回收率也有相应提高。除组合1的回收率较低外,其他3组的回收率差别不明显,但从实际效果来看,组合4除3-羟基克百威回收率略低外,其他农药的回收率均可达最高值,样品的净化程度对保护色谱的进样口和降低维护频率具有较大意义。综合考虑成本和净化效果,确定GCB和PSA的用量分别为50和100 mg。
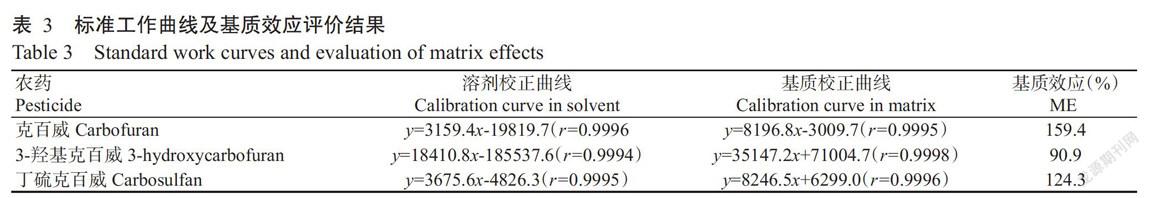
2. 4 基质效应
基质效应在-20%~20%为弱基质效应,在-50%~20%和20%~50%为中等基质效应,超过-50%或50%为强基质效应。由表3可知,丁硫克百威及其代谢物在芹菜基质中的基质效应均大于50%,呈强基质效应。
2. 5 方法的准确度和精密度
对建立方法的准确度、精密度和LOQ进行检测,结果见表4,芹菜中克百威的LOQ为4.8 µg/kg,添加回收率为90.5%~119.0%,RSD为3.7%~9.6%;3-羟基克百威的LOQ为8.0 µg/kg,添加回收率为92.0%~103.5%,RSD为1.8%~5.3%;丁硫克百威的LOQ为5.5 µg/kg,添加回收率为83.8%~110.3%,RSD为2.7%~10.2%。表明建立的气相色谱—串联质谱法的准确度和精密度符合残留分析要求。
2. 6 丁硫克百威在露地芹菜中的最终残留量
本研究以丁硫克百威在登记蔬菜甘蓝(叶菜)上推荐最高剂量为试验的低剂量组,1.5倍的推荐最高剂量为高剂量组。由于丁硫克百威在芹菜基质中的不稳定性,在施药后1 d采集的样品中发现丁硫克百威已全部代谢为克百威,未检出3-羟基克百威,因此试验中仅考察代谢物克百威的残留量。目前,我国GB 2763—2016《食品中最大农药残留限量》标准中叶类蔬菜中克百威的最大残留限量值(MRL)为0.02 mg/kg。
低剂量组中,在末次施药后第5 d(5 d之前所有施药处理均高于克百威的限量值),施药1次处理芹菜的克百威残留量为0.018 mg/kg,处于限量临界值;施药2次和施药3次处理的克百威残留量分别为0.035和0.062 mg/kg,均高于MRL;末次施药后第14 d,施药1次、施药2次和施药3次处理中的克百威残留量分别为未检出、0.009和0.017 mg/kg,均低于MRL。高剂量组中,在末次施药后第14 d测得施药1次、施药2次和施药3次处理的克百威残留量分别为0.026、0.056和0.089 mg/kg;以克百威计,则3种施药次数的处理均高于叶类蔬菜中克百威的MRL,安全风险较大。
3 讨论
样品前处理是分析检测技术的关键,传统的前处理技术在整个分析检测过程中占据了大量时间。近年来兴起的QuEChERS(Quick、Easy、Cheap、Effe-ctive、Rugged、Safe)法(Anastassiades et al.,2003)和分散固相萃取法(Liu et al.,2014)等前处理方法,伴随着仪器技术的进步,极大提高了样品分析检测速度。但分散固相萃取法需经过提取、多次转移提取液、多次离心和净化等步骤,特别是离心步骤较多。有学者在医用注射器中装入净化材料,将样品提取液吸入注射器中,再将提取液挤出注射器,达到快速净化的目的(Qin et al.,2015)。本研究在此基础上进行改进,直接将净化填料加入注射器中,同时加入针头式复合滤膜组合成一套更简便的净化装置,随后将提取液直接转入组装好的注射器针筒中,使用推杆挤出提取液,使样品提取液的净化和过滤等过程一次性完成,避免了传统分散固相萃取法中频繁使用离心机进行离心的步骤,进一步提高前处理效率(褚能明等,2016),构建了方便、有效的残留检测方法。
克百威属禁限用农药,我国食品安全国家标准GB 2763—2016《食品中农药最大残留限量》中只规定了叶类蔬菜中克百威的MRL为0.02 mg/kg,而在芹菜中没有限量标准;丁硫克百威在芹菜上的限量为0.05 mg/kg,但在芹菜上还未登记使用。国际上有关丁硫克百威的残留物定义略有不同,其问题主要集中在是否将代谢物换算成母体化合物来表示,因此导致采用限量判定标准也不同。我国关于农药的食品安全国家标准规定丁硫克百威的残留物为该农药的母体,不包括其代谢物;而丁硫克百威的残留物为克百威和3-羟基克百威,残留量以克百威表示,这种定义与国际食品法典委员会(CAC)(FAO,2015)、欧盟(EU,2018)的定义一致。但是日本肯定列表(The Japan Food Chemical Research Foundation,2018)对丁硫克百威残留物规定为丁硫克百威及其代谢物(克百威、3-羟基克百威)之和,并说明如果产品中检测出丁硫克百威,则所有检测出的克百威和3-羟基克百威均需折算成丁硫克百威残留量。对于市场中某种农产品若同时检出丁硫克百威和克百威两种农药,按照日本肯定列表的方法则折算成丁硫克百威的MRL来判定是否超标;而CAC、欧盟和我国会分别按照两种农药的MRL判定,可能是导致在农药残留监测时克百威超标的原因之一。
日常农产品质量安全监测中芹菜样品克百威检出率较高,主要来源是丁硫克百威在使用过程中的代谢。排除丁硫克百威的不科学使用和安全间隔期不合理等原因外,其最大的可能是多次施药,或不按规定高剂量、过度施药造成。本研究的最终残留试验结果表明,丁硫克百威最终转化为毒性更大的克百威,按照推荐剂量施用,用药1次的安全间隔期为5 d以上,2~3次的用药频率安全间隔期在14 d以上;用药剂量为推荐剂量1.5倍时,发现在末次用药14 d时其安全风险仍然较大,不推荐如此使用。本研究仅进行一种栽培模式、一地一年的试验,目的是用于验证丁硫克百威在芹菜上的安全性,并不是完整的最终残留试验,今后应进行多地多年最终残留试验以便于继续评估其安全性。
4 结论
本研究在前人的研究基础上,利用分散固相萃取技术和简易的净化工具,建立了芹菜中丁硫克百威及其代谢物的快速检测技术,该方法的回收率、精密度和最小检出限均能满足农药残留量分析要求,且样品前处理快速高效,整个检测分析过程可在30 min内完成。丁硫克百威在芹菜上的最终残留试验结果表明,按照我国现行最大农药残留限量标准,以丁硫克百威有效成分180 g/ha的剂量喷雾1次,建议安全间隔期在5 d以上,喷雾2次以上则安全间隔期在14 d以上,应尽快推进该农药在芹菜上的用药登记工作。
参考文献:
褚能明,孟霞,康月琼,唐偲雨,杨俊英. 2016. 分散固相萃取—气相色谱—串联质谱法测定茉莉花茶中86种农药残留[J]. 食品科学,37(24):239-246. [Chu N M,Meng X,Kang Y Q,Tang S Y,Yang J Y. 2016. Determination of 86 pesticide residues in jasmine tea by dispersive solid-phase extraction combined with gas chromatography-tandem mass spectrometry[J]. Food Science,37(24):239-246.]
郎朗,孟慶良,高国训,肖瑜,黄亚杰. 2017. 保护地芹菜主要病虫害为害症状及防治方法[J]. 长江蔬菜,(11):58-59. [Lang L,Meng Q L,Gao G X,Xiao Y,Huang Y J. 2017. Symptoms and control methods of main diseases and insect pests of celery in protected fields[J]. Journal of Changjiang Vegetables,(11):58-59.]
刘晓亮,郭泽旺,黄璐璐,封国君,王彦辉,曾东强,黄永禄. 2016. 多壁碳纳米管分散固相萃取气相色谱法检测蔬菜中23种农药残留[J]. 南方农业学报,47(3):401-406. [Liu X L,Guo Z W,Huang L L,Feng G J,Wang Y H,Zeng D Q,Huang Y L. 2016. Detection of 23 pesticides in ve-getables by multi-walled carbon nanotubes dispersive solid phase extraction combined with gas chromatography[J]. Journal of Southern Agriculture,47(3):401-406.]
朴秀英,吕宁,林荣华,宗伏霖,刘学. 2015. 克百威、丁硫克百威和丙硫克百威登记现状及其潜在风险关注分析[J]. 农药科学与管理,36(4):10-16. [Piao X Y,Lü N,Lin R H,Zong F L,Liu X. 2015. Analysis of registration status and potential risk concerns of carbofuran,carbosulfan and benfuracarb[J]. Pesticide Science and Administration,36(4):10-16.]
秦冬梅,龚勇. 2000. 好年冬在甘蓝及土壤中残留动态[J]. 农药科学与管理,21(1):21-23. [Qin D M,Gong Y. 2000. Study on the residue dynamics of marshal in the cabbage and soil[J]. Pesticide Science and Administration,21(1):21-23.]
谢小真. 2016. 青岛曝光44批次不合格食品[EB/OL]. (2016-09-01)[2018-10-11]. http://news.qingdaonews.com/qing-dao/2016-09/01/content_11742714.htm. [Xie X Z. 2016. Qingdao exposed 44 batches of disqualification food[EB/OL]. (2016-09-01)[2018-10-11]. http://news.qingdaonews.com/qingdao/2016-09/01/content_11742714.htm.]
徐应明,李军幸,李卫国,王立,黄永春,戴晓华. 2003. 丁硫克百威在韭菜和土壤中的残留动态研究[J]. 农业环境科学学报,22(4):484-487. [Xu Y M,Li J X,Li W G,Wang L,Huang Y C,Dai X H. 2003. Residual dynamics of carbosulfan in Chinese chives and soils[J]. Journal of Agro-Environment Science,22(4):484-487.]
杨清华,史玉坤,施逸岚,杨梅桂. 2017. 气相色谱—质谱联用测定蔬菜中克百威、三羟基克百威及丁硫克百威残留[J]. 中国卫生检验杂志,27(11):1539-1541. [Yang Q H,Shi Y K,Shi Y L,Yang M G. 2017. Determination of the carbofuran,3-Hydroxycarbofuran and carbosulfan re-sidues in vegetables by gas chromatography mass spectrometry[J]. Chinese Journal of Health Laboratory Technology,27(11):1539-1541.]
杨爽,刘新刚,董丰收,郑玮,郑永权. 2008. GC-MS方法检测辣椒中丁硫克百威及代谢产物的残留[J]. 农药,47(7):515-516. [Yang S,Liu X G,Dong F S,Zheng W,Zheng Y Q. 2008. Residue analysis of carbosulfan and metabolites in capsicum using GC-MS method[J]. Agrochemicals,47(7):515-516.]
赵桦林. 2013. 丁硫克百威在黄瓜和白菜中的残留代谢行为研究[D]. 北京:中国农业科学院. [Zhao H L. 2013. Study on residue and metablisam of carbosulfan in cucumber and Chinese cabbage[D]. Beijing:Chinese Academy of Agricultural Sciences.]
趙桦林,邱静,王敏,杨曙明,柴婷婷,叶小兰. 2013. 加速溶剂萃取—液相色谱—串联质谱法同步检测白菜中的丁硫克百威及其代谢物残留[J]. 农药学学报,15(2):204-210. [Zhao H L,Qiu J,Wang M,Yang S M,Chai T T,Ye X L. 2013. Simultaneous determination of carbosulfan and its metabolites in Chinese cabbage by ASE-LC-MS/MS[J]. Chinese Journal of Pesticide Science,15(2):204-210.]
Anastassiades M,Lehotay S J,Stajnbaher D,Schenck F J. 2003. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and “dispersive solid-phase extraction” for the determination of pesticide residues in produce[J]. Journal of AOAC International,86(2):412-431.
Brooks M W,Barros A. 1995. Determination of carbosulfan in oranges by high-performance liquid chromatography with post-column fluorescence[J]. The Analyst,120(10):2479-2481.
EU. 2018. EU-pesticides database[EB/OL]. [2018-10-11]. http://ec.europa.eu/food/plant/pesticides/eu-pesticides-database/public/?event=download.MRL.
FAO. 2015. List of pesticides evaluated by JMPR and JMPS[EB/OL]. [2018-10-11]. http://www.fao.org/agriculture/crops/core-the-mes/theme/pests/lpe/en/.
Liu X,Guan W B,Hao X H,Wu X L,Ma Y Q,Pan C P. 2014. Pesticide multi-residue analysis in tea using d-SPE sample cleanup with graphene mixed with primary se-condary amine and graphitized carbon black prior to LC-MS/MS[J]. Chromatographia,77(1-2):31-37.
Qin Y H,Zhao P Y,Fan S F,Han Y T,Li Y J,Zou N,Song S Y,Zhang Y,Li F B,Li X S,Pan C P. 2015. The comparison of dispersive solid phase extraction and multi-plug filtration cleanup method based on multi-walled carbon nanotubes for pesticides multi-residue analysis by liquid chromatography tandem mass spectrometry[J]. Journal of Chromatography A,1385:1-11.
Soler C,Hamilton B,Furey A,James K J,Mañes J,Picó Y. 2006. Optimization of LC-MS/MS using triple quadrupole mass analyzer for the simultaneous analysis of carbosulfan and its main metabolites in oranges[J]. Analytica Chimica Acta,571(1):1-11.
The Japan Food Chemical Research Foundation. 2018. The Japanese positive list system for agricultural chemical re-sidues in foods[EB/OL]. [2018-10-11]. http://www.ffcr.or.jp/zaidan/FFCRHOME.nsf/pages/MRLs-p.
(責任编辑 罗 丽)

