草莓响应炭疽菌侵染的差异磷酸化蛋白质组学分析
余红,严建立,裘劼人,王淑珍,忻雅,童建新,来文国,方献平,2*
(1.杭州市农业科学研究院生物技术研究所,杭州 310024;2.上海市农业科学院林木果树研究所,上海 201403)
炭疽病是目前草莓生产中最具威胁性的病害之一,常造成田间草莓苗大量死亡,严重影响草莓生产的经济效益。草莓炭疽病病原种类主要有草莓炭疽菌(Colletotrichum fragariae)、尖孢炭疽菌(C.acutatum)和胶孢炭疽菌(C.gloeosporioides)[1]。目前,针对炭疽病的治理主要以药物防治为主,但药物防治成本高,还造成环境污染,不是解决问题的长久之策。利用优良抗性基因资源,改良草莓品种是防治炭疽病最为经济有效的办法;而优良抗性基因资源的确定和利用取决于人们对草莓抗病机制的深入了解。
研究者通过转录组学技术发现,尖孢炭疽菌侵染使得草莓根冠部273个基因发生了明显的差异表达[2],草莓果实中也有44个基因发生了显著变化,这些基因涉及信号转导、转录调控和防御反应等各方面[3]。以上研究从转录水平上分析了草莓-炭疽病的互作关系,然而蛋白质是生命活动的直接执行者,可以更为直接地反映植物与病菌的互作变化过程[4]。已经有很多研究者借助双向电泳技术探究了多种植物在感病前后的蛋白质差异变化水平[5-7]。本课题组前期也利用双向电泳技术比较了在草莓炭疽菌侵染条件下草莓叶片的蛋白质表达变化,发现草莓叶片内的一种小分子热激蛋白在病菌防御过程中发挥着重要作用[8]。蛋白质组学在研究内容上包括蛋白质鉴定与定量、蛋白质翻译后修饰(post translational modification,PTM)和蛋白质间相互作用等。其中,PTM直接决定着蛋白质的高级结构,不仅影响到蛋白质本身的生化性质,还对其亚细胞定位及与其他大分子物质的相互作用产生重要的影响,进而改变其活性和功能。PTM使蛋白质的结构更为复杂,功能更为完善,调节更为精细,作用更为专一[9]。作为众多PTM中最值得关注的一种翻译后修饰类型,蛋白质磷酸化是细胞信号系统的重要组成部分之一,它往往参与植物生长发育、细胞分化、刺激应答和抗逆调控等各个生物学过程[10]。植物病原菌释放的致病因子和病毒素均易诱发植物蛋白质的磷酸化反应,所以对植物抗病信号系统中磷酸化发生的生物学功能进行系统、深入的研究,将会具有重要的指导意义[11]。
草莓品种‘红颊’果实口感鲜美,却易感炭疽病,而‘甜查理’品种植株矮小,却对炭疽病表现出高度的抗性。随着现代生命科学技术的发展,基于液相色谱-质谱联用的蛋白质组学技术已经逐渐取代双向电泳技术,成为当今蛋白质组学研究中的主流手段之一。为进一步探索不同草莓品种对炭疽菌的抗性机制,本研究利用基于液相色谱-质谱联用的非标记定量磷酸化蛋白质组学技术,比较不同抗性草莓茎组织对炭疽菌响应的磷酸化蛋白表达差异,以期找出草莓植株对炭疽菌特异响应的差异磷酸化蛋白和相关的磷酸化信号通路,探索其抗病机制,为今后抗病基因克隆和分子育种奠定重要的研究基础。
1 材料与方法
1.1 试验材料及取样
试验用草莓品种‘红颊’和‘甜查理’4叶期幼苗由浙江省杭州市农业科学研究院生物技术研究所草莓生产基地提供。胶孢炭疽菌株从感病的草莓植株中分离得到,并通过形态学和序列分析进行鉴定,以0.001%体积分数的吐温-80为溶剂制成浓度为5.0×106CFU/mL的菌悬液,喷洒于草莓幼苗植株茎部进行病菌感染。同时,设对照组,喷洒液为0.001%体积分数的吐温-80。接菌处理后将植株移入大棚继续生长,保持棚内湿度在80%左右,7 d后取茎组织为试验材料。每5株幼苗茎部组织取样混合作为1个生物学重复,每个样本设3个生物学重复。
1.2 蛋白质的提取及定量
称取新鲜茎组织10.0 g左右,在液氮中研磨成细粉,分装入40 mL离心管中,加入10 mL左右蛋白质提取液Ⅰ(含10%三氯乙酸和0.07%β-巯基乙醇的丙酮溶液)以沉淀粗蛋白(-20℃,1 h),在4℃、1.3×104r/min下离心20 min;再加入相同体积蛋白质提取液Ⅱ(含0.07%β-巯基乙醇的丙酮溶液)悬浮粗蛋白(-20 ℃,1 h),在4 ℃、1.3×104r/min下离心20 min;取沉淀,弃上清液,重复用蛋白质提取液Ⅱ悬浮清洗3次(-20℃,1 h)。真空抽干得粗蛋白干粉,并称取0.5 g粉末,加入10 mL裂解液[8 mol/L尿素、10 mmol/L二硫苏糖醇(DTT)、2 mmol/L乙二胺四乙酸(EDTA)和1 mmol/L苯甲基磺酰氟(PMSF)]中,振荡混匀,4℃放置1 h,其间取出振荡3~5次,在20 ℃、1.3×104r/min下离心15 min,弃沉淀不溶物,取上清液。用考马斯亮蓝染色法[12]进行蛋白质定量,并用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测提取的总蛋白质量,分装并保存于-80℃冰箱中,备用。
1.3 还原烷基化、胰酶酶解与C18柱除盐
取约5.0 mg蛋白样本,按1∶10体积比加入100 mmol/L二硫苏糖醇至终浓度10 mmol/L,56℃还原反应1 h。冷却至室温后,按1∶10体积比加入500 mmol/L碘代乙酰胺至终浓度50 mmol/L,避光反应45 min。按1∶10体积比加入100%的三氯乙酸至终体积分数为10%,4℃沉淀2 h;用冷丙酮洗3次后离心得沉淀颗粒,溶于100 mmol/L NH4HCO3中,超声5 min。在此蛋白混合物中,按酶与蛋白质量比1∶50加入胰蛋白酶,37℃反应12 h。酶解后的肽段经C18固相萃取柱(SPE柱)(Qiagen公司,德国)除盐后进行真空干燥。
1.4 磷酸化肽段的富集
用1mL上样缓冲液[60%乙腈(acetonitrile,ACN),2%三氟乙酸(trifluoroacetic acid,TFA),饱和谷氨酸,pH 2.0)]将除盐后的肽段重溶到1.5 mL离心管中,加入10 mg二氧化钛(titanium dioxide,TiO2)柱料[m(肽段)∶m(TiO2)=1∶2],于室温上下颠倒20~30 min(柱料事先用上样缓冲液平衡)。离心弃上清液,向柱料中加500 μL洗涤缓冲液Ⅰ(60%ACN,0.5%TFA,pH 2.5),于室温上下颠倒20 min;离心弃上清液,向柱料中加500 μL洗涤缓冲液Ⅱ(60%ACN,0.1%TFA,pH 3.0),于室温上下颠倒20 min。离心弃上清液,向柱料中加500 μL洗脱缓冲液Ⅰ(50%ACN,300 mmol/L氨水,pH 11.0),于室温上下颠倒20 min。离心将洗脱液(磷酸化肽段)转移至新的离心管,向柱料中加500 μL洗脱缓冲液Ⅱ(50%ACN,500 mmol/L氨水,pH 11.0),室温上下颠倒20 min后,离心将洗脱液(磷酸化肽段)转移至新的离心管;将洗脱液高速离心5 min,弃柱料沉淀,将富集的磷酸化肽段转入新的1.5 mL离心管中,真空干燥。
1.5 液相色谱-质谱联用分析
真空干燥后的肽段用0.1%甲酸水溶液溶解后使用EASY-nLC 1000超高效液相系统(Thermo Fisher Scientific公司,美国)进行分离。流动相A为含0.1%甲酸(formic acid,FA)和2%ACN的水溶液;流动相B为含0.1%FA和98%ACN的水溶液。液相梯度设置:5%~8%,6 min;8%~30%,34 min;30%~60%,5 min;60%~80%,3 min;80%,7 min平衡;80%~5%,3 min;5%,7 min平衡。流速维持在200 nL/min。肽段经由超高效液相系统分离后被注入NSI离子源中进行电离,然后用Q ExactiveTM质谱仪(Thermo Fisher Scientific公司,美国)进行分析。离子源电压设置为2.0 kV,肽段母离子及其二级碎片都使用高分辨的Orbitrap进行检测和分析,每个一级谱图自动选择3个最强母离子进行二级扫描。为了提高质谱的有效利用率,自动增益控制设置为3E4,信号阈值设置为1×104ions/s,最大注入时间设置为200 ms,串联质谱扫描的动态排除时间设置为30 s,以避免母离子的重复扫描。
1.6 蛋白质定性与定量的数据库搜索分析
二级质谱数据使用Proteome Discoverer 1.4软件进行检索。检索参数设置:数据库为NCBI草莓蛋白数据库(https://www.ncbi.nlm.nih.gov/protein/?term=txid101020%5BOrganism%5D),添加反库以计算随机匹配造成的错误发现率,在数据库中加入常见的污染库,用于消除鉴定结果中污染蛋白的影响。借助Thermo Fisher Sieve 2.2软件对差异表达的磷酸化蛋白进行相对定量,以峰面积作为每条磷酸化肽段的定量值,差异定量标准必须满足接菌组蛋白/对照组蛋白>1.50或<0.67,且P<0.05。
1.7 差异磷酸化蛋白修饰位点的模序富集分析
模序(motif)是指氨基酸序列中的一些作用位点,比如酶的活性位点、修饰位点及具有序列特异性的蛋白结合位点(如转录因子)或者涉及重要生物过程(如RNA起始、终止、剪切)的位点等。利用软件Motif-X(http://motif-x.med.harvard.edu)对鉴定到的磷酸化肽段进行模式富集分析,将氨基酸长度设置为13,模序序列出现的频次≥20,以本次鉴定到的全部蛋白质数据作为背景数据。
1.8 差异磷酸化蛋白的信息注释与功能分类
利用Uniprot蛋白数据库(http://www.ebi.uniprot.org)对所鉴定到的各磷酸化蛋白进行基因本体(gene ontology,GO)分析,依据蛋白参与的生物学过程(biologicalprocess)、细胞学组分(cellularcomponents)和分子功能(molecular function)属性,对不同抗性草莓品种响应病菌感染的差异磷酸化蛋白分别进行GO注释和功能分类。
1.9 差异磷酸化蛋白的功能富集
以鉴定到的蛋白质为背景,借助费歇尔精确双端检验方法(Fisher’s exact test)用于检验差异表达蛋白的显著性,分别进行GO富集、京都基因和基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析。P值小于0.05被认为是显著的。最后根据KEGG网站(https://www.kegg.jp)通路层级分类方法将这些通路进行分类。
2 结果与分析
2.1 炭疽病菌侵染后不同草莓品种茎部组织变化
炭疽病菌一般最先感染草莓苗根部,然后逐渐侵染植株其他部位。易感品种‘红颊’在病菌侵染7 d后茎部出现了部分明显病斑,而高抗品种‘甜查理’在接种病菌处理后并未出现明显病征,仅仅茎部出现部分红化现象(图1)。
2.2 磷酸化蛋白和磷酸化肽段的定性鉴定概况
对接种病菌处理和对照的2种草莓植株茎部取样后进行差异磷酸化组学分析。总共定性鉴定到磷酸化蛋白619个,磷酸化肽段781条,共计922个磷酸化修饰位点。其中鉴定到的发生在丝氨酸、苏氨酸和酪氨酸上的磷酸化修饰位点分别为779、124和19个,分别占比84.49%、13.45%和2.06%(图2A)。此外,对每条肽段发生磷酸化修饰个数进行统计发现,只发生1个磷酸化位点修饰的磷酸化肽段有687条,含有2个磷酸化修饰位点的肽段有68条,含有3个磷酸化修饰位点的肽段有13条,含有4、6和9个磷酸化修饰位点的肽段分别有9、2和2条(图2B)。

图1 病菌易感草莓品种‘红颊’和抗性品种‘甜查理’在对照和接种炭疽病菌后的病征变化Fig.1 Symptom induced by mock-infection and C.gloeosporioides infection in disease-susceptible strawberry cultivar‘Benihopp’and resistant cultivar‘Sweet Charlie’

图2 鉴定到的磷酸化位点分布统计图Fig.2 Distribution chart of identified phosphorylation sites
2.3 差异磷酸化蛋白和磷酸化肽段的定量统计
对定性得到的肽段进一步开展定量统计分析和计算,在1.5倍差异倍数(fold change,FC)且P<0.05阈值条件下,进行差异磷酸化肽段筛选。其中:FC≥1.5且P<0.05为表达量上调,FC≤0.667且P<0.05为表达量下调,0.667<FC<1.5或者P>0.05为表达量无明显变化。在炭疽病菌感染后,‘红颊’茎部总共有154条磷酸化肽段发生1.5倍以上差异表达变化,其中86条上调,68条下调;‘甜查理’茎部总共有173条磷酸化肽段发生了1.5倍以上差异表达变化,其中126条上调,47条下调(表1)。对发生差异表达的肽段进一步统计发现,‘红颊’和‘甜查理’中分别有24条和37条肽段磷酸化水平差异变化倍数达到了3倍以上(表1;附表1,http://www.zjujournals.com/agr/CN/10.3785/j.issn.1008-9209.2018.10.151)。

表1 差异表达磷酸化修饰肽段数统计Table 1 Summary of differentially expressed phosphorylated peptides
2.4 差异磷酸化蛋白的模序富集分析
利用Motif-X软件对差异磷酸化修饰的肽段进行重点分析,旨在进一步探索不同品种草莓响应炭疽病菌侵染的蛋白磷酸化修饰位点的偏好性。
分析发现,‘红颊’品种中差异磷酸化肽段集中修饰的氨基酸保守域主要包括3种类型:S*F、F*S和T*D(图3A)。S*F类型的磷酸化修饰肽段主要有LDDILESLFEEYL、GGLASESLFVGYN和LVAVVG SEFVQYL等;F*S类型的磷酸化肽段有LLERFYS LTSLDP、GFEDFRSGYEEAL和SRNDFGSIDILVH等;T*D类型的肽段包括NNCHPQTIDICTF、NNCHPQTIDICTR、RLTGHETADINTF和IVGILET DDIVLI等。
而在高抗品种‘甜查理’中,氨基酸保守域主要包括S*F、S*Y和T*F 3种类型(图3B)。S*F类型的磷酸化修饰肽段主要有NILFVISPDVFDQ、AQAGD RSITDFGS和RETTEISEGMFSP等;S*Y类型的磷酸化肽段有NYMMMTSGEAVYY、EIVEVSSYLAH YL、NGGGANSVAHGYT和LAHPSLSTFNHYL等;T*F类型的肽段包括AMNPINTVFDANQ、LNLVQ TTPFDGQP和LAAEYETVFYYVD等。
2.5 差异磷酸化蛋白的功能分类与代谢通路富集分析
我们进一步对差异磷酸化蛋白进行了功能注释,按照细胞成分、分子功能和生物学过程进行了分类。结果发现:炭疽病菌高抗品种‘甜查理’的磷酸化现象更多地聚集在大分子复合体、具有结构分子活性的结构中,并更多地参与了生物学定位过程;而易感品种‘红颊’的差异磷酸化蛋白具有结构分子活性和定位功能,但更多地聚集在细胞器中(图4)。归类结果表明,不同品种响应病菌侵染发生差异磷酸化的主要亚细胞部位有所区别。
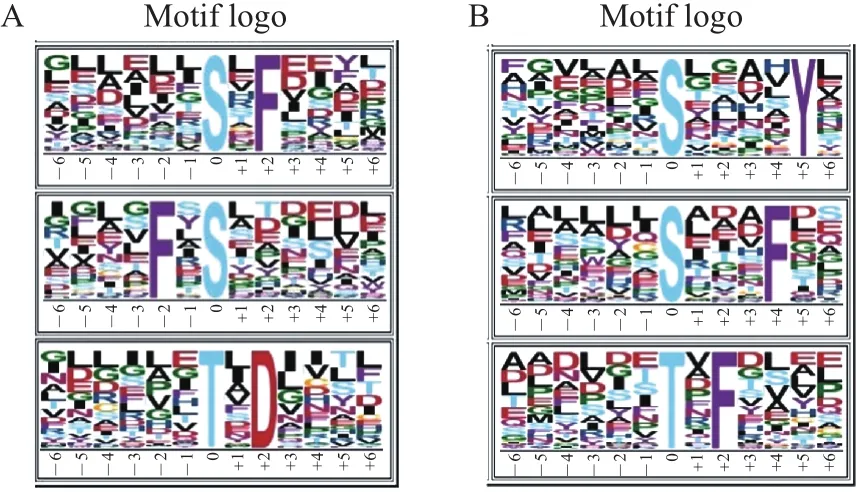
图3‘红颊’(A)和‘甜查理’(B)差异磷酸化肽段的保守域分析Fig.3 Motif analysis of differentially expressed phosphorylated peptides in‘Benihopp’(A)and‘Sweet Charlie’(B)
以鉴定到的蛋白为背景,利用KEGG网站对差异磷酸化蛋白进行代谢通路富集分析。结果显示:在易感品种‘红颊’中,光合作用、糖酵解和氧化磷酸化3条代谢通路富集程度最高,而在高抗品种‘甜查理’中,植物激素信号传导途径、碳固定和糖酵解3条通路富集程度最高(图5)。这一结果提示,在植物激素信号传导途径中关键蛋白的高度磷酸化在草莓抵御病菌侵染过程中发挥着重要作用。
3 讨论
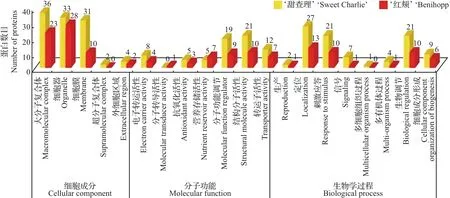
图4 差异磷酸化蛋白的GO功能归类分析Fig.4 GO functional category analysis of differentially expressed phosphorylated proteins
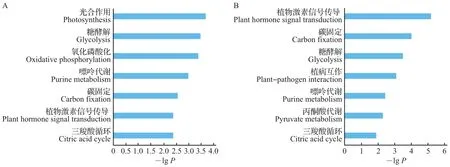
图5‘红颊’(A)和‘甜查理’(B)响应炭疽菌侵染的差异磷酸化蛋白的KEGG通路富集分析Fig.5 KEGG pathway enrichment analysis of differentially expressed phosphorylated proteins in‘Benihopp’(A)and‘Sweet Charlie’(B)
蛋白翻译后修饰密切参与了植物生长发育、信号转导和逆境应答过程,它极大地增加了蛋白质种类的多样性,使得生物学调控过程变得更为精密[9-10],所以蛋白翻译后修饰组学的研究对于进一步深入探析植病互作机制具有非常重要的意义。蛋白质磷酸化修饰是众多PTM类型中最为主要的一种修饰类型[10]。蛋白质磷酸化修饰现象十分普遍,人类基因组中2%的编码基因和拟南芥基因组中近6%的编码基因都能编码磷酸化修饰相关蛋白[13]。虽然磷酸化蛋白质组已经成为当前蛋白质组学研究中的一个热点内容,但在实际操作中,酶解后的磷酸化肽段会带上负电导致质谱过程质子化的难度增加[14],所以开发并应用高效的磷酸化蛋白/肽段分离富集方法将是推动磷酸化蛋白质组学发展的关键技术问题之一。二氧化钛富集法是时下最为成熟的磷酸化肽段分离富集技术。科学家已经运用该富集方法在Hela细胞中鉴定到了512个磷酸化蛋白中的617个磷酸化位点[15],在拟南芥质膜中定量到了472个磷酸化蛋白中的1 172条磷酸化肽段[16],在拟南芥幼苗中鉴定了61个磷酸化蛋白中的224条磷酸化肽段[17]。本研究应用二氧化钛富集法总共定性鉴定到619个磷酸化蛋白中的781条磷酸化肽段和922个磷酸化修饰位点。当然,也有学者利用抗磷酸化酪氨酸抗体和固相金属离子亲和色谱法等手段,鉴定了一系列的蛋白磷酸化位点[18-20]。
本研究鉴定到的发生在丝氨酸、苏氨酸和酪氨酸上的磷酸化修饰位点占比依次为84.49%、13.45%和2.06%。现有的拟南芥研究结果显示,三者的比例为85%、10.7%和4.4%[21],在水稻中也发现了类似的现象[22]。虽然丝氨酸和苏氨酸发生磷酸化的比例高于酪氨酸,但酪氨酸一旦发生磷酸化,其修饰程度往往比前两者更加稳定[23]。为了分析在磷酸化位点附近的氨基酸序列特性,我们利用Motif-X工具分析发现,高抗品种‘甜查理’存在2种特异的保守序列类型S*Y和T*F。有研究显示,很多特异保守模序(motif)的磷酸化蛋白基本上位于细胞质和细胞核中,它们的底物通常是一系列包括逆境信号转导途径中MPK、CDK、CDPK、RLK、AGC和 SLK在内的激酶[24]。另外,在本研究中,几类重要功能蛋白的磷酸化水平在炭疽病菌侵染后都发生了显著的变化。与易感品种‘红颊’不同,‘甜查理’中的休眠/生长素相关家族蛋白在其氨基酸肽段的第447和896位都发生了高度磷酸化,丰度是炭疽病菌侵染样本前的7.3和9.7倍。休眠/生长素相关家族蛋白往往在植物生长过程中起重要作用,也在外界环境胁迫刺激过程中发挥调控作用[25],该蛋白磷酸化水平的上调有助于进一步提高其蛋白活性,发挥相应的生物学功能。本研究还在‘甜查理’中鉴定到一种细胞壁结构蛋白发生了显著的磷酸化增高现象,它的磷酸化丰度上调了12.27倍。我们推测病菌的侵染使得细胞壁蛋白发生了急剧的磷酸化,从而第一时间向胞内传递信号,影响细胞内的代谢活动[26]。同时,我们发现‘红颊’中真核细胞蛋白翻译起始因子eIF-5A在病菌侵染后发生了强烈去磷酸化现象,丰度足足下降了4.83倍。eIF-5A在真核细胞中普遍存在,广泛参与了细胞增殖、mRNA降解和胁迫应答等过程。有多项研究证实,转eIF-5A基因的拟南芥植株生长能力特别强[27],能表现出强烈的氧化胁迫和渗透胁迫抗性[28]。由此可以看出,炭疽菌的侵染使得‘红颊’植株体内的eIF-5A发生了显著的去磷酸化现象,从而抑制了eIF-5A的活性,进一步阻碍了相关抗性蛋白的翻译,为病菌的迅速侵染和繁殖提供了便利条件。
4 结论
本研究借助非标记定量磷酸化蛋白质组学技术,分析了不同抗性草莓品种在炭疽菌侵染胁迫前后的茎部磷酸化蛋白组变化。在易感、高抗品种中分别鉴定到154个和173个显著差异磷酸化蛋白,揭示出植物激素信号传导途径和碳固定代谢通路在防御病菌入侵过程中发挥了重要作用。该成果为后续深入揭示草莓-炭疽病菌互作分子机制及草莓抗病新品种选育奠定了重要的理论研究基础。

