表没食子儿茶素促进Nrf2的核转位减轻Aβ25-35对SH-SY5Y细胞的损伤
张 雯,宋俊科,朱晓瑜,杨海光,王海港,许启泰,杜冠华
(1. 中国医学科学院北京协和医学院药物研究所,天然药物活性物质与功能国家重点实验室,药物靶点研究与新药筛选北京市重点实验室,北京 100050;2.海南绿槟榔科技发展有限公司,海南 定安 571200)
阿尔兹海默病(Alzheimer′s disease,AD)是一种与年龄相关的,隐匿发展的神经系统退行性疾病,给家庭和社会带来沉重的负担[1]。AD的特征性病理变化为胞内神经纤维缠结,胞外β淀粉样(amyloid β protein,Aβ)沉积,神经元损伤及突触减少。Aβ为AD病理进程的关键因素,Aβ的神经毒性及其诱导的蛋白级联反应对AD的发生发展具有重要作用[2]。
研究表明,多酚类化合物具有很强的抗氧化能力,能够清除细胞内自由基,发挥神经保护作用[3-5]。此外,多酚类化合物中的某些成分还能够减少Aβ生成、促进Aβ消除,保护神经元免受Aβ神经毒性[6-8]。以往的文献中,对表没食子儿茶素没食子酸酯的研究较多,但对表没食子儿茶素(epigallocatechin,EGC)研究较少。EGC作为一种多酚类化合物,广泛存在于茶叶、槟榔等植物中,其是否能够减轻Aβ对神经细胞的损伤,未见报道。因此,本实验选择SH-SY5Y细胞为研究对象,研究EGC对Aβ25-35诱导SH-SY5Y细胞损伤的保护作用及机制。
1 材料与方法
1.1 材料
1.1.1药物与试剂 EGC(HPLC>98%), 购自上海源叶生物科技有限公司;DMEM/F12培养基、胎牛血清(fetal bovine serum,FBS)、2′,7′-二氯荧光黄双乙酸盐(2′,7′-dichlorofluorescin diacetate,DCFH-DA),均购自Thermo Scientific公司;Aβ25-35、Hoechst 33258、MTT、氮乙酰半胱氨酸(N-acetylcysteine,NAC),均购自Sigma公司;蛋白裂解液、β-actin抗体,均购自Cell Signaling Technology公司;乳酸脱氢酶(lactate dehydrogenase,LDH )细胞毒性检测试剂盒,购自碧云天生物技术公司;核因子E2相关因子2(nuclear factor erythroid-derived 2-like 2,Nrf2)、血红素氧合酶-1(hemeoxygenase-1,HO-1)、醌氧化还原酶1(NADPH:quinone oxidoreductase 1,NQO1)、过氧化物还原酶6(peroxiredoxin 6,Prdx6)、硫氧还蛋白-1(thioredoxin-1,Trx1)、Lamin B1抗体,均购自Santa Cruz;丙二醛(malondialdehyde,MDA)测定试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)测定试剂盒,均购自南京建成生物工程研究所。
1.1.2仪器 蛋白电泳仪、转膜仪、成像仪(Bio-Rad公司);酶标仪(Molecular Devices);高内涵分析仪(Thermo Scientific)。
1.2 细胞培养SH-SY5Y细胞购自中国医学科学院基础医学研究所,用含10% FBS的DMEM/F12培养液,37 ℃、5% CO2条件下培养。
1.3 Aβ25-35模型建立及分组细胞分为正常对照组、Aβ25-35损伤模型组、EGC低剂量组(Aβ25-35+5 μmol·L-1EGC)、EGC中剂量组(Aβ25-35+10 μmol·L-1EGC)、EGC高剂量组(Aβ25-35+20 μmol·L-1EGC)和阳性对照组(Aβ25-35+5 mmol·L-1NAC)。
1.4 MTT法检测细胞存活率实验终点,吸除原有培养液,每孔加入100 μL 0.5 g·L-1MTT溶液,培养4 h后吸除MTT,加入100 μL DMSO振荡5 min,490 nm测定吸光度,计算细胞存活率。
1.5 LDH释放率考察细胞活力实验终点,取细胞上清,采用试剂盒检测LDH,具体操作按照试剂盒说明书进行。
1.6 细胞活性氧(reactive oxygen species,ROS)的检测实验终点,倾去细胞培养液,PBS洗涤1次,每孔加入50 μL终浓度为10 μmol·L-1DCFH-DA和10 μg·mL-1Hoechst 33258的DMEM/F12培养基。30 min后PBS洗涤3次,之后用高内涵细胞分析系统检测ROS水平。
1.7 氧化应激标志物检测实验终点,取细胞上清,采用试剂盒检测SOD、MDA和GSH-Px,具体操作按照试剂盒说明书进行。
1.8 Western blot法检测蛋白表达变化实验终点,用胞核胞质蛋白抽提试剂盒,分别提取核蛋白和细胞总蛋白,进行SDS-PAGE电泳,转印至PVDF膜后,置于5% BSA室温封闭2 h。然后用稀释的Nrf2、NQO-1、HO-1、Prdx6、Trx1抗体,于4 ℃孵育过夜。之后,TBST洗涤3次,再加入稀释后二抗室温孵育2 h,TBST洗涤3次后显色成像。
1.9 免疫荧光法检测Nrf2的核转位实验终点,吸除原培养液,PBS洗涤1次后,每孔加入50 μL多聚甲醛溶液固定15 min;PBS洗涤1次,每孔加入50 μL 0.3% Triton-100孵育10 min;PBS洗涤1次,每孔加入50 μL 5% BSA室温封闭2 h;之后每孔加入50 μL Nrf2抗体稀释液孵育过夜;回收一抗后,用PBS洗涤3次,然后加入荧光二抗稀释液,37 ℃孵育1.5 h;PBS洗涤3次后,加入Hoechst 33258避光孵育30 min;最后PBS洗涤1次,置于高内涵分析仪进行检测。

2 结果
2.1 EGC对Aβ25-35损伤SH-SY5Y细胞活力的影响如Fig 1A所示,与正常对照组相比,3 μmol·L-1Aβ25-35损伤SH-SY5Y细胞24 h后,细胞活力明显降低(P<0.01)。EGC(10、20 μmol·L-1)和抗氧化阳性药NAC(5 mmol·L-1)能够逆转Aβ25-35对SH-SY5Y细胞造成的损伤,明显提高细胞存活率(P<0.05,P<0.01)。如Fig 1B所示,Aβ25-35明显提高SH-SY5Y细胞LDH的释放(P<0.01),EGC(5、10、20 μmol·L-1)和NAC(5 mmol·L-1)能够明显降低Aβ25-35诱导的LDH释放(P<0.05,P<0.01)。
2.2 EGC抑制Aβ25-35诱导的SH-SY5Y细胞ROS的产生如Fig 2所示,3 μmol·L-1Aβ25-35损伤SH-SY5Y细胞后,细胞中ROS释放量明显增加(P<0.01),10、20 μmol·L-1EGC均能明显抑制Aβ25-35损伤导致的ROS释放(P<0.01)。
2.3 EGC调节Aβ25-35损伤SH-SY5Y细胞中氧化应激标志物的释放如Tab 1所示,与正常对照组相比,Aβ25-35损伤导致SH-SY5Y细胞中SOD和GSH-Px活性明显降低,MDA含量明显升高(P<0.01)。EGC能够明显提高SOD和GSH-Px活性,减少MDA含量,抑制氧化应激损伤。
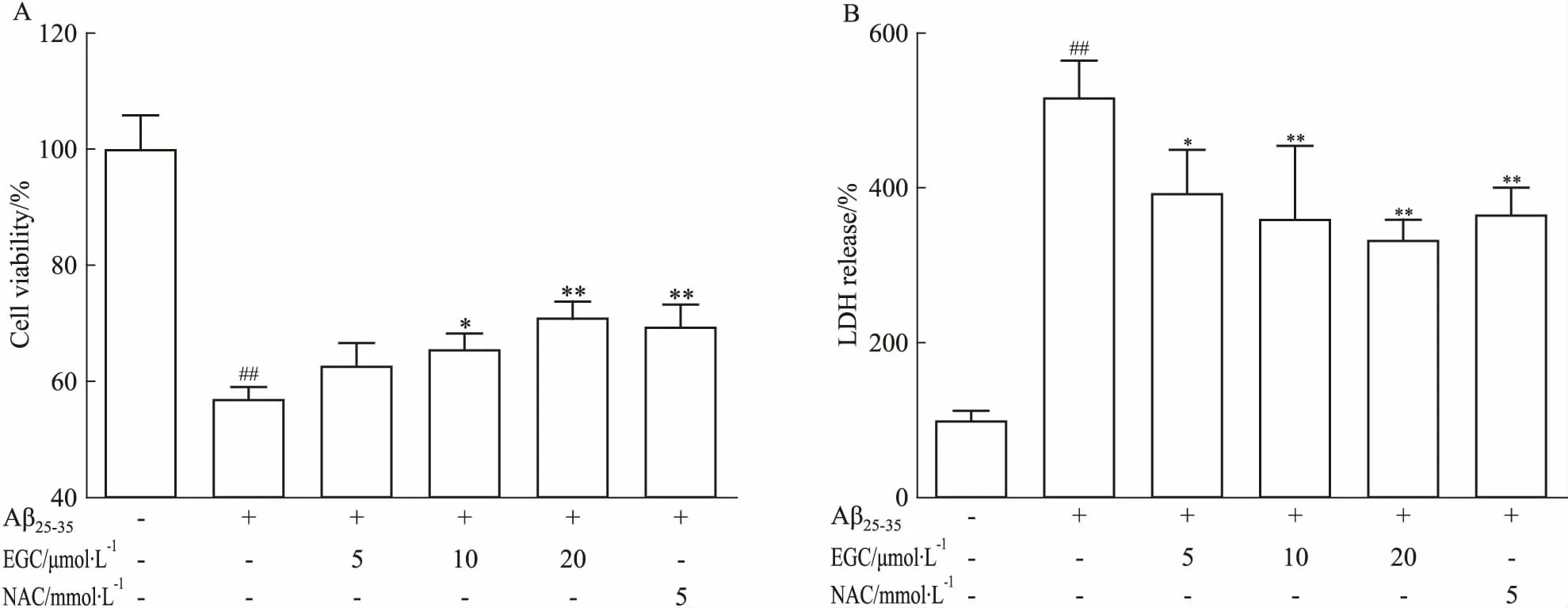
Fig 1 Effects of EGC on Aβ25-35-induced cytotoxicity in SH-SY5Y cells
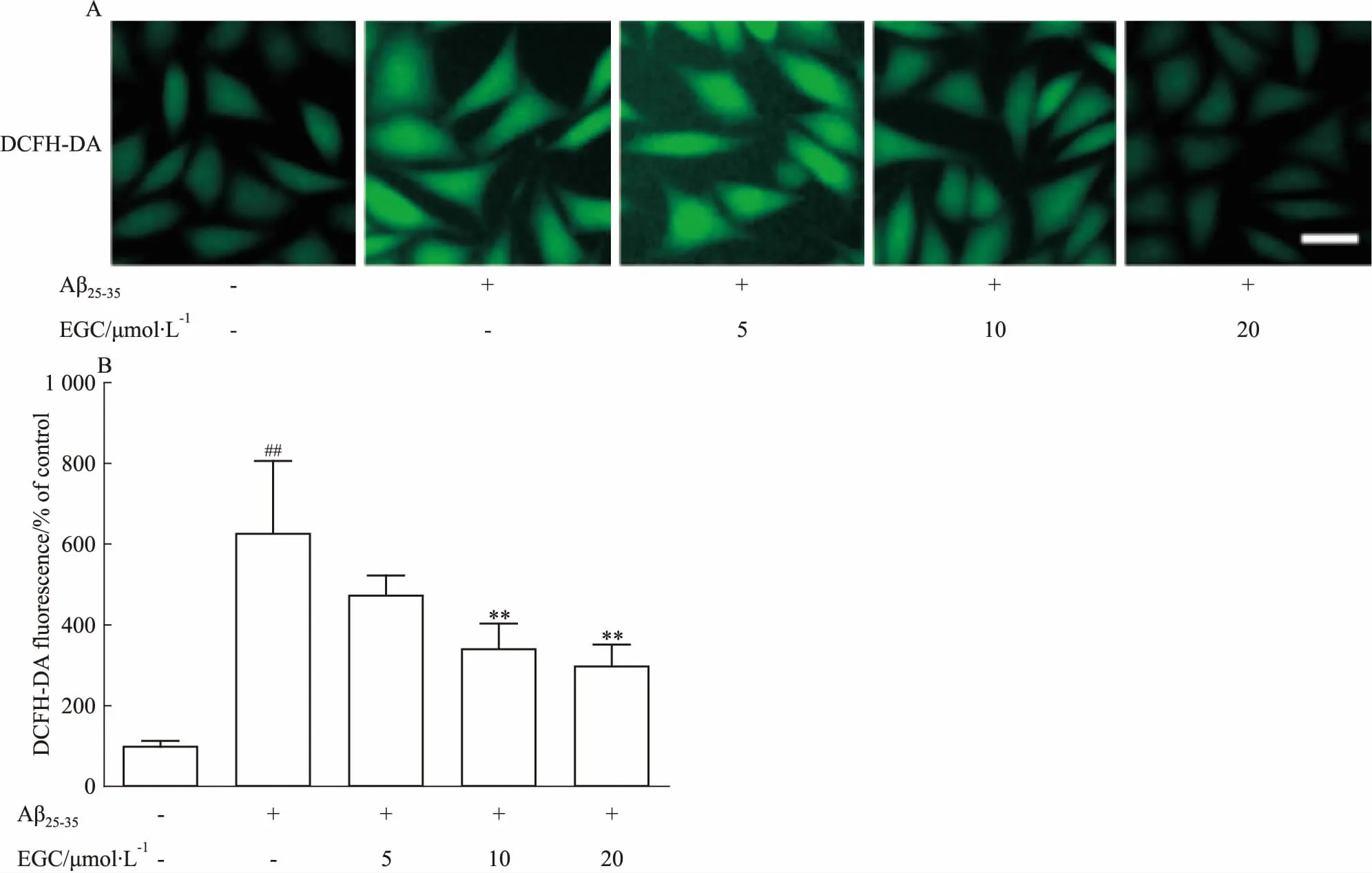
Fig 2 Effects of EGC on Aβ25-35-induced ROS accumulation in SH-SY5Y cells
Tab 1 Effects of EGC on SOD, GSH-Px, MDA in Aβ25-35-induced SH-SY5Y cells
2.4 EGC对Aβ25-35损伤SH-SY5Y细胞Nrf2核转位的影响采用Western blot和免疫荧光检测SH-SY5Y细胞内Nrf2核转位情况,结果如Fig 3所示,正常SH-SY5Y细胞核中Nrf2水平较低,Aβ25-35损伤后SH-SY5Y细胞核中Nrf2蛋白水平略有增加。EGC干预能够明显增强Aβ25-35损伤后Nrf2的核转位。
2.5 EGC对Aβ25-35损伤SH-SY5Y细胞Nrf2下游抗氧化蛋白表达的影响采用Western blot检测SH-SY5Y细胞内Nrf2下游抗氧化蛋白的表达情况,如Fig 4所示,EGC干预后能够明显增强Aβ25-35损伤后Nrf2诱导的II相辅酶HO-1、NQO1、Prdx6和Trx1的表达,提高细胞的抗氧化能力。
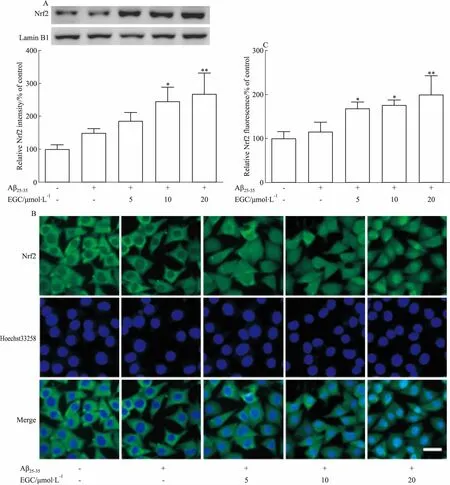
Fig 3 Effects of EGC on Nrf2 levels in Aβ25-35-treated SH-SY5Y cells

Fig 4 Effects of EGC on HO-1, NQO1, Prdx6, Trx1 levels in Aβ25-35-treated SH-SY5Y cells
3 讨论
本实验采用Aβ25-35损伤SH-SY5Y细胞模型,探讨EGC对Aβ25-35损伤SH-SY5Y细胞氧化应激的影响。3 μmol·L-1Aβ25-35损伤SH-SY5Y细胞24 h后,细胞存活率明显降低,LDH释放明显增加。EGC能够减轻Aβ25-35诱导的SH-SY5Y细胞损伤,提高细胞存活率,降低LDH释放。
氧化应激损伤是指机体抗氧化水平低于氧化水平,氧化中间产物在体内聚积,打破抗氧化与氧化平衡,造成机体损伤,诱发多种疾病[9-10]。研究表明,氧化应激在AD病理生理过程中发挥着重要作用[11-12]。Nrf2是细胞发生氧化应激反应的关键调节因子,对维持细胞内氧化还原水平至关重要[14-15]。本文实验结果表明,Aβ25-35损伤能够明显增加SH-SY5Y细胞ROS水平,而EGC可以明显降低Aβ25-35诱增的细胞内ROS。正常生理状态下,Nrf2-Keap1处于抑制状态,Aβ25-35损伤后SH-SY5Y细胞ROS水平明显增加,Nrf2-Keap1被激活发生解离,解离后的Nrf2蛋白在细胞核中聚集,促进SOD、GSH-Px及HO-1等下游产物增多[16-17]。
SOD在新陈代谢中起重要作用,能够特异性清除氧自由基,使细胞免受氧化应激损伤。GSH-Px也可以减少过氧化物在细胞内堆积,维持细胞正常生理功能。对抗氧化酶水平,Aβ25-35损伤后明显降低SH-SY5Y细胞中SOD和GST-Px的活性,而EGC可以明显升高SOD和GSH-Px活性。MDA是脂质过氧化终产物,可影响线粒体呼吸链中关键酶的活性,常用于评估氧化应激反应程度和自由基水平[13]。本实验结果表明,与对照组相比,Aβ25-35损伤导致脂质过氧化产物MDA积累,而EGC可以明显降低Aβ25-35诱增的MDA含量。采用Western blot和免疫荧光检测了SH-SY5Y细胞核中Nrf2蛋白表达。正常SH-SY5Y细胞核中Nrf2呈弱阳性表达,Aβ25-35损伤使细胞核中Nrf2蛋白水平略有增加,但与正常对照组相比差异不明显。EGC干预能够明显增强Aβ25-35损伤后Nrf2核转位。检测Nrf2-Keap1通路下游II相辅酶的表达水平表明,EGC处理能够明显增强Aβ25-35损伤后Nrf2诱导的II相辅酶HO-1、NQO1、Prdx6和Trx1的表达。SOD、GSH-Px、HO-1、NQO1、Prdx6和Trx1协同清除ROS,保护细胞免受氧化应激损伤。
综上所述,表没食子儿茶素能够激活Nrf2-Keap1通路,调节氧化应激反应中相关酶的活性,阻断Aβ25-35导致的ROS产生,提高SOD和GSH-Px活性,减少MDA含量,提高机体抗氧化水平,改善氧化损伤,降低Aβ25-35的神经毒性。