高、低场强多参数MRI膀胱影像报告与数据系统对膀胱癌浸润肌层诊断效能的比较
张添辉,古志聪,朱文标,姚纯,龙曦,范伟雄
膀胱癌的发病率高居全球常见恶性肿瘤第10位,严重威胁人类健康[1],术前准确评估膀胱癌是否浸润肌层对制定治疗方案具有重要价值[2]。非肌层浸润型膀胱癌(non-muscle invasive bladder cancer,NMIBC)主要采用经尿道膀胱肿瘤切除术加膀胱灌注化疗,而肌层浸润型膀胱癌(muscle invasive bladder cancer,MIBC)多采用根治性膀胱癌切除术联合术后全身辅助化疗[3,4]。多参数MRI(mutiparametric MRI,mp-MRI)是术前诊断膀胱癌是否浸润肌层的最佳影像学方法[5,6],但国内外对于膀胱mp-MRI研究中使用的设备、扫描方案及诊断流程等存在较大差异。为了规范膀胱mp-MRI检查及诊断流程,进一步提高诊断准确性及一致性,欧美及亚洲的多学科专家团队于2018年共同制订了膀胱影像报告与数据系统(vesical imaging reporting and data system,VI-RADS)[7],并已获得日本腹部放射学会、欧洲泌尿影像学会及欧洲泌尿学会的共同认可;但是,该评分系统主要基于既往文献证据及专家临床经验制定,其诊断价值还需大量临床病例进行测试和验证。本研究旨在探讨1.5T与3.0T多参数MRI膀胱影像报告与数据系统对膀胱癌浸润肌层的诊断效能。
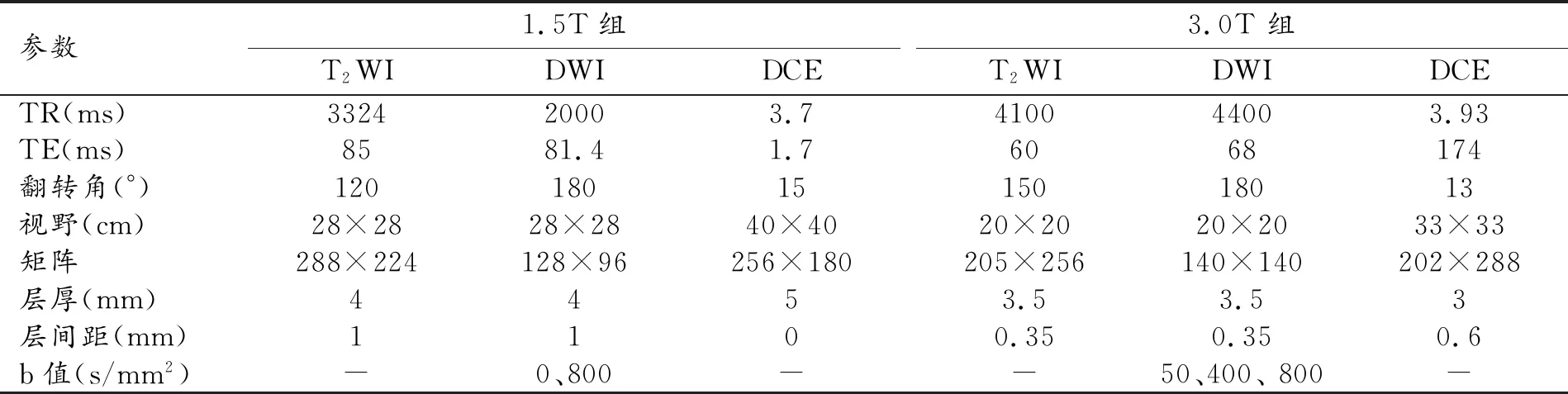
表1 两组多参数磁共振(mp-MRI)扫描序列及参数
材料与方法
1.病例资料
搜集本院2016年1月-2018年5月接受膀胱mp-MRI检查的患者。病例纳入标准:①患者临床及MRI检查资料均齐全,MRI检查序列包含T2WI、扩散加权成像(diffusion weighted imaging,DWI)和动态增强(dynamic contrast enhanced,DCE)序列;②患者行经尿道膀胱肿瘤切除术或根治性膀胱切除术,病理诊断为膀胱癌且T分期明确。病例排除标准:①图像存在伪影或质量不佳,无法进行VI-RADS评分;②患者MRI检查前已接受相关治疗,包括化疗、放疗或手术等。最后共193例膀胱癌患者纳入本研究,根据所接受MRI检查的磁场场强将患者分为1.5 T组与3.0 T组,其中1.5 T组92例(男74例,女18例),平均年龄为(63±12)岁;3.0 T组101例(男86例,女15例),平均年龄为(66±12)岁。根据肿瘤T分期将膀胱癌分为NMIBC(≤T1期)和MIBC(≥T2期)。
2.检查方法
患者检查前10 min肌肉注射山莨菪碱20 mg以抑制肠道蠕动,适度充盈膀胱;MRI检查采用GE Optima MR 360 1.5T、Siemens Skyra 3.0T MR扫描仪和腹部相控阵线圈,患者取仰卧位。1.5T组和3.0T组扫描序列及参数见表1。 MRI动态增强扫描对比剂采用钆双胺,剂量0.1 mmol/kg,注射流率2 mL/s,连续扫描4个时相。
3.图像分析
由两位影像科医师(影像诊断经验分别为2年和5年)依照VI-RADS评分标准进行盲法阅片,若阅片结果存在差异,通过协商达成一致意见。VI-RADS评估标准见表2[7]。
最终,VI-RADS评分根据T2WI、DWI和DCE-MRI的综合表现(图1),将出现膀胱癌浸润肌层的可能性分为5个等级[7]:1分(不可能存在);2分(不太可能存在);3分(可疑存在);4分(可能存在);5分(极有可能存在)。
4.统计学分析
采用MedCalc 15.6.1软件进行统计学分析。采用受试者工作特征(receiver operating characteristic ,ROC)曲线对1.5T组与3.0T组应用VI-RADS评分诊断膀胱癌浸润肌层的诊断效能进行分析,获得最佳阈值及ROC曲线下面积(area under curve,AUC),并计算最佳阈值条件下的诊断敏感度、特异度、阳性预测值(positive predictive value,PPV)、阴性预测值(negative predictive value,NPV)及准确度。以P<0.05为差异有统计学意义。
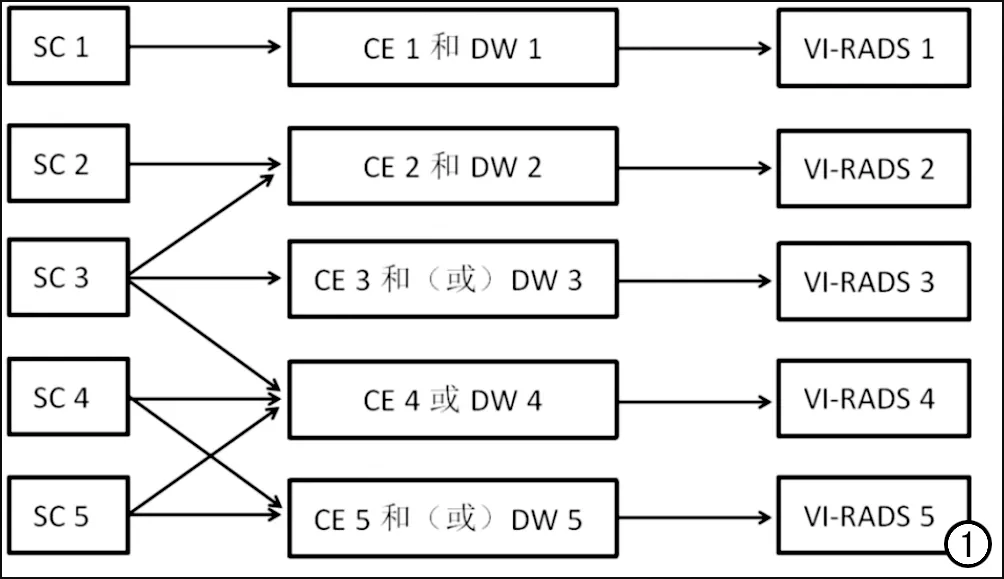
图1 VI-RADS评分流程图。

表3 1.5T组和3.0T组的VI-RADS评分与病理结果
注:括号内为构成比。

表4 1.5T组和3.0T组VI-RADS评分对膀胱癌浸润肌层的诊断效能
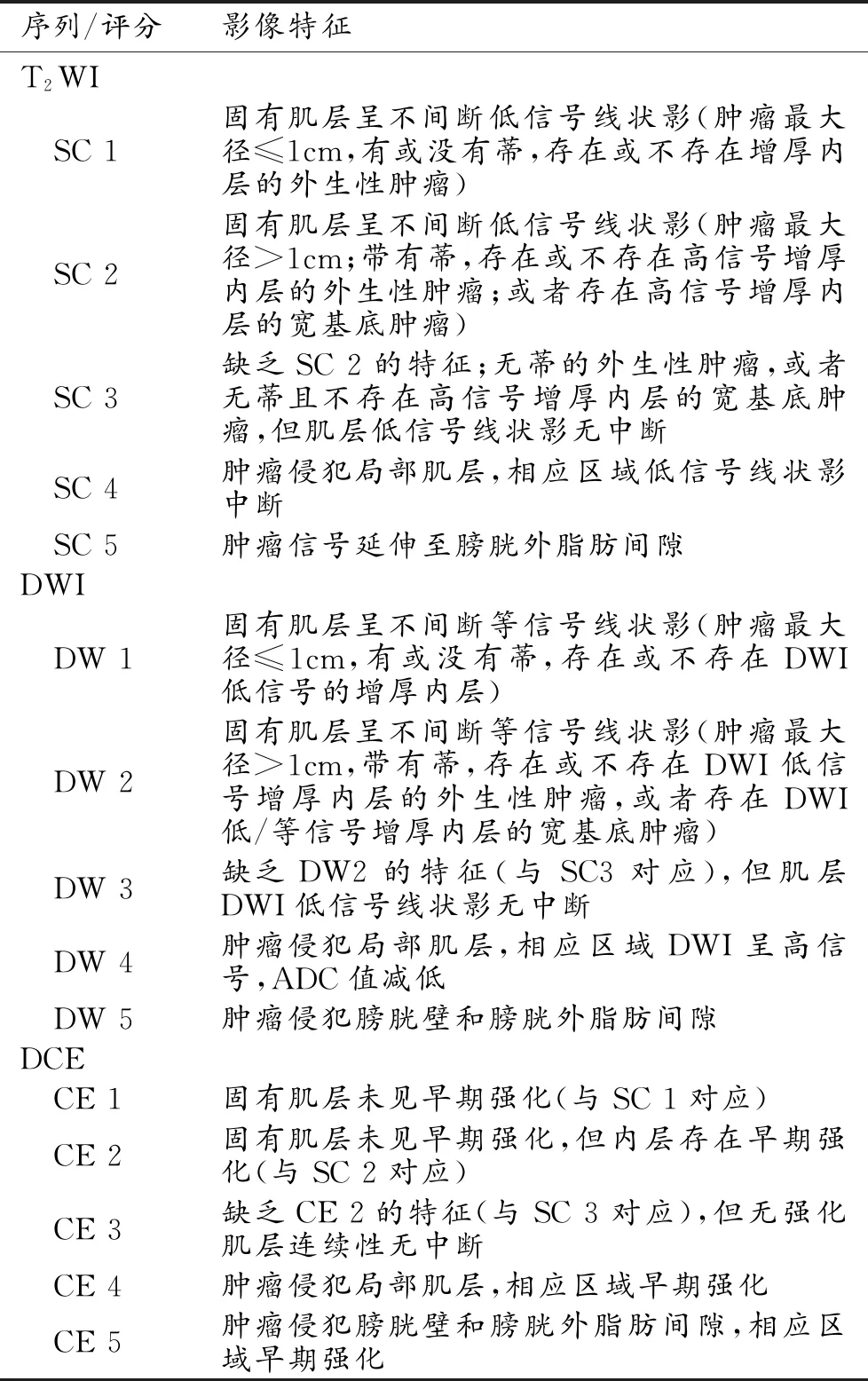
表2 膀胱影像报告与数据系统(VI-RADS)的MRI序列评分标准
注:结构类别(structural category,SC)。
结 果
1.病理分期结果
1.5T组纳入92例患者(单发病灶85例,多发病灶7例)共101个病灶。病理分期如下:Ta期病灶7个(6.9%),T1期75个(74.3%),T2期12个(11.9%),T3期6个(5.9%),T4期1个(1%)。其中,NMIBC病灶共82个(81.2%),MIBC病灶共19个(18.8%)(图2、3)。
3.0T组共纳入101例患者(单发病灶91例,多发病灶10例)共116个病灶。病理分期如下:Ta期病灶15个(12.9%),T1期69个(59.5%),T2期20个(17.2%),T3期8个(6.9%),T4期4个(3.4%)。其中,NMIBC病灶共84个(72.4%),MIBC病灶共32个(37.6%)(图4、5)。
1.5T组和3.0T组的VI-RADS评分与病理结果见表3。
2.诊断效能分析
ROC曲线分析结果显示,1.5T和3.0T两组VI-RADS评分诊断膀胱癌浸润肌层的最佳诊断阈值均为≥4,AUC分别为0.907和0.942,3.0T组的诊断效能优于1.5T组(表4,图6)。
讨 论
精准、规范的影像诊断是临床个体化和规范化治疗的前提和基础。影像报告与数据系统(reporting and data system,RADS)通过标准化的影像术语、诊断流程及分类评价体系规范了影像诊断报告,在不同器官的疾病诊治中发挥了极大的作用,如乳腺影像报告与数据系统(breast imaging-reporting and data system,BI-RADS)[8]、前列腺影像报告与数据系统(prostate imaging-reporting and data system,PI-RADS)[9]及肝脏影像报告与数据系统(liver imaging-reporting and data system,LI-RADS)[10]。因此,日本腹部放射学会、欧洲泌尿影像学会及欧洲泌尿学会共同发表了5分制标准的VI-RADS评分[7,11],旨在推动膀胱MRI检查及诊断流程的规范化、标准化及定量化,提高mp-MRI对膀胱癌浸润肌层的诊断准确性及一致性,同时有助于不同专业领域医生及不同医疗中心之间的交流。VI-RADS评分不仅针对T2WI、DWI及DCE作了相应的量化评分标准,而且对评判流程和诊断权重作了规定:首先依据T2WI判断膀胱壁肌层的完整性,DWI与DCE则主要用于诊断固有肌层是否受侵,且以DWI为首选,DCE为次选[7]。最终根据mp-MRI综合表现得到反映膀胱癌浸润肌层风险的VI-RADS评分,分数越高,浸润肌层的可能性越大[7]。
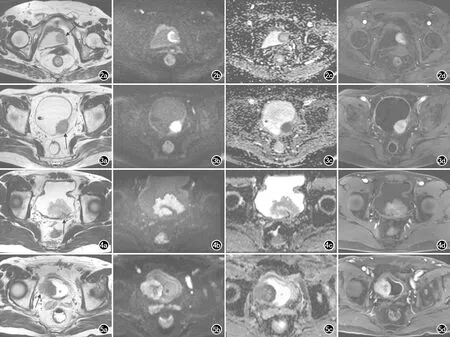
图2 1.5T多参数MRI图像。膀胱癌无浸润肌层(T1期)患者,女,71岁,VI-RADS评分为2分。a)T2WI示膀胱左侧壁肿物(箭),大小约17mm×21mm,膀胱壁固有肌层低信号无中断,评分为SC 2;b)DWI示病灶呈高信号,病灶内及基底见低信号; c)ADC图示病灶呈低信号,病灶内及基底见轻度高信号,评分为DW 2;d)DCE示病灶明显强化,邻近固有肌层无强化,评分为DC 2。 图3 1.5T多参数MRI图像。膀胱癌侵及壁外脂肪间隙(T3期)患者,男,74岁,VI-RADS评分为5分。a)T2WI示膀胱左后侧壁肿物(箭),大小约23mm×28mm,侵犯膀胱壁及壁外脂肪间隙,评分为SC 5;b)DWI示病灶呈明显高信号; c)ADC图示病灶呈明显低信号,并侵犯膀胱壁外脂肪间隙,评分为DW 5;d)DCE示病灶明显强化并侵犯至膀胱外脂肪间隙,评分为DC 5。 图4 3.0 T多参数MRI图像。膀胱癌无浸润肌层(T1期)患者,男,48岁,VI-RADS评分为2分。a)T2WI示膀胱左后壁菜花样肿物(箭),大小约54mm×41mm,膀胱壁固有肌层低信号无中断,评分为SC 2;b)DWI示病灶呈高信号,病灶内及基底见低信号; c)ADC图示病灶呈低信号,病灶内及基底见高信号,评分为DW 2;d)DCE示病灶明显强化,相应固有肌层无强化,评分为DC 2。 图5 3.0 T多参数MRI图像。膀胱癌侵及壁外脂肪间隙(T3期)患者,男,92岁,VI-RADS评分为5分。a)T2WI示膀胱右侧壁肿物(箭),大小约36mm×37mm,侵犯膀胱壁及壁外脂肪间隙,评分为SC 5;b)DWI示病灶呈明显高信号,c)ADC图示病灶呈明显低信号,并侵犯膀胱壁外脂肪间隙,评分为DW 5;d)DCE示病灶明显强化并侵犯至膀胱外脂肪间隙,评分为DC 5。

图6 1.5T组和3.0T组VI-RADS评分诊断膀胱癌浸润肌层的ROC曲线。a) 1.5T组; b) 3.0T组。
既往多项研究结果表明,多参数MRI对膀胱癌浸润肌层的诊断敏感度为68%~100%,特异度为76%~100%[12-17]。但是,这些研究缺少统一、客观的诊断标准及规范,造成不同研究间的结果具有较大差异。本研究利用VI-RADS对1.5T和3.0T膀胱多参数MRI进行分析,结果显示以4分为最佳临界值,诊断膀胱癌浸润肌层的AUC分别为0.907和0.942,敏感度分别为79.0%和87.5%,特异度分别为87.8%和95.2%,准确度分别为86.1%和93.1%,提示不论在高、低场强mp-MRI中,VI-RADS评分对膀胱癌浸润肌层均有较高的诊断效能,这可能与VI-RADS采用标准化、规范化及定量化的评分系统有关。此外,本研究还发现不论在高、低场强mp-MRI中, VI-RADS评分均具有较高的阴性预测值,即VI-RADS低于4分时,膀胱癌存在浸润肌层的可能性极小,使得临床医生有较大把握排除浸润肌层的风险,从而更准确地辨别出NMIBC患者,选择创伤更小的经尿道膀胱肿瘤切除术,避免不必要的根治性膀胱切除术[18]。
本研究结果还显示,基于VI-RADS评分的3.0T组对膀胱癌浸润肌层的诊断效能优于1.5T组,与以往基于mp-MRI的研究结论相符[18,19];分析原因可能是因为主磁场强度与图像信噪比成正比,磁场强度越高,图像信噪比越高,图像质量也越好,更有利于病灶VI-RADS的准确评估及精确分类,从而提高诊断效能[19]。此外,与1.5T MR相比,3.0T MR在对比噪声比、时间分辨率及空间分辨率等方面都有明显改进和提高[15]。因此,尽管VI-RADS推荐1.5T和3.0 T MR均可获得满足临床诊断要求的图像,但基于上述研究结果,笔者认为3.0T MR设备的优势更明显。
本研究还存在以下不足:①该研究是回顾性分析,难以避免选择性偏差;②由于膀胱内的空气会导致DWI伪影,VI-RADS中建议若患者条件允许,应移除导尿管2~3天后再行MRI检查。而本研究中部分行MRI检查的患者为插入导尿管者,这在以后临床工作中需要注意,不过本研究患者入组时已剔除存在伪影且影响VI-RADS评分者;③浸润肌层型膀胱癌患者样本量相对较少,可能对结果统计造成一定影响;④该研究只评估了VI-RADS对膀胱癌浸润肌层的诊断效能,即区分≤T1与≥T2期,而对区分≤T2与≥T3期及膀胱癌分级的诊断效能尚不清楚,有待进一步研究。
总之,VI-RADS在高、低场强mp-MRI中对膀胱癌浸润肌层均有较高的诊断价值,且3.0TMR的诊断效能优于1.5T,今后仍需要多中心、大样本的前瞻性研究来进一步验证结论。

