不同浓度胆固醇建立动脉粥样硬化斑块模型的超声评估
王佳玉, 周玮, 王心宇, 毕小军, 毛宇航, 孙杰
超声成像广泛应用于动脉粥样硬化(atherosclerosis,AS)疾病的检查,对斑块的发生、发展及治疗效果的评估具有重要的监测作用。以前的模型建立主要用于内皮功能的研究或显微镜下的观察[1],不需产生超声可见斑块。随着超声技术的发展,超声成像可以分辨斑块回声特性及斑块新生血管密度进而评估斑块的稳定性。因此,建立常规超声可视的动物斑块模型成为许多声学实验亟需解决的问题。目前,国内常用建立AS斑块模型的高脂饮食胆固醇含量多为1%或2%[2-4],所用的模型动物以兔为常见[5]。由于兔没有肝酯酶,建模给予的高脂喂养常常会使血清胆固醇浓度很高,兔子内脏器官产生脂质沉着,大大缩短了动物寿命[6,7]。过低的胆固醇可能使血清胆固醇浓度累积较慢,建模时间延长[8]。自然发展的斑块多位于腹主动脉,过低的胆固醇形成的斑块主要位于主动脉弓和胸主动脉[9],这些部位不利于超声观察。因此给予合适浓度的胆固醇对于建立可供超声显像分析的斑块及实验周期的长短非常重要。然而,关于不同浓度胆固醇含量的高脂饲料对建立声学实验所需AS斑块的影响,国内外尚无类似研究的报道。本研究拟评价应用球囊扩张联合不同浓度的高脂饲料,建立超声可视兔AS斑块模型的周期长短及效果,以期为声学实验根据不同的需要,选择适宜浓度的高脂饲料建立AS模型提供参考。
材料与方法
1.实验材料
新西兰白兔65只,雄性,12周龄,体重1.8~2.5 kg(湖北省实验动物中心提供),5只为正常饮食的对照组,60只行球囊扩张联合高脂喂养建立模型。高脂喂养分为1%胆固醇组28只与2%胆固醇组32只。其他实验材料包括胆固醇 (Amresco分装)、球囊(3.0~3.5) mm×15 mm(美国coridis公司)、Logiq E9彩色多普勒超声诊断仪(美国GE公司)。
2.实验方法
球囊扩张:经兔耳缘静脉注射3%戊巴比妥钠1.5 mL/kg麻醉后固定,分离右侧股动脉后,肝素化的穿刺针与血管呈20°刺入股动脉后平行进入,送入直径为3.0~3.5 mm球囊导管,超声监测球囊至腹腔干水平后停止送入,导管外侧端连接压力泵,注入生理盐水,维持压力表为10~15 kPa,使球囊扩张后缓慢拉出球囊至股动脉分叉处,压力表归零后将球囊再次送入,如此重复3次,术后高脂喂养。
高脂喂养:球囊扩张前1周开始高脂喂养。高脂饲料分为2%胆固醇与1%胆固醇:2%胆固醇组采用2%胆固醇+3%蛋黄粉+3%猪油配置成高脂饲料,1%胆固醇组采用1%胆固醇+3%蛋黄粉+3%猪油配置成高脂饲料[8],每只兔每日早100 g、晚50 g喂养,自高脂喂养8周后每4周进行一次超声检查。2%胆固醇组由于病死率较高,高脂喂养至20周时实验截止,1%胆固醇组喂养至36周时实验截止。
超声检查:实验兔麻醉后左侧位放于检查台上,右侧腹备皮,采用Logiq E9超声检查仪,9L探头行常规二维超声检查,探头频率9 MHz。以右肾动脉为标记,观察并记录每个斑块距右肾动脉的距离、大小及斑块回声强度。
病理分析:取1%胆固醇饲料喂养36周及2%胆固醇饲料喂养20周的模型兔的斑块,组织连续切成5 μm切片后行HE染色,测量纤维帽及脂质核心的厚度。免疫组化检测斑块内新生血管及血管内皮生长因子(vascular endothelial growth factor,VEGF)。

图1 2%胆固醇组与1%胆固醇组的生存曲线图。 图2 1%胆固醇及2%胆固醇饮食喂养组的斑块厚度变化图。a)1%胆固醇组;b)2%胆固醇组。 图3 AS斑块声像图。 图4 2%胆固醇组斑块CD31染色,200倍显微镜放大后可见斑块内新生血管、胆固醇结晶及大量泡沫细胞。 图5 两组斑块内均可见大量VEGF表达。

表1 2组喂养组与对照组的血脂结果比较 (mg/dL)
注:与对照组比较,aP<0.05。
3.统计学分析
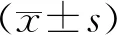
结 果
1.血脂分析结果
在高胆固醇饮食喂养8周时进行甘油三酯及胆固醇检测,发现2%胆固醇组与1%胆固醇组两组间各参数差异均无统计学意义(P值均>0.05);但高胆固醇饮食喂养的两组与对照组间差异均有统计学意义(P值均<0.05,表1)。
2.1%胆固醇组与2%胆固醇组兔生存分析结果
对照组无1只兔死亡,1%胆固醇组与2%胆固醇组模型兔的生存曲线差异有统计学意义(χ2=7.503,P=0.0062),2%胆固醇组的生存时间明显缩短,病死率较1%胆固醇组高,两组的中位生存时间分别为102 d和170.5 d(图1)。
3.超声测量斑块厚度变化
对照组无斑块形成。1%胆固醇组在8周时基本无明显可测量斑块,在12周时可测得斑块的平均厚度为(0.51±0.12) mm,随后斑块厚度缓慢增加,至24周时增加明显,斑块平均厚度为(0.73±0.21) mm,至32周时斑块平均厚度达到最大为(0.85±0.29) mm(图2),随后斑块平均厚度降低。2%胆固醇组在8周时出现可测量斑块,平均厚度为(0.54±0.16) mm,12周时斑块厚度明显增加,达(0.70±0.14) mm,16周时平均厚度达到最大,为(0.76±0.10) mm。高脂饮食喂养至相同周数时,2%胆固醇组的斑块厚度明显大于1%胆固醇组,差异均具有统计学意义(图3)。

表2 2组纤维帽、脂质核心厚度比较
4.病理斑块特性
HE染色发现两组斑块成份基本一致,镜下可见大量泡沫细胞。部分2%胆固醇组斑块内可见剑样胆固醇结晶(图4),1%胆固醇组未见明显胆固醇结晶。两组斑块内新生血管密度及纤维帽厚度、纤维帽与脂质核心厚度比差异均无统计学意义(表2)。免疫组化染色发现两组斑块内均可见大量VEGF表达(图5)。
讨 论
血管内皮是覆盖在血管腔表面以保护平滑肌细胞的一个屏障,内皮细胞损伤诱发一系列炎症反应是发生AS的必备条件,是形成易损斑块的始动环节。球囊损伤内皮可加速AS斑块的形成,在一定程度上可缩短造模时间,增强造模效果。但单纯使用球囊拉伤方法很难得到理想的模型。相关研究发现,以高脂血症和/或高胆固醇血症为特征的血浆脂蛋白和脂质代谢异常是冠心病和AS的主要病因[9],因此,通过给予高胆固醇饮食可以建立AS模型。但是,胆固醇的浓度、成模时间、病变进展等直接影响模型的制备。目前的高脂饲料成分及配比不尽相同,常用的是含胆固醇的高脂饲料,不同浓度的胆固醇饲料建模效果可能不同。饮食中胆固醇的含量及高脂喂养时间均可影响斑块的组份。以往研究发现给予5.5%胆固醇与给予1%胆固醇所形成的高脂血症程度相同[10],给予0.3%~0.5%的胆固醇饮食可以使血清胆固醇水平达到1 000 mg/dl,给予1.0%~1.5%的胆固醇饮食8周后可使血清胆固醇水平达到1500~3000 mg/dl,并且形成以泡沫细胞为主的AS斑块。基于此,目前国外采用0.3%胆固醇饮食喂养20~26周建立兔AS斑块模型,但该方法形成的斑块多局限于主动脉弓及胸主动脉,腹主动脉斑块则少见[11,12]。本研究通过球囊扩张损伤腹主动脉内膜,联合不同浓度胆固醇饮食建立兔腹主动脉AS斑块模型,结果发现给予2%胆固醇与1%胆固醇在12周时两组的血清胆固醇均达到很高水平,差异无统计学意义,与之前研究结果相符[10]。尽管血清中胆固醇水平无差异,但胆固醇含量低(0.15%)的饮食会导致脂肪条纹病变的发生,而当饮食中胆固醇含量较高时,则更容易产生动脉粥样斑块[13]。本研究中2%胆固醇组兔的生存率较低,推测可能是因为血清胆固醇过高使得内脏器官产生脂质沉着,引起动物抵抗力降低,继发感染而死亡。
目前AS的检查主要依赖于影像学检查,常用的方法包括DSA、CT、 MRI及超声检查[14],超声检查方便、快捷,在临床上广泛应用于AS血管的检测。以往研究认为超声测量兔腹主动脉内中膜复合体厚度≥0.5 mm即可判定为斑块形成[15]。给予1%胆固醇饮食喂养8周以上即可通过血管内超声观察到斑块形成[3],目前国内各实验建立的兔AS斑块厚度多在0.5~1.5 mm之间。本研究通过常规二维超声检查发现2%胆固醇组喂养8周后部分实验兔可见较小点状斑块,12周时基本已形成较大斑块,16周时斑块更为明显。与之相反,1%胆固醇组斑块形成时间长,斑块出现时间晚于2%胆固醇组,在8周时斑块不明显,在24周左右时斑块较明显,32周时最为明显。由于斑块厚度大的模型兔死亡,2%胆固醇组、1%胆固醇组分别在16周、32周以后平均斑块厚度下降。由此可见,若实验中为降低病死率而使用1%胆固醇需要更长时间建模,但斑块平均厚度增加。
综上所述,本研究发现应用球囊扩张联合高脂喂养的方法可以成功建立超声检查所见的AS斑块模型,给予2%胆固醇喂养可在较短时间内建立斑块模型,但斑块兔存活时间短,病死率较高。给予1%胆固醇喂养建模时间长,但斑块兔存活时间长,两者所建立的斑块从病理学角度无明显差异。本研究结果可为声学实验选择合适浓度的高脂饲料建立AS模型提供参考,具有重要的理论和实践意义。

