干扰S100A4在屋尘螨诱导的哮喘气道上皮屏障功能的作用
黄超文 赵强 钟雪莺 温玉婷 梁丽萍 黄炎明

【摘要】 目的:探讨干扰16HBE细胞中S100A4基因表达后,HDM(屋尘螨)诱导的气道上皮屏障功能和信号蛋白的变化。方法:合成靶向S100A4基因的siRNA,采用脂质体转染正常16HBE细胞,PCR和Western blot检测干扰效果,并使用HDM刺激正常和干扰后的16HBE细胞,检测跨细胞电阻、FITC通透性,以及屏障蛋白(E-cadherin、β-catenin)、下游信号分子VEGFR2/p-VEGFR2表达的变化。结果:siRNA干扰后成功抑制16HBE细胞的S100A4基因和蛋白表达。HDM引起正常16HBE细胞TEER减少和FITC通透性增加,干扰S100A4可抑制HDM对跨细胞电阻和FITC通透性的损害。HDM刺激导致E-cadherin、β-catenin表达下调,干扰S100A4可减轻HDM对16HBE细胞屏障蛋白的破坏。HDM刺激后引起培养液中S100A4释放增加,细胞p-VEGFR2表达显著增加,而siRNA干扰后的16HBE细胞p-VEGFR2的表达仅轻度增加。结论:S100A4在HDM诱导的气道上皮细胞屏障损害中具有重要作用,可为哮喘的防治提供重要科学依据。
【关键词】 哮喘; S100家族钙结合蛋白A4; 屋尘螨提取物; 上皮细胞屏障; 血管生成因子
doi:10.14033/j.cnki.cfmr.2019.20.001 文献标识码 A 文章编号 1674-6805(2019)20-000-04
Role of Interfering S100A4 in HDM Induced Airway Epithelial Barrier Dysfunction/HUANG Chaowen,ZHAO Qiang,ZHONG Xueying,et al.//Chinese and Foreign Medical Research,2019,17(20):-4
【Abstract】 Objective:To investigate the changes of airway epithelial barrier function and signaling proteins in asthma induced by HDM after RNAi with S100A4 gene expression in 16HBE cells.Method:16HBE were transfected by S100A4 siRNA,the interference effect was detected by PCR and Western blot.16HBE were stimulated by HDM.The changes of TEER,FITC permeability,barrier proteins and VEGFR2/p-VEGFR2 were detected.Result:S100A4 gene and protein in 16HBE cells was inhibited successfully by siRNA interference.HDM stimulation resulted in decrease of TEER and increase of FITC permeability in normal 16HBE.S100A4 RNAi ameliorated the impairment of HDM on TEER and FITC permeability.The expression of E-cadherin and β-catenin was down-regulated by HDM stimulation,while interference with S100A4 could alleviate the damage of barrier proteins induced by HDM.HDM promoted the release of S100A4 in culture medium and profoundly elevated the expression of p-VEGFR2 in normal cells,while the expression of p-VEGFR2 in RNAi 16HBE slightly increased.Conclusion:S100A4 plays an important role in HDM-induced airway epithelial barrier dysfunction,and these findings can provide scientific basis for the prevention and treatment of asthma.
【Key words】 Asthma; S100A4; House dust mite extract; Airway epithelial barrier; Vascular endothelial growth factor
First-authors address:Jiangmen Central Hospital,Jiangmen 529000,China
我国哮喘发病率在逐年增高,虽低于发达国家,但死亡率卻高居世界之首,而发病机制尚未明确。气道上皮是肺抵御外界刺激的第一道防线,气道上皮屏障功能破坏是哮喘发病的首要环节[1-2]。上皮细胞屏障蛋白破坏后引起更多过敏原和刺激物进入上皮下,从而加重气道炎症,并可直接激活下游信号通路,最终引起慢性气道炎症、平滑肌增生和气道
重塑[3]。
S100A4蛋白属于钙离子结合蛋白家族中最大亚家族S100家族的成员,目前关于S100A4蛋白的研究主要聚焦在肿瘤细胞的侵袭和转移,但S100A4蛋白在炎症中同样发挥巨大作用。S100A4可调节细胞多种功能,在细胞增殖、分化、肌肉收缩和凋亡中发挥重要作用[4-5]。新近研究认为,S100A4蛋白不仅存在于细胞中,而且可以通过外泌体的形式主动分泌到细胞间,发挥与细胞内不同的生物学效应[6-7]。本研究拟通过干扰16HBE细胞S100A4基因表达,评价S100A4蛋白在HDM(屋尘螨)诱导的哮喘气道上皮屏障功能破坏中的作用。
1 材料与方法
1.1 一般材料
人正常气道上皮细胞16HBE细胞(中国科学院上海生命科学研究院提供)在培养瓶中生长密度达90%左右时,胰酶[吉诺生物科技有限公司(中国)提供]消化后移至6孔板中,分为空白对照组(无转染,con组)、转染空白序列组(NC组),S100A4干扰组(转染S100A4序列,S100A4-siRNA组)。
1.2 方法
(1)各组均进行脂质体转染,S100A4干扰碱基序列及阴性对照干扰序列由美国Ambion公司提供[8],正义链:5 GGACAAGGCCCGUUAUGAA dTdT 3,反义链:3 dTdT CCUGUUCCGGGCAAUACUU 5,等细胞生长至整个板表面积60%左右时进行转染。Lipofectamine TM2000(美国Thermo scientific公司)5 μl+无血清的RPMI(美国GIBCO公司)245 μl混匀稀释,室温孵育5 min,再取S100A4-siRNA或阴性对照siRNA序列75 pmol(250 μl),加入上述稀释液中等混匀,室温孵育20 min,按照500 μl/孔分组加到6孔板内,混匀;37 ℃ 5%CO2培养箱孵育48 h收取细胞,进行检测和下一步实验。
(2)阴性对照siRNA细胞和S100A4-siRNA细胞生长达整个板表面积80%时,分别使用PBS(1 ml,预处理24 h)、HDM(400 U:
1 ml,预处理24 h,丹麦ALK公司)处理上述两种细胞。实验共分成4组,正常组(PBS+NC组),HDM刺激阴性对照siRNA细胞组(HDM+NC组),PBS刺激S100A4-siRNA细胞组(PBS+siRNA组),HDM刺激S100A4-siRNA细胞组(HDM+siRNA组)。TEER用Millicell电阻仪(美国Millipore公司)进行测定,求得标准化电阻值。检测细胞跨膜电阻(TEER)和异硫氰酸荧光素-右旋糖酐(美国Sigma公司)透过率(FITC-Dextran)评价屏障的直接功能;FITC-Dextran用于研究单层细胞通透性的变化;收集刺激后细胞的培养液,超滤后检测分泌型S00A4总量;Western blot检测屏障蛋白E-cadherin(美国CST公司)、β-catenin(美国CST公司)和VEGFR2(美国Abcam公司)、p-VEGFR2(美国Abcam公司)。
1.3 检测指标
(1)RTPCR、Western Blot分别检测各组细胞S100A4基因mRNA和蛋白表达情况,以评价干扰效果;(2)检测细胞跨膜电阻(TEER)和异硫氰酸荧光素-右旋糖酐透过率(FITC-Dextran)评价屏障的直接功能;(3)FITC-Dextran实验结果均以Pa/对照组Pa(Pc)×100%表示;(4)对比各组S00A4总量;(5)对比各组E-cadherin、β-catenin和VEGFR2、p-VEGFR2。
1.4 统计学处理
应用SPSS 19.0分析数据,计量资料使用(x±s)表示,均数满足方差齐性时采用单向方差分析(one way ANOVA),组间多重比较采用Bonferroni法比較;不满足方差齐性时均数比较采用Welch法比较,组间多重比较采用Tamhanes T2检验比较,P<0.05为差异有统计学意义。
2 结果
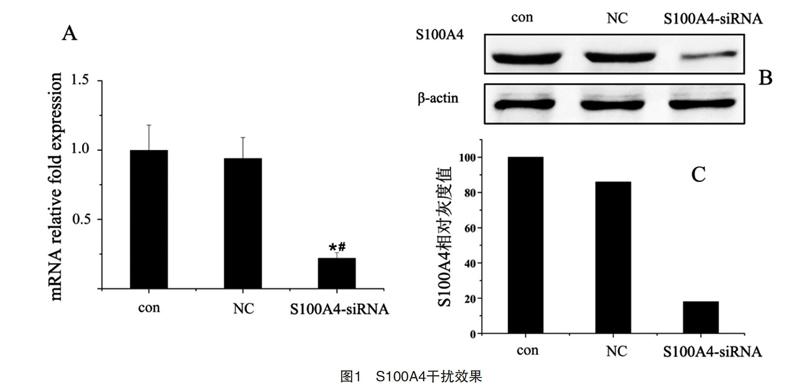
2.1 S100A4干扰效果比较
NC组的S100A4基因表达对比con组,差异无统计学意义(P>0.05),但S00A4-siRNA组对比con组、NC组的S100A4 mRNA表达均明显低,差异有统计学意义(P<0.05),见表1、图1-A。Western Blot结果显示NC组S100A4蛋白表达与con组基本相同,但S00A4-siRNA组蛋白表达显著减少(表1、图1-B、图1-C)。
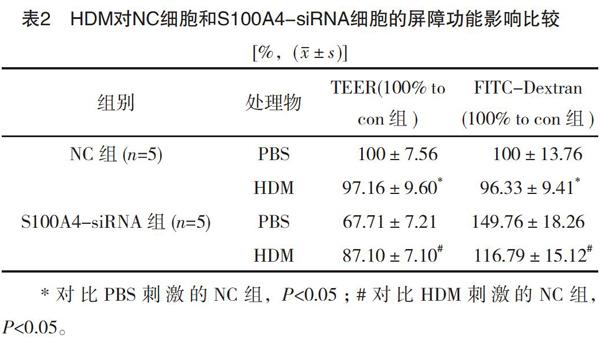
2.2 干扰S100A4在HDM介导的16HBE屏障功能破坏的作用对比
HDM刺激NC细胞导致TEER下降和FITC-Dextran增加,对比PBS+NC组,差异有统计学意义(P<0.05),见表2、图2。而HDM刺激S00A4-siRNA细胞仅引起TEER轻度下降及FITC-Dextran轻度增加,对比HDM刺激的NC组,差异有统计学意义(P<0.05),见表2、图2。
2.3 HDM对NC和S100A4-siRNA细胞屏障蛋白和VEGFR2的影响比较
HDM刺激NC细胞可导致屏障蛋白E-cadherin和β-catenin表达减少,并促使VEGFR2的磷酸化,但不影响总VEGFR2的表达,此结果与本文作者既往研究结果文献[9]相一致。而对比NC组,HDM刺激S100A4-siRNA细胞所致的屏障蛋白破坏和VEGFR2的磷酸化均明显受到抑制。同时,HDM刺激S100A4-siRNA细胞虽可引起分泌型S100A4轻度增高,但仍显著低于NC组的分泌量(表3、图3)。
3 讨论
目前哮喘的发病机制尚未明确,而气道上皮屏障功能破坏是哮喘发病的启动环节。笔者的前期研究结果显示:VEGFR2磷酸化在HDM介导的气道上皮细胞损伤、屏障蛋白破坏、炎症信号通路激活中具有重要的意义[9]。但HDM如何引起VEGFR2磷酸化尚不清楚。本研究首次揭示S100A4蛋白对HDM所致的哮喘气道上皮屏障功能破坏的影响,明确S100A4蛋白在哮喘发病中的作用,国内尚未见相关研究报道。
S100A4蛋白同时具备胞内和胞外活性,在胞内外分别调节多种信号通路蛋白,主要依赖钙离子信号通路[4-5,10]。S100A4还可与连接蛋白等结合从而改变细胞迁移能力,参与上皮间充质转换[11]。本研究发现S00A4-siRNA组对比con组、NC组的S100A4 mRNA表达均明显低,Western Blot结果显示S00A4-siRNA组蛋白表达相对NC组与con组显著低,表示RNA干扰效果良好。同时发现HDM刺激可直接促使S100A4蛋白分泌增加,提示S100A4介导HDM对气道上皮屏障损害的潜在可能。进而笔者采用脂质体转染进行S100A4干扰实验,干扰结果显示单纯干扰下调S100A4蛋白表达并不影响16HBE上皮细胞的直接屏障功能,如跨细胞电阻和右旋糖酐通透性,亦不引起主要屏障蛋白E-cadherin和β-catenin表达变化,但却可以抑制HDM导致的细胞跨细胞电阻和右旋糖酐通透性改变和屏障蛋白的表达下调。证明下调S100A4蛋白在维持气道上皮细胞功能中具有保护作用,从而抑制哮喘的发生发展,与本文作者黄超文在国家自然科学基金青年基金的预实验结果是一致的。
上皮細胞屏障功能体现为其作为第一道物理屏障,可直接抵御各种刺激物、过敏原通过上皮细胞进入上皮下,因此本文使用跨细胞电阻和通透性变化可评价此功能[12]。本研究所选择的E-cadherin和β-catenin作为屏障蛋白的核心蛋白,除了二者可直接反映上皮细胞屏障是否被破坏之外,更重要的是E-cadherin和β-catenin可同时在气道上皮介导免疫调节和下游信号通路的激活。NF-κB在促进哮喘气道炎症的放大的作用已被公认,而E-cadherin完整正常时,可抑制NF-κB活性,而破坏的E-cadherin被介导入核并激活NF-κB,促使多条炎症信号通路激活[13],E-cadherin与S100A均能共同作用于NF-κB,引起放大炎症的作用。β-catenin则可直接激活wnt通路,介导黏膜下平滑肌细胞增生和成纤维细胞活化,导致气道重塑[14]。
VEGFR2/p-VEGFR2信号通路的激活为本研究的另一亮点,本文作者已在动物实验中显示,HDM可引起哮喘小鼠的VEGFR2磷酸化,而使用VEGFR2的受体拮抗剂贝伐珠单抗可抑制屏障蛋白的破坏及下游信号通路的激活[9]。而VEGF在哮喘小鼠气道重塑方面的作用亦被证实[15]。因此,本研究良好的衔接既往研究结果并补充了细胞实验结果,结果发现干扰下调S100A4蛋白可以减少p-VEGFR2的表达,这提示下调S100A4蛋白可通过抑制VEGFR2的磷酸化发挥其保护气道上皮屏障的作用。
综上所述,本研究通过建立S100A4-siRNA的细胞模型,成功证明了下调S100A4蛋白的表达可抑制HDM所引起的屏障功能破坏及下游VEGFR2/VEGFR2信号通路的激活,进而保护气道上皮细胞。目前S100A4蛋白的研究主要聚焦于EMT、肿瘤发生发展中,而本文首次探讨其在哮喘发病机制中的作用,为哮喘的防治提供了新的依据。
参考文献
[1] Samitas K,Delimpoura V,Zervas E,et al.Anti-IgE treatment,airway inflammation and remodelling in severe allergic asthma:current knowledge and future perspectives[J].Eur Respir Rev,2015,24(138):594-601.
[2] Lambrecht B N,Hammad H.Allergens and the airway epithelium response:Gateway to allergic sensitization[J].Journal of Allergy and Clinical Immunology,2014,134(3):499-507.
[3] Georas S N,Rezaee F.Epithelial barrier function:At the front line of asthma immunology and allergic airway inflammation[J].Journal of Allergy and Clinical Immunology,2014,134(3):509-520.
[4] Dulyaninova N G,Ruiz P D,Gamble M J,et al.S100A4 regulates macrophage invasion by distinct myosin-dependent and myosin-independent mechanisms[J].Mol Biol Cell,2018,29(5):632-642.
[5] Zhang K,Liu X,Hao F,et al.Targeting TGF-β1 inhibits invasion of anaplastic thyroid carcinoma cell through SMAD2-dependent S100A4-MMP-2/9 signaling[J].American Journal of Translational Research,2016,8(5):2196.
[6] Kim H,Lee Y D,Kim M K,et al.Extracellular S100A4 negatively regulates osteoblast function by activating the NF-kappa B pathway[J].BMB Rep,2017,50(2):97-102.
[7] Herwig N,Belter B,Pietzsch J.Extracellular S100A4 affects endothelial cell integrity and stimulates transmigration of A375 melanoma cells[J].Biochem Biophys Res Commun,2016,477(4):963-969.
[8] Zhang K,Yu M,Hao F,et al.Knockdown of S100A4 blocks growth and metastasis of anaplastic thyroid cancer cells in vitro and in vivo[J].Cancer Biomark,2016,17(3):281-291.
[9] Huang C,Dong H,Zou M,et al.Bevacizumab reduced auto-phosphorylation of VEGFR2 to protect HDM-induced asthma mice[J].Biochemical and Biophysical Research Communications,2016,478(1):181-186.
[10] Xia H,Gilbertsen A,Herrera J,et al.Calcium-binding protein S100A4 confers mesenchymal progenitor cell fibrogenicity in idiopathic pulmonary fibrosis[J].J Clin Invest,2017,127(7):2586-2597.
[11] Ning Q,Li F,Wang L,et al.S100A4 amplifies TGF-β-induced epithelial-mesenchymal transition in a pleural mesothelial cell line[J].Journal of Investigative Medicine:the Official Publication of the American Federation for Clinical Research,2018,66(2):334-339.
[12] George L,Brightling C E.Eosinophilic airway inflammation:role in asthma and chronic obstructive pulmonary disease[J].Therapeutic Advances in Chronic Disease,2015,7(1):34-51.
[13] Nawijn M C,Hackett T L,Postma D S,et al.E-cadherin:gatekeeper of airway mucosa and allergic sensitization[J].Trends in Immunology,2011,32(6):248-255.
[14] Chen D,Zheng Z,Xiao B,et al.Corrigendum:orf virus 002 protein targets ovine protein S100A4 and inhibits NF-kappa B signaling[J].Front Microbiol,2017,8:160.
[15] Qian L,Hong J,Zhang Y,et al.Downregulation of S100A4 alleviates cardiac fibrosis via Wnt/β-Catenin pathway in mice[J].Cell Physiol Biochem,2018,46(6):2551-2560.

