哇巴因对肝癌细胞株P-gp表达的影响研究
杨明镇 赵逵
【摘要】 目的 研究哇巴因对肝癌细胞株P-糖蛋白(P-gp)表达的影响。方法 选用人肝癌Bel-7402细胞株, 阿霉素(ADM)大剂量间断冲击法建立Bel-7402/ADM模型并设为耐药组, 正常Bel-7402设为对照组。采用免疫印迹(WB)检测两组哇巴因干预前后P-gp表达水平。结果 哇巴因干预前, 耐药组P-gp表达水平为(72.68±0.07), 对照组为(22.21±0.04);哇巴因干预后, 耐药组P-gp表达水平为(20.61±0.04), 对照组为(14.32±0.05);哇巴因干预后, 两组P-gp水平均显著低于哇巴因干预前, 差异有统计学意义(P<0.05);哇巴因干预前后耐药组P-gp水平均显著高于对照组, 差异有统计学意义(P<0.05)。结论 哇巴因可有效下调肝癌细胞株P-gp的表达。
【关键词】 哇巴因;肝癌细胞株;P-糖蛋白
DOI:10.14163/j.cnki.11-5547/r.2019.24.107
Effect of ouabain on the expression of P-gp in hepatocellular carcinoma cell line YANG Ming-zhen, ZHAO Kui. Department of Invasive Technology, Affiliated Hospital of Zunyi Medical College, Zunyi 563003, China
【Abstract】 Objective To study the effect of ouabain on the expression of P-glycoprotein (P-gp) in hepatocellular carcinoma cell line. Methods The Bel-7402/ADM model of human hepatocellular carcinoma cell line Bel-7402 was established by high-dose intermittent impulse method with adriamycin (ADM) as drug-resistant group and normal Bel-7402 as control group. The expression of P-gp was detected by Western blotting (WB) before and after ouabain intervention in the two groups. Results Before intervention of ouabain, drug-resistant group had P-gp expression level as (72.68±0.07), which was (22.21±0.04) in the control group. After intervention of ouabain, drug-resistant group had P-gp expression level as (20.61±0.04), which was (14.32±0.05) in the control group. After intervention of ouabain, both groups had significantly lower P-gp expression level than those before intervetion of ouabain, and the difference was statistically significant (P<0.05). Before and after intervention of ouabain, drug-resistant group had significantly higher P-gp expression level than the control group, and the difference was statistically significant (P<0.05). Conclusion Ouabain can effectively down-regulate the expression of P-gp in hepatocellular carcinoma cell line.
【Key words】 Ouabain; Hepatocellular carcinoma cell line; P-glycoprotein
肝癌(liver cancer)是指發生于肝脏或从肝脏开始的恶性肿瘤, 使机体基因转录异常, 细胞失去正常增殖、分化、凋亡能力[1]。肝癌发病隐蔽, 初期无明显症状, 病情进展迅速, 临床症状多表现为发热、乏力、纳差、消瘦、消化道症状及最常见的肝区疼痛, 多因癌细胞迅速生长致肝包膜紧绷导致, 疼痛可辐射至右肩[2]。体征常见肝脾肿大、腹水黄疸等。肝癌确诊时患者往往已到晚期或已发生转移, 大多数患者无法通过手术根治, 预后差, 复发率高。化疗是目前最主要治疗手段[3], 长时间使用化疗药物易导致肿瘤多药耐药性(multidrug resistance, MDR)[4], 影响药物吸收, 制约疗效, 危害患者身心健康。研究表明, P-糖蛋白(P-glycoprotein, P-gp)是MDR基因编码的一种跨膜转运蛋白, 参与机体解毒及代谢, 可将细胞内毒性代谢产物外排出细胞, 保护细胞受损。临床上对哇巴因干预下P-gp表达影响研究较少, 因此本文旨在探讨哇巴因对肝癌细胞株P-gp表达的影响, 期望为临床治疗提供实验和理论依据, 现将研究结果报告如下。
1 材料与方法
1. 1 主要药物及试剂 人肝癌Bel-7402细胞株(上海冠导生物工程有限公司);ADM(湘潭嘉叶源生物科技有限公司);胎牛血清(FBS)(北京雅安达生物技术有限公司);细胞裂解液(北京智杰方远科技有限公司);聚偏二氟乙烯膜(PVDF膜)(上海邦景实业有限公司);预染标准分子量蛋白 (上海谷研实业有限公司)。
1. 2 实验模型制备及分组 取对数生长期人肝癌Bel-7402细胞, 0.25%胰酶消化, 1000 r/min离心3 min后收集细胞。在37℃、5% CO2、0.1 μmol/L浓度ADM条件下染毒1 h后, 0.25%胰酶消化, 1000 r/min离心3 min收集细胞, 在不加ADM培养瓶中继续接种培养。重复以上步骤, 逐渐提高ADM药物浓度至1 μmol/L浓度, 细胞仍能稳定良好生长即肝癌耐药Bel-7402/ADM造模成功。将正常Bel-7402设为对照组, Bel-7402/ADM设为耐药组。
1. 3 观察指标 采用免疫印迹(Western Blot, WB)检测P-gp表达水平, 取正常人肝癌Bel-7402及Bel-7402/ADM细胞, FBS清洗3次, 加入细胞裂解液, 离心15 min, 取上清液加入蛋白样缓冲液混匀, 置入100℃沸水变性5 min后-20℃保存备用。将凝胶置于电泳槽, 加甘氨酸电泳缓冲液, 取总蛋白上样, 80 V电泳, 内参照为β-actin, 蓝色蛋白样缓冲液与上下分离线>3 cm时停止电泳, 取出凝胶去除膜与凝胶气泡, 两侧放上滤纸, 置入转膜液槽, 80 V电压4℃过夜。BTBS洗膜3次, 加入二抗温育1 h, TBS洗膜3次, 加入增强化学发光(ECL)在Bio-RAD上成像并分析密度。
1. 4 统计学方法 采用SPSS22.0统计学软件进行数据统计分析。计量资料以均数±标准差( x-±s)表示, 采用t检验。P<0.05表示差异具有统计学意义。
2 结果
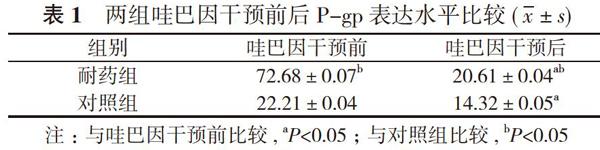
哇巴因干预前, 耐药组P-gp表达水平为(72.68±0.07), 对照组为(22.21±0.04);哇巴因干预后, 耐药组P-gp表达水平为(20.61±0.04), 对照组为(14.32±0.05);哇巴因干预后, 两组P-gp水平均显著低于哇巴因干预前, 差异有统计学意义(P<0.05);哇巴因干预前后耐药组P-gp水平均显著高于对照组, 差异有统计学意义(P<0.05)。见表1。耐药组P-gp表达凝胶蛋白电泳图见图1。
3 讨论
我国作为肝癌大国[5], 每年新发肝癌病例约占全球的50%, 且发病率逐年增长。肝癌起病隐匿, 初期多在肝病隨访或体检中偶然发现, 患者无症状, 体格检查也缺乏肿瘤指征, 出现症状就医时多进入中晚期, 大部分失去根治性手术机会, 而化疗是此阶段患者最有效治疗方式, 但肝癌在肿瘤死亡率中仅次于肺癌居于第二位, 最主要是因部分患者化疗无效或有效逐渐转为无效现象产生, 出现对未接触过、多种化学结果和作用机理不同的化疗药物交叉耐药, 即MDR。MDR[6]严重影响肿瘤治疗效果, 是肝癌化疗失败的主要原因, 严重威胁患者生命安全, 最先发现其和细胞膜糖蛋白增加有关, MDR由多种因素介导, 包括化疗药物造成损伤, 其中一些酶发挥作用, 使细胞自我修复能力增强, 导致细胞耐药(如蛋白激酶C);肿瘤细胞凋亡基因难以正常介导细胞凋亡导致耐药机制(如CD95/CD95L);微环境改变导致肿瘤细胞对化疗药物敏感性降低;某些信号传导因子改变[如细胞转录因子蛋白家族(NF-κB)]及其中最主要的P-gp介导化疗药物外排。mdr-1基因位于染色体7q21-21, 经糖基化后形成170KD的P-gp, 属于一种跨膜转运蛋白, 由跨膜疏水区和ATP结合亲水区构成, 主要定位在细胞膜上。
目前国内外对肝癌MDR已有较多文献报道, 但对哇巴因药物下肝癌细胞株的P-gp表达的影响研究较少。P-gp[7]广泛分布全身多个器官及组织中, 参与药物体内转运, 肿瘤细胞长期接触化疗药物, mdr-1基因被诱导大量表达P-gp, 此时P-gp结合药物分子并利用ATP水解能量将疏水亲脂性化疗药物在尚未发挥细胞毒性时排除细胞外, 降低药物浓度, 细胞由此获得耐药性, P-gp发挥外排作用依赖ATP水解释放能量, P-gp包含2个ATP结合位点, P-gp识别并结合药物, 其中1个ATP激活水解释放能量, P-gp结构改变释放底物至细胞外, 随后第2个ATP水解P-gp恢复原状态, 其影响P-gp与药物结合、外排、强度及P-gp结构恢复。针对P-gp介导的肿瘤MDR, 可通过增加细胞内Ca2+浓度在mdr-1基因转录翻译上抑制P-gp合成及活性, 影响膜功能降低P-gp外排作用, 提高药物浓度, 解决肿瘤细胞耐药性。P-gp外排作为ATP能量依赖泵, 也可以从降低外排所需能量入手。有研究发现低浓度哇巴因能抑制肿瘤生长[8, 9], 作为细胞膜上钠钾泵(Na+-K+-ATP ase)抑制剂, 可通过Na+-K+-ATP酶α亚基特异性可逆结合抑制血管内皮细胞生长, 降低细胞黏附性, 促进钠钾泵内吞加快酶的溶解, 减少细胞内钠钾泵含量, 抑制钠钾泵功能, 导致细胞内ATP分解减少, 降低P-gp将药物排除体外能力, K+浓度下降或哇巴因可抑制钠钾ATP酶50%以上导致Na+浓度上升, 引起细胞膜超极化, 激活Na+/Ca2+
对向转运体, Ca2+浓度上升, 影响mdr-1基因转录翻译P-gp。本研究以非耐药人肝癌Bel-7402细胞系为亲代细胞, 采用ADM诱变产生Bel-7402/ADM模型, 以WB测定哇巴因干预前后P-gp表达, 利用抗原抗体特异反应, 有效排除其他蛋白质干扰。本文研究结果显示, 哇巴因干预前, 耐药组P-gp表达水平为(72.68±0.07), 对照组为(22.21±0.04);哇巴因干预后, 耐药组P-gp表达水平为(20.61±0.04), 对照组为(14.32±0.05);哇巴因干预后, 两组P-gp水平均显著低于哇巴因干预前, 差异有统计学意义(P<0.05);哇巴因干预前后耐药组P-gp水平均显著高于对照组, 差异有统计学意义(P<0.05)。由此说明肿瘤细胞耐药时P-gp呈高表达状态, 哇巴因可有效降低P-gp表达, 耐药组干预后可恢复至对照组未受干预状态, 增加肿瘤细胞对ADM敏感性, 实现逆转耐药作用。
综上所述, 哇巴因可有效下调肝癌细胞株的P-gp表达。
参考文献
[1] 中华人民共和国卫生和计划生育委员会医政医管局. 原发性肝癌诊疗规范(2017年版). 中华消化外科杂志, 2017, 16(7):635-647.
[2] 李慧, 路潜, 杨萍, 等. 原发性肝癌手术患者症状及延续照顾需求的研究. 中华护理杂志, 2015, 50(6):684-688.
[3] 祝普利, 尹超, 冯建龙. 原发性肝癌综合治疗进展. 临床肝胆病杂志, 2015, 31(6):965-968.
[4] Raderer M, Scheithauer W. Clinical trials of agents that reverse multidrug resistance. A literature review. Cancer, 1993, 72(12):
3553-3563.
[5] Gao J, Xie L, Chen WQ, et al. Rural-urban, sex variations, and time trend of primary liver cancer incidence in China, 1988-2005. European Journal of Cancer Prevention, 2013, 22(5):448-454.
[6] 楊超, 俸婷婷, 刘雄利, 等. 细菌多重耐药机制及其检测方法研究新进展. 中国病原生物学杂志, 2015(11):1047-1050.
[7] Alfarouk KO, Stock CM, Taylor S, et al. Resistance to cancer chemotherapy: failure in drug response from ADME to P-gp. Cancer Cell International, 2015, 15(1):71.
[8] 李杰, 徐忠伟, 程世翔, 等. 哇巴因诱发人神经胶质瘤U251细胞凋亡的机制. 武警后勤学院学报(医学版), 2016(3):174-177.
[9] Baker RM, Brunette DM, Mankovitz R, et al. Ouabain-resistant mutants of mouse and hamster cells in culture. Cell, 2015, 1(1):9-21.

