LncRNA-MEG3作为急性髓系白血病预后标志物调控细胞增殖
曾进龙 周志衡 陈宝欣 王彩霞
【摘要】 目的:探索长链非编码-MEG3(LncRNA-MEG3)与急性髓系白血病(AML)生存期的关系,并分析它对细胞增殖的调控作用。方法:采用过表达技术对AML细胞系HL-60、THP-1和U937的LncRNA-MEG3进行过表达,用MTT检测细胞增殖情况。收集初发未治的10例AML患者和10名健康人的骨髓标本及相关临床资料,用实时荧光定量PCR(qPCR)检测LncRNA-MEG3在骨髓中的表达情况。检测75例被确诊为AML患者骨髓中LncRNA-MEG3的表达情况,并跟踪随访5年,分析LncRNA-MEG3的表达与患者生存结局的关系。结果:与健康人比较,AML患者骨髓中LncRNA-MEG3的表达量明显下调,差异有统计学意义(P<0.01)。生存分析显示,MEG3低表达组患者的中位生存时间为21.162个月,明显短于MEG3高表达组的41.715个月(P<0.000 1)。MTT结果显示,LncRNA-MEG3过表达细胞组的细胞增殖明显低于阴性对照组,差异有统计学意义(P<0.05)。结论:LncRNA-MEG3在AML骨髓中表达下调,LncRNA-MEG3低表达可能是AML预后不良的新生物标记物,并能調控AML细胞的细胞增殖。
【关键词】 急性髓系白血病; 长链非编码RNA; 细胞增殖; 生物标志物
LncRNA-MEG3 as a Prognostic Marker of Acute Myeloid Leukemia Regulates Cell Proliferation/ZENG Jinlong,ZHOU Zhiheng,CHEN Baoxin,et al.//Medical Innovation of China,2019,16(23):00-005
【Abstract】 Objective:To explore the relationship between long-chain non-coding-MEG3(LncRNA-MEG3)and the survival period of acute myeloid leukemia(AML),and to analyze its regulatory effect on cell proliferation.Method:LncRNA-MEG3 of AML cell lines HL-60,THP-1 and U937 were overexpressed by overexpression technique,and the proliferation of the cells was detected by MTT.Bone marrow samples and relevant clinical data of 10 untreated AML patients and 10 normal people were collected,and the expression of LncRNA-MEG3
in bone marrow was detected by real-time quantitative PCR(qPCR).The expression of LncRNA-MEG3 in the bone marrow of 75 patients diagnosed with AML was detected and followed up for 5 years to analyze the relationship between the expression of LncRNA-MEG3 and survival outcome of patients.Result:Compared with healthy individuals,the expression of LncRNA-MEG3 in bone marrow of AML patients was significantly down-regulated,the difference was statistically significant(P<0.01).Survival analysis showed that the median survival time of patients in the MEG3 low-expression group was 21.162 months,significantly shorter than 41.715 months in the MEG3 high-expression group(P<0.000 1).MTT results showed that the proliferation of LncRNA-MEG3 overexpressed cells in the LncRNA-MEG3 overexpressed cells group was significantly lower than that in the negative control group,the difference was statistically significant(P<0.05).Conclusion:The expression of LncRNA-MEG3 in AML bone marrow is down-regulated,and the low expression of LncRNA-MEG3 may be a new biomarker of AML with poor prognosis,and can regulate the proliferation of AML cells.
【Key words】 Acute myeloid leukemia; Long non coding RNA; Cell proliferation; Biomarker
First-authors address:Zengcheng District Peoples Hospital of Guangzhou,Guangzhou 511300,China
doi:10.3969/j.issn.1674-4985.2019.23.001
母系表达基因3(maternally expressed gene 3,MEG3)是小鼠母体印记基因Gtl2的人类同系物,定位于染色体14q32.3,属于长链非编码RNA(long non-coding RNA,LncRNA)。有研究发现,MEG3在多种正常组织中表达,但在很多肿瘤细胞中表达下调或者表达缺失[1]。MEG3可能是肿瘤发生发展的新生物标记物[2-3],但它在血液肿瘤中的功能如何,仍未被阐明。本研究拟探索长链非编码LncRNA-MEG3与急性髓系白血病生存期的关系,并分析它对细胞增殖的调控作用。
1 材料与方法
1.1 实验材料
1.1.1 实验细胞系 白血病细胞株HL-60、THP-1和U937由广州赛哲生物科技有限公司实验室馈赠。培养体系为含10%胎牛血清的1640培养液,置于37 ℃、5% CO2培养箱中培养。
1.1.2 主要试剂与仪器 TRIzol(Gibco公司),PCR引物、PCR内参照引物(上海生工公司),逆转录试剂盒Fermentas K1622,TurboFect Transfection Reagents(Thermo Scientific),qPCR试剂盒(Promega公司)pcDNA3.0空载体和pcDNA3.0-MEG3质粒(上海吉玛制药有限公司),Ficoll(GE公司)。
1.1.3 患者来源 (1)检测LncRNA-MEG3差异表达的患者来源:2018年8月1日-10月30日在本院初发未治急性髓系白血病(AML)10例,患者均符合FAB诊断标准,其中男5例,女5例,年龄21~67岁,平均(34.40±4.12)岁;选取10名健康人作为健康对照组,其中男5例,女5例,年龄21~65岁,平均(34.10±3.91)岁。(2)生存分析的入组患者来源:根据FAB的诊断标准,选取本院于2012年2月-2013年12月在广州市第一人民医院确诊的75例AML患者标本库标本作为入组对象,收集这些患者的骨髓标本和相关临床资料,并对其进行随访。自确诊之日至死亡或最后随访截止日计算其生存时间,终点随访时间为2018年12月30日,随访时间均超过5年。
1.2 实验方法
1.2.1 总RNA提取及纯度和含量的鉴定 取1×106个MNCs用Trizol提取细胞总RNA,在1.8%琼脂糖电泳下可见三条清晰亮带(28S、18S、5S),证明所提RNA模板完整;用紫外分光光度计测定A260/A280比值均大于1.8,并进行RNA含量測定。
1.2.2 pcDNA3.0 MEG3质粒的细胞转染 细胞实验分为对照组、空载体组、MEG3质粒组。对照组细胞仅加转染试剂,空载体组转染pcDNA3.0质粒,MEG3质粒组转染pcDNA3.0-MEG3质粒。细胞培养获得对数生长期的细胞,接种于6孔板中,用Lipfectamine2000转染pcDNA3.0-MEG3,以转染空载体pcDNA3.0和未转染细胞作为对照,转染
24~48 h后,检测各组细胞LncRNA-MEG3表达水平。
1.2.3 细胞增殖实验 按照5 000个/mL的细胞密度接种于96孔板,每孔200 μL,每组设3个复孔,置于5% CO2、37 ℃培养箱中静置培养;细胞处理:U937、HL-60和THP-1细胞分别转染siRNA-NC、siLncRNA-MEG3,实验重复三次;培养结束前4 h,每孔加入5 mg/mL的MTT溶液20 μL,继续置于37 ℃、5% CO2培养箱中静置培养至结束;收集细胞并重悬,每孔加入150 μL DMSO,水平振荡10 min,酶标仪检测492 nm处的吸光值,绘制生长曲线。
1.2.4 人单个核细胞(mononuclear cells,MNCs)提取 白血病患者和健康人标本均为肝素抗凝新鲜骨髓,PBS稀释后,置于淋巴细胞分离液Ficoll上,在自动平衡离心机上1 500 r/min(Eppendorf,美国)离心20 min,吸取界面层MNCs,PBS洗涤2次,所得MNCs一部分用作抽提总RNA。
1.2.5 qPCR检测LncRNA-MEG3表达情况 各细胞的总RNA运用Fermentas K1622试剂(Thermo Scientific公司)逆转录为cDNA。逆转录为cDNA后,根据试剂说明书配置QPCR体系(20 μL):2×Master Mix(10 μL),Forward Primer(10 μM)(0.3 μL),Reverse Primer(10 μM)(0.3 μL)(序列:Forward:5-ATCCGTCCACCTTGTCT-3,Reverse:5-CCTCTTCATCCTTTGCCATC-3),cDNA(0.8 μL),nuclease-free Water(8.6 μL)。每样品每基因重复3次。在ABI Stepone Plus qPCR仪上设置QPCR反应程序:95 ℃,5 min;95 ℃,30 s;58 ℃,30 s,40个循环;72 ℃,15 s,95 ℃,15 s;60 ℃,1 min;95 ℃,15 s。
1.3 统计学处理 运用SPSS 19.0统计软件建立数据库并进行统计分析。符合正态分布的计量资料用(x±s)描述,比较用独立样本的t检验,三个时间点重复测量的MTT结果采用重复测量设计的方差分析。应用K-M法和生命表法计算中位生存率和累计生存率;运用对数秩检验(Log-rank)比较不同组的生存时间差异,双侧ɑ=0.05作为检验水准。P<0.05为差异有统计学意义。
2 结果
2.1 患者一般情况 本研究入组的急性髓细胞白血病患者75例,按照FBA分型M1、M2、M3、M4、M5分别是5、18、12、15、25例,M6、M7均为0例。其中男41例,女34例,年龄18~68岁,平均(34.20±4.12)岁。
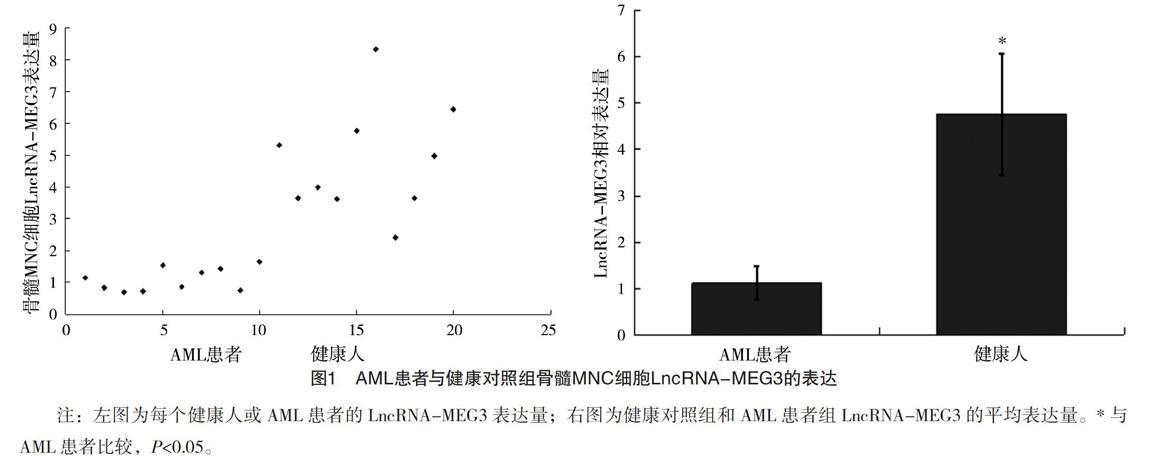
2.2 白血病患者与健康对照组MNC细胞LncRNA-MEG3的表达 健康人骨髓MNC细胞LncRNA-MEG3表达量为4.759±1.719,而AML患者骨髓MNC细胞LncRNA-MEG3表达量为1.109±0.362。与健康人比较,AML患者的骨髓标本中LncRNA-MEG3的表达明显下调,差异有统计学意义(t=-6.684,P<0.001),见图1。
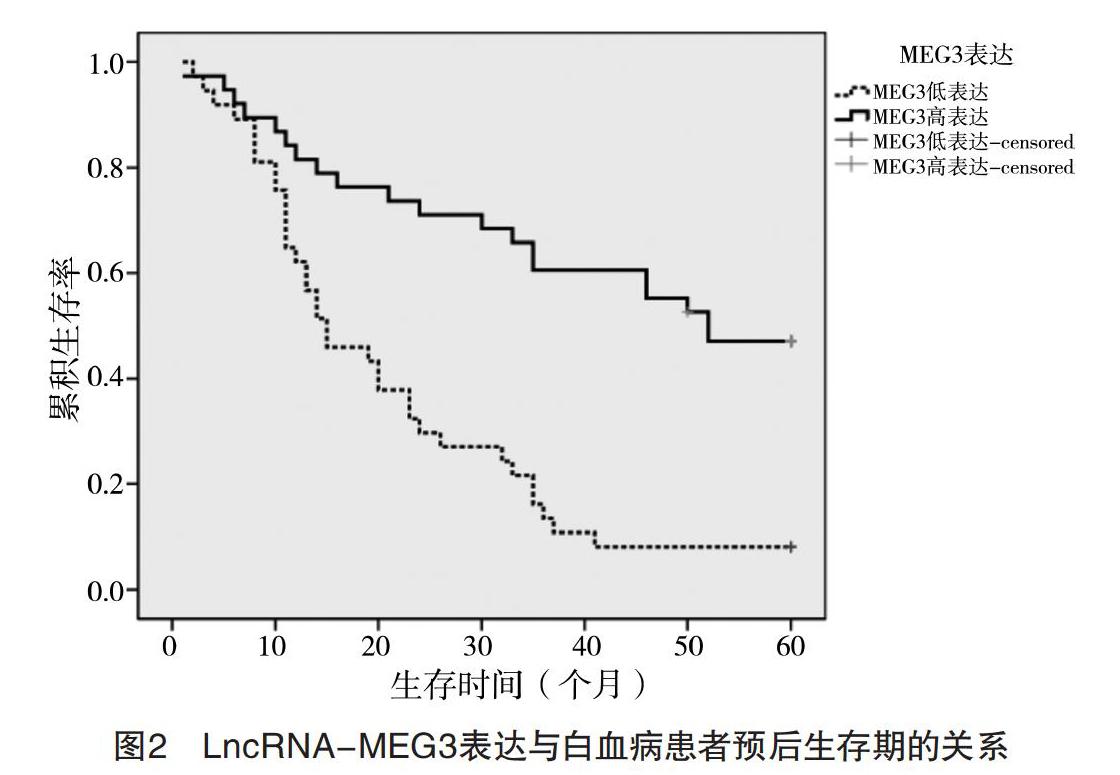
2.3 LncRNA-MEG3表达与AML患者预后生存期的关系 75例AML患者,中位生存时间为31.577个月,有20例(26.67%)患者达5年或5年以上长期生存。以LncRNA-MEG3表达量1.0为截点,把AML患者分为MEG3低表达组(37例)和高表达组(38例)。MEG3低表达组患者的生存时间2~60个月,中位生存时间为21.162个月,有3例(8.108%)患者的生存期5年以上;而MEG3高表达组患者的生存时间为1~60个月,中位生存时间为41.715个月,有17例(44.737%)患者的生存期5年以上。经对数秩检验(Log-rank)分析,MEG3高表达组的5年生存率(44.737%)和MEG3低表达组患者的5年生存率(8.108%)比较,差异有统计学意义(字2=19.117,P<0.000 1),见图2。
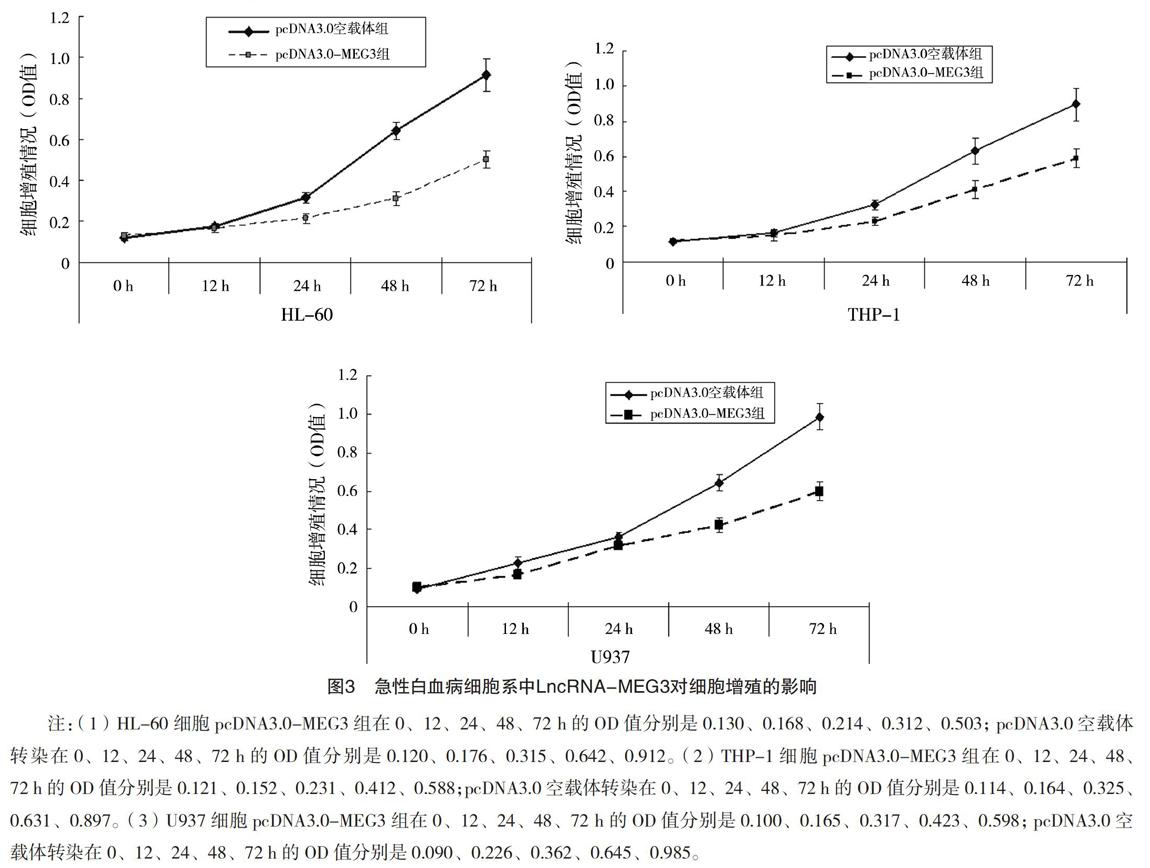
2.4 各细胞系LncRNA-MEG3过表达效果 HL-60、
THP-1和U937细胞分别用pcDNA3.0-MEG3和空载体pcDNA3.0转染48 h后,分别检测未转染细胞、空载体pcDNA3.0转染细胞和pcDNA3.0-MEG3转染细胞的LncRNA-MEG3表达水平。结果显示,
以上三种细胞被空载体pcDNA3.0转染后,LncRNA-MEG3表达量分别是(0.56±0.10)、(0.62±0.12)和(0.39±0.07);而被pcDNA3.0-MEG3转染后,以上三种细胞的LncRNA-MEG3表达量分别(5.78±0.58)、(6.42±1.21)和(5.15±0.77),pcDNA3.0-MEG3转染细胞的LncRNA-MEG3表达量明显上调,达到了过表达的效果。
2.5 AML细胞系中LncRNA-MEG3对细胞增殖的调控作用 在不同细胞系中,与pcDNA3.0空载体转染细胞比较,pcDNA3.0-MEG3转染细胞增殖受抑制。其中,HL-60和THP-1细胞系在转染24 h起,pcDNA3.0-MEG3转染细胞增殖(ODHL-60=0.214,ODTHP-1=0.231)低于pcDNA3.0空载体转染细胞(ODHL-60=0.315,ODTHP-1=0.325),差异有统計学意义(P<0.001),而U937细胞在转染48 h pcDNA3.0-MEG3转染细胞增殖(OD=0.423)低于pcDNA3.0空载体转染细胞(OD=0.645),差异有统计学意义(P<0.001),见图3。
3 讨论
近年来,LncRNA在肿瘤发病和预后的研究备受关注。LncRNA是继miRNA之后被科学家们重点研究的热点之一[4]。前期的研究证明,LncRNA在多种肿瘤中存在异常表达的现象,并在肿瘤发生和发展中起重要作用[5]。有研究显示,LncRNA在急性和慢性病白血病中也存在表达异常现象,并具有重要的调控功能[6-7]:LncRN-MIR100HG和As MONC参与了急性巨核细胞白血病的发生与发展[8],LncRNA NEAT1在急性早幼粒细胞白血病中的表达明显低于健康人的表达[9],LncRNA-ANRIL在急性淋巴细胞白血病中能调节p16INK4a;LncRNA急性髓性白血病中能参与沉默p15和p21基因。本课题在过去的研究也发现,LncRNA-H19、LncRNA-ENST00000414355在AML中具有调控细胞周期和细胞凋亡的作用,并与部分临床指标具有相关性。
目前,LncRNA在肝癌、肺癌等肿瘤的研究较多,而在白血病的研究报道有限[10-12]。特别是LncRNA在急性白血病中发生发展中的调控、与治疗和预后的研究仍处于起步阶段。基于此,本项目组开展了LncRNA-MEG3与AML生存时间的关系,并研究LncRNA-MEG3对AML细胞系的细胞增殖调控作用。本研究发现,AML患者骨髓单核细胞的LncRNA-MEG3表达量显著下调;AML患者中,骨髓单核细胞的LncRNA-MEG3表达量下调组的患者生存时间较LncRNA-MEG3高表达组的短。在三种急性白血病细胞系中,LncRNA-MEG3过表达细胞组的细胞增殖情况明显低于pcDNA3.0空载体转染组。以上结果提示,LncRNA-MEG3与AML发病和预后相关,并具有调控AML细胞增殖的功能。
既往大量的研究发现,LncRNA-MEG3在乳腺癌、肝癌、肺癌等多种肿瘤中呈现低表达的现象,同时还发现LncRNA-MEG3能抑制部分肿瘤细胞增殖的作用[13-16],MEG3可能是一种肿瘤抑制因子,可通过增强P53基因的活性而发挥调控作用[17-18]。然而,LncRNA-MEG3在急性髓系白血病中的调控功能如何、它的表达与该病的预后关系如何?调控机制如何?[19-20]尚未被阐明。本研究发现,LncRNA-MEG3在急性白血病中调控细胞增殖的功能,并发现LncRNA-MEG3低表达的患者生存时间较短,这提示LncRNA-MEG3可能是急性髓系白血病预后的一个新生物标志物,这和文献[21]报道LncRNA-MEG3在其他肿瘤的调控功能吻合。今后,笔者将继续扩大临床样本量和进一步延长患者的跟踪随访时间和增加观察指标,进一步验证LncRNA-MEG3在急性白血病中作为新生物标记物的效果,并深入探索LncRNA-MEG3的调控机制,为阐明LncRNA-MEG3在急性白血病预防、诊断和治疗的角色提供新思路。
参考文献
[1]王昱文,成秉林,张淑君.LncRNA的生物标记作用及MEG3在肿瘤中的研究进展[J].现代肿瘤医学,2017,25(2):308-311.
[2]刘珂,侯毅,郑稼.LncRNA MEG3对骨肉瘤细胞增殖、侵袭和凋亡的影响[J].郑州大学学报,2018,53(1):56-59.
[3] Xiu Y L,Sun K X,Chen X,et al.Upregulation of the LncRNA Meg3 induces autophagy to inhibit tumorigenesis and progression of epithelial ovarian carcinoma by regulating activity of ATG3[J].Oncotarget,2017,8(19):31714.
[4] Dong D,Mu Z,Wang W,et al.Prognostic value of long noncoding RNA ZFAS1 in various carcinomas:a meta-analysis[J].Onco Targets Ther,2017,8(48):84497-84505.
[5] Zheng Y,Liu L,Shukla G C.A comprehensive review of web-based non-coding RNA resources for cancer research[J].Cancer Lett,2017,407:1-8.
[6] Sun C,Luan S,Zhang G,et al.CEBPA-mediated upregulation of the lncRNA PLIN2 promotes the development of chronic myelogenous leukemia via the GSK3 and Wnt/β-catenin signaling pathways[J].Am J Cancer Res,2017,7(5):1054-1067.
[7] Miller C R,Ruppert A S,Fobare S,et al.The long noncoding RNA,treRNA,decreases DNA damage and is associated with poor response to chemotherapy in chronic lymphocytic leukemia[J].Oncotarget,2017,8(16):25942-25954.
[8] Emmrich S,Streltsov A,Franziska S.LincRNAs MONC and MIR100HG act as oncogenes in acute megakaryoblastic leukemia[J].Molecular Cancer,2014,13(1):171-182.
[9] Yu X,Li Z,Zheng H,et al.NEAT1:A novel cancer-related long non-coding RNA[J].Cell Prolif,2017,50(2):12329.
[10] Ziye Li,Lin Yang,Xiaojun Liu,et al.The Long Noncoding RNA MEG3 and its Target miR-147 Regulate JAK/STAT Pathway in Advanced Chronic Myeloid Leukemia[J].Bio Medicine,2018,34:61-75.
[11] Ji L,Li X.Long noncoding RNA MEG3 is a tumor suppressor in choriocarcinoma by upregulation of microRNA-211[J].J Cell Physiol,2019.
[12] Pang X,Feng G,Shang W,et al.Inhibition of lncRNA MEG3 protects renal tubular from hypoxia-induced kidney injury in acute renal allografts by regulating miR-181b/TNF-αsignaling pathway[J].J Cell Biochem,2019,120(8):12822-12831.
[13] Zhang L L,Hu D,Zou L H.Low expression of lncRNA MEG3 promotes the progression of oral squamous cell carcinoma by targeting miR-21[J].Eur Rev Med Pharmacol Sci,2018,22(23):8315-8323.
[14] Zhou X,Yuan P,Liu Q,et al.LncRNA MEG3 Regulates Imatinib Resistance in Chronic Myeloid Leukemia via Suppressing MicroRNA-21[J].Biomolecules & Therapeutics,2017,25(5):490-496.
[15] Binabaj M M,Bahrami A,Bahreyni A,et al.The prognostic value of long noncoding RNA MEG3 expression in the survival of patients with cancer:A meta-analysis[J].J Cell Biochem,2018,119(11):9583-9590.
[16]周晶,田野.長链非编码RNA MEG3在肿瘤发生中的研究进展[J].临床医学进展,2018,8(5):454-459.
[17] Wang H,Li Q,Tang S,et al.The role of long noncoding RNA HOTAIR in the acquired multidrug resistance to imatinib in chronic myeloid leukemia cells[J].Hematology,2017,22(4):208-216.
[18]范宁宁,耿敬姝.长链非编码RNA MEG3在人胶质瘤细胞中的表达及作用研究[J].实用肿瘤学杂志,2018,32(3):219-223.
[19] Feng S Q,Zhang X Y,Fan H T,et al.Up-regulation of LncRNA MEG3 inhibits cell migration and invasion and enhances cisplatin chemosensitivity in bladder cancer cells[J].Neoplasma,2018,65(6):925-932.
[20] Yao H,Duan M,Lin L,et al.TET2 and MEG3 promoter methylation is associated with acute myeloid leukemia in a Hainan population[J].Oncotarget,2017,8(11):18337-18347.
[21] Li Z Y,Yang L,Liu X J,et al.The Long Noncoding RNA MEG3 and its Target miR-147 Regulate JAK/STAT Pathway in Advanced Chronic Myeloid Leukemia[J].E Bio Medicine,2018,34:61-75.
(收稿日期:2019-03-19) (本文编辑:张爽)

