补肾中药对老化间充质干细胞内外微环境改变及其分化方向调控的影响
刘幸明, 赵永杰, 蔡俊笙, 王翰宇, 梁志强, 程志安*
(1.广州中医药大学,广东广州510405;2.河南省许昌市立医院,河南许昌461000;3.广东省中医院,广东 广州510120)
老化可使机体整体内环境发生巨大改变,也使骨髓内微环境与复杂的细胞内、外信号调控发生改变。衰老大鼠的氧化应激可能是导致年龄相关性骨丢失的重要致病机制[1],老化使间充质干细胞更趋向于分化为脂肪细胞,而不是成骨细胞,骨量持续性减少和丢失,导致骨质疏松症发生[2]。既往研究[3-4]表明,补肾中药能诱导间充质干细胞成骨分化、提高抗氧化能力抑制成脂分化,但它能否通过改变细胞内外微环境起到同样的作用尚不明确,故本实验为此进行了研究。
1 材料
金匮肾气丸、健骨二仙丸、六味地黄丸来源于广东省中医院药学部(金匮肾气丸由干地黄、山药、山萸肉、泽泻、茯苓、牡丹皮、桂枝、附子按8 ∶4 ∶4 ∶4 ∶3 ∶3 ∶1 ∶1 比例组成,健骨二仙丸由龟板、鹿角胶、党参、枸杞子、续断、山药按1 ∶1 ∶3 ∶6 ∶6 ∶6 比例组成;六味地黄丸由熟地黄、山药、山萸肉、泽泻、茯苓、牡丹皮按8 ∶4 ∶4 ∶4 ∶3 ∶3 比例组成)。清洁级健康SD 成年大鼠40 只,体质量(200±50) g,63~70 d,雌雄各半,购自广东省医学实验动物中心,动物生产许可证号SCXK(粤) 2013-0002。胎牛血清(货号SH30087.01)、DMEM-F12 培养基(货 号 SH30023.01B)、 DMEM-高 糖 培 养 基 (货 号SH30022.01B)、青链霉素(货号SH30010)、磷酸钾缓冲液(货号SH30256.01B) (美国Hyclone 公司);cellTiter 96 AQ 单溶液细胞增殖检测试剂(货号G3582,美国Promega公司);成骨诱导培养基、成脂诱导培养基(StemPro®Adipogenesis Differentiation Kit, 美 国Gibco 公 司, 货 号A10070-01)。洁净工作台(苏州安泰空气技术有限公司,型号SW-CJ-IFD);低速离心机(安徽中科中佳科学仪器有限公司,型号SC3614);倒置光学显微镜(型号CKX41、U-CTR30-2,日本Olympus 公司);细胞恒温培养箱(美国Thermo Scientific 公司,型号HERAcell150i);倒置荧光显微镜(德国Leica 公司,型号DMI6000B)。
2 方法
2.1 含药血清制备 金匮肾气丸、健骨二仙丸、六味地黄丸浓煎后,分别按照89.1、75.9、85.8 g/kg 剂量灌胃给药,每天2 次,连续7 d,最后1 d 灌胃给药后2 h 再次给药。第2 次给药后1 h,大鼠腹主动脉取血,离心,取上清,除菌,灭活,分装,-80 ℃保存备用。根据前期实验筛选出的10%含药血清[3],将其随机分为空白组、模型组、健骨二仙丸组、六味地黄丸组、金匮肾气丸组。
2.2 模型建立[5]及鉴定 10 只大鼠冲出骨髓细胞培养,每3 d 换液1 次,培养7 d,300 μmol/L H2O2处理24 h。然后,通过β-半乳糖苷酶染色鉴定,方法为固定15 min,洗涤,染色12 h,显微镜下观察。
2.3 细胞增殖检测 采用MTS 法。收集0、48 h 细胞,加入cellTiter 96 AQ 单溶液细胞增殖检测试剂4 h 后酶标仪读板,读取490 nm 波长处OD 值,计算增殖率,公式为增殖率= (48 h 平均OD 值/0 h 平均OD 值-1) ×100% (同一样品)。
2.4 成骨诱导、茜素红染色及ALP 活性检测 当各组细胞贴壁生长达到80%融合时成骨诱导,培养3 d 后再维持7 d,观察细胞形态,检测ALP 活性,具体检测步骤按试剂盒说明书进行。继续培养至14 d 后,茜素红染色鉴定成骨细胞。
2.5 成脂诱导及油红O 染色 成脂诱导方法同“2.4” 项下成骨诱导。培养7 d 后,油红O 染色鉴定脂肪细胞。
2.6 相关因子检测 经典TRIzol 提取总RNA,检测浓度、提纯、逆转录,rRT-qPCR 采用一步法,按照说明书进行操作,2-△△Ct法分析各基因表达差异。然后,应用Invitrogen在线引物设计软件OligoPer-fectTM Designer 设计, 采用BLAST 进行比对,探针序列由美国Invitrogen 公司合成,根据NCBI 数据库序列设计(CollagenΙ ID 100199754,Runx2 ID 12393,DLX5 ID 13395,OSX ID 170574,OCN ID 632,PPARγ2 ID 19016,C/EBPβ ID 12608,TAZ ID 66826),引物序列见表1。

表1 引物序列
2.7 TAZ 蛋白表达检测 采用Western blot 法。裂解→收集→调整浓度→煮沸→冷却→电泳→转膜→TAZ 一抗→37 ℃孵育2 h→洗膜→二抗→洗膜→转膜→显影。
2.8 统计学分析 通过SPSS 19.0 软件进行处理,数据以表示,组间比较采用方差分析。P<0.05 表示差异有统计学意义。
3 结果
3.1 氧化模型及成骨、成脂效果鉴定 氧化后老化间充质干细胞在β-半乳糖苷酶染色阳性率明显增加,细胞核周围有天蓝色颗粒,补肾中药处理后阳性率明显减少,H2O2处理后老化间充质干细胞增殖减少,而药物处理后增加。表2、图1 显示,与空白组比较,模型组扁平状、分布稀疏的老年细胞数量明显增加;与模型组比较,成脂诱导的细胞均被油红O 染为红色,各补肾中药组红染减少,而成骨诱导后细胞均被茜素红染为棕褐色,各补肾中药组染色增加;模型组ALP 活性显著低于空白组(P<0.05),各补肾中药组显著高于模型组(P<0.05)。
表2 各组对H2O2 诱导衰老细胞的影响

表2 各组对H2O2 诱导衰老细胞的影响
注:与空白组比较,*P<0.05;与模型组比较,△P<0.05
组别 细胞药物敏感性增殖率/% ALP 活性空白组 10.38±0.82 1.98±0.02模型组 -42.22±0.84* 0.29±0.01*金匮肾气丸组 22.54±0.85△ 0.69±0.14△健骨二仙丸组 23.75±0.36△ 0.87±0.22△六味地黄丸组 19.72±1.24△ 0.60±0.16△
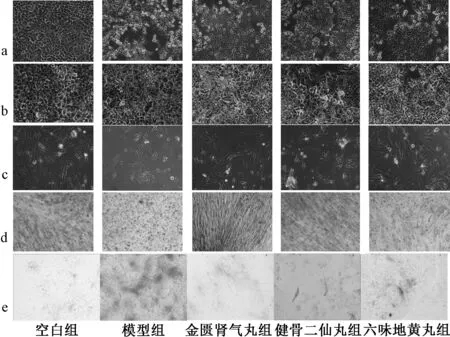
图1 各组细胞显微镜图(×100)
3.2 成骨、成脂诱导因子mRNA 表达 表3 ~4 显示,与空白 组 比 较, 模 型 组OCN、 Collagen Ⅰ、 DXL5、 OSX、RunX2、TAZ mRNA 表达显著下调 (P <0.05),PPARγ2、C/EBPβ mRNA 表达显著上调(P<0.05);与模型组比较,各补肾中药组OCN、DXL5、OSX、RunX2、TAZ mRNA 表达显著上调(P<0.05),PPARγ2、C/EBPβ mRNA 表达显著下调(P<0.05)。
3.3 TAZ 蛋白表达 图2 显示,与空白组比较,模型组TAZ 蛋白表达显著下调(P<0.01);与模型组比较,各补肾中药组其蛋白表达有所上调,其中金匮肾气丸组、六味地黄丸组差异有统计学意义(P<0.05)。
表3 各组成骨诱导因子mRNA 表达比较

表3 各组成骨诱导因子mRNA 表达比较
注:与空白组比较,*P<0.05;与模型组比较,△P<0.05
组别 CollagenΙ Runx2 DLX5 OSX OCN空白组 1.00±0.21 1.00±0.08 1.00±0.10 1.00±0.06 1.00±0.17模型组 0.27±0.01* 0.13±0.01* 0.40±0.03* 0.22±0.02* 0.36±0.04*金匮肾气丸组 0.30±0.04 0.32±0.03△ 0.90±0.02△ 0.79±0.11△ 0.53±0.05△健骨二仙丸组 0.45±0.05 0.43±0.01△ 0.52±0.11 0.55±0.01△ 0.76±0.09△六味地黄丸组 0.36±0.04 0.66±0.18△ 0.64±0.04△ 0.79±0.12△ 0.81±0.19△
表4 各组成脂诱导因子mRNA 表达比较

表4 各组成脂诱导因子mRNA 表达比较
注:与空白组比较,*P<0.05;与模型组比较,△P<0.05
组别 PPARγ2 C/EBPβ TAZ空白组 1.00±0.06 1.00±0.09 1.00±0.30模型组 4.28±0.27* 6.39±0.56* 0.21±0.04*金匮肾气丸组 2.60±0.32△ 4.12±0.08△ 0.68±0.08△健骨二仙丸组 3.48±0.78△ 3.96±0.91△ 0.68±0.04△六味地黄丸组 2.96±0.50△ 3.09±0.54△ 0.87±0.05△

图2 各组TAZ 蛋白表达
4 讨论
机体衰老时,内环境氧化应激水平增高,抗氧化能力降低,导致骨质量下降,骨皮质变薄,骨髓脂肪组织增多,具有多项分化潜能的间充质干细胞特性、增殖活性、端粒酶活性、端粒长度、分化能力与方向随之改变,一方面涉及老化所致的细胞自身内在因素改变,另一方面涉及细胞外骨髓内微环境的改变。从细胞自身来说,Runx2 为特异性成骨细胞转录因子和成骨细胞分化的关键调节因子,而OSX、Runx2 是多条信号通路的共同下游基因,可作为其下游基因启动成骨基因[6-8];TAZ 作为共同激活因子,可刺激Runx2 转录而抑制PPARγ2 转录,从而调节间充质干细胞向成骨细胞分化,老化使其水平下调,干细胞更趋向与脂肪分化;ALP 活性正向反映成骨细胞分化水平[9],Ⅰ型胶原是骨细胞外基质的主要有机成分,前者表达取决于后者产生量;OCN 在成骨晚期的表达随着细胞分化和基质矿化而增加,常作为矿化晚期的标志物使用[10]。在骨钙素、骨涎蛋白、Ⅰ型胶原的调控序列上,均存在Dlx5 的结合位点,能促进骨基质的矿化,增强Runx2 基因P1 启动子的活性,促进成骨分化[11]。PPARγ2 正向调节脂肪生成,是脂肪细胞形成合成通路的中心转录调控因子[6,12-13]。在分化早期,C/EBPβ 被活化后表达增加,随后激活C/EBPα,协同PPARγ2 共同调控脂肪分化。本实验表明,缺少C/EBPβ的胚胎成纤维细胞脂肪生成能力明显减低[14]。
《素问·阴阳脏象大论》指出, “肾主骨生髓,精生髓、髓居其中,髓养骨,骨生髓,聚髓为脑”,故中医治疗骨病大多以补肾为主。有学者认为,间充质干细胞相当于中医的“精” “髓”[15],补肾中药调节氧化衰老细胞内微环境,促进精血津液化生,并使之转化为能量,促进生长,就骨骼生长发育方面而言,主要体现在促进成骨抑制成脂。课题组前期从补肾中药中选择补肾阴(六味地黄丸)、补肾阳(金匮肾气丸)、补肾填精(健骨二仙丸[16]),发现其含药血清能通过调控细胞内微环境来促进间充质干细胞增殖,增强细胞活性,抑制成脂促进成骨。
另外,补肾中药可防止氧自由基过量产生,具有抗氧化作用[17]。氧化处理后,细胞内抗氧化系统失衡,产生大量活性氧族,使p16、p21、p53 基因表达增加而引起早衰,当有大量活性氧族在体内聚集时,可通过p53 作用使得下游靶点p21 抑制CDK/cyclin 复合体活性,并下调pRb/E2F轴,降低间充质干细胞自我更新及再生能力,促进衰老,同时p53/p21 途径还可通过与p16/pRb 途径相互作用来共同诱导细胞内出现早熟性衰老[18]。本实验中β-半乳糖苷酶染色和ALP 活性检测均显示,氧化可使细胞衰老,下调OCN、DXL5、OSX、RunX2、TAZ 表达,上调PPARγ2、C/EBPβ mRNA 表达,促进成脂分化抑制成骨分化;补肾中药处理后,增强了衰老细胞活性,提升OCN、DXL5、OSX、RunX2、TAZ 表 达,抑 制PPARγ2、C/EBPβ mRNA 表 达,逆转成脂分化的趋势,促进成骨分化。
本实验通过氧化诱导衰老模型,验证了补肾中药能通过改变细胞内成骨、成脂相关因子的表达,同时调节细胞外微环境促进精血津液化生,从而促进细胞生长、成骨分化。但本实验仅停留在大分子阶段,对于更小分子(如miRNA 等) 的影响还需进一步探究。

