响应面法的脂肪酶富集金枪鱼油中二十二碳六烯酸甘油酯工艺优化的研究
陈 莹 Cheong LingZhi 赵家和 陈洁妙 乙丛敏 丛艳霞 李 晔 芦晨阳 周 君 苏秀榕
(宁波大学食品与药学学院1,宁波 315800)(中国农业科学院油料作物研究所2,武汉 430062)
金枪鱼主要以生鱼片、寿司、罐装食品等方式被消费,未被利用的副产物高达35%~40%,金枪鱼油则是其中主要的副产物之一,如何对其进行有效的综合利用是当前亟待解决的重要问题之一[1-3]。研究发现,金枪鱼油中含有一定量的ω-3系列脂肪酸——二十二碳六烯酸(Docosahexaenoic Acid, C22H32O2,DHA) , DHA作为细胞膜形成的主要成分,在婴幼儿的大脑和视力发育方面有着重要影响[4-8]。怀孕期间ω-3脂肪酸的缺乏与婴儿的视觉和行为缺陷有关,这些缺陷无法通过产后补充来逆转[4]。除此之外,ω-3脂肪酸还可以帮助降低早产率和或增加妊娠期[9-11];在抗炎、提高机体免疫功能、抑制癌症的产生与转移方面也具有明显的效果[12, 13]。
虽然人体中能够通过α-亚麻酸合成DHA,但是合成速度缓慢,因此需要从食物中额外补充[4]。与游离脂肪酸和乙酯形式相比,酰基甘油或磷脂形式的膳食DHA不仅在氧化稳定性方面表现更加优异,也更加有利于人体内的消化吸收[14, 15]。然而,由于酰基甘油形式的天然金枪鱼油中DHA的含量仅20%左右[16],难以满足人们的需要,因此,选择一种合适的方法富集金枪鱼油中的DHA将具有重要意义。脂肪酶选择性催化水解富集酰基甘油形式的DHA在实验和企业生产过程中都取得了不错的效果,这是由于ω-3多不饱和脂肪酸中的顺式双键的空间位阻和弯曲,使甲基基团接近酯键,脂肪酶不能进入和水解ω-3多不饱和脂肪酸的酯键[17],在水解过程中产生的游离饱和脂肪酸和单不饱和脂肪酸可以通过皂化或分子蒸馏除去,从而产生富含ω-3 PUFA的酰基甘油馏分(包括甘油一酯,甘油二酯,甘油三酯)。酶法提取与传统方法如分子蒸馏、尿素包合法等相比具有多种优点,主要体现在酶催化反应条件温和,降低了DHA聚合、氧化等风险[18-25];对底物选择性高,减少了能源消耗,是一种重要的绿色可持续的富集方法[20, 21]。目前,脂肪酶水解富集ω-3脂肪酸也面临一些瓶颈,主要包括反应时间较长(>24 h),富集水平(<40%)和酰基甘油产率较低(<50%)[26, 27]。例如,Mbatia等人[26]使用Thermomyceslanuginosus脂肪酶反应24 h,仅将尼罗河鲈鱼内脏油中的EPA和DHA浓度从12%提高到35%。因此,在寻找高选择性脂肪酶,优化和改造水解过程以获得高产率的富含ω-3 PUFA的酰基甘油级分方面,需要做更多的工作。
本研究利用皱褶假丝酵母脂肪酶选择性水解法提高金枪鱼油中DHA的含量,皱褶假丝酵母脂肪酶富集DHA的能力主要归因于脂肪酸选择性,据报道,皱褶假丝酵母脂肪酶由用于识别底物链的L形隧道组成,该隧道非常适合油酸的空间要求,由于这个原因,皱褶假丝酵母脂肪酶对于广泛的脂肪酸链长度是非特异性的,但对长链多不饱和脂肪酸呈现低活性[28]。这保证了皱褶假丝酵母脂肪酶能够有效富集酰基甘油中的DHA。通过系统研究水解反应条件(水油质量比、脂肪酶添加量、水解温度和时间),获得富集DHA甘油酯的最优工艺,为实现DHA甘油酯产品的工业化生产提供参考。
1 材料与方法
1.1 材料与试剂
金枪鱼油;皱褶假丝酵母脂肪酶;37种脂肪酸甲酯混标;GF254薄层色谱硅胶;甲醇(95%)、乙醇、甲醇、氯仿、氢氧化钾、酚酞、一水硫酸氢钠、乙醚、正己烷、甲酸、碘均为分析纯或色谱纯。
1.2 仪器与设备
RO15多点磁力搅拌器;3A-401WP24恒温水浴锅;TDL5M离心机;EL204电子天平;Agilent7890A气相色谱仪;M7-80EI质谱仪。
1.3 方法
1.3.1 DHA甘油酯富集工艺
皱褶假丝酵母脂肪酶促鱼油水解→水解产物皂化脱酸→薄层层析定性分析→酸价测定→DHA含量测定
1.3.1.1 皱褶假丝酵母脂肪酶水解反应
按照水油质量比例(2∶1、1∶2、1∶7、1∶15、1∶47)称取一定量鱼油置入50 mL锥形瓶中,称取一定量皱褶假丝酵母脂肪酶(1%、3%、5%、7%)溶解在去离子水中,再将酶液转移入锥形瓶(水油总质量20 g),充分混合均匀。将上述锥形瓶密封,置于一定温度(30、40、50、60 ℃)的恒温多点磁力搅拌器(转速300 r/min)反应一定的时间(0.5、1、2、4、6、10 h)。反应结束后,将上述混合溶液95 ℃水浴10 min使脂肪酶灭活,然后在4 000 r/min条件下离心10 min,分离油相和水相。
1.3.1.2 水解产物皂化脱酸
根据前人方法进行皂化过程以除去水解的游离脂肪酸[29]。取200 μL酶解后的油样,加入2 mL去离子水、2 mL无水乙醇(溶解油样,加速皂化过程),1 mL 0.5 mol/L的氢氧化钾-乙醇(皂化以除去游离脂肪酸),混合均匀完成对油样的脱酸皂化。然后用正己烷萃取溶液中的甘油酯成分。简而言之,向上述溶液中加入4 mL正己烷混合均匀,在3 000r/min条件下离心10 min。离心后,上层为含有甘油酯成分的正己烷,下层为脂肪酸钾、乙醇等皂化液。取上清液至离心管中备用,下层再加入4 mL正己烷用相同方式萃取一次,合并两次萃取得到的含有甘油酯的正己烷溶液。将上述正己烷溶液氮吹至恒重则得到富含DHA甘油酯的油样。
1.3.1.3 薄层层析定性分析
取25 μL氮吹后的油样溶解到100 μL的氯仿-甲醇(2∶1)中,用点样器点样于薄层板上,一般为圆点,点样基线距底边2.0 cm。在层析缸中加入展开剂,展开剂为乙醚-正己烷-甲酸(60∶40∶1)。将载有样品的薄层板置入层析缸中,上行展开,自然晾干后,置碘蒸气中显色至斑点完全显现。最后根据薄层层析结果判断水解下来的脂肪酸和甘油酯是否分离。
1.3.1.4 酸价测定
参照GB 5009.229—2016《食品中酸价的测定》[30]进行水解产物酸价的测定。将含有0.5 mL酚酞指示剂的50 mL乙醇溶液置入锥形瓶中,用0.1 mol/L的氢氧化钾溶液滴定至溶液变色,并保持溶液15 s不褪色,即为终点。然后将中和后的乙醇溶液转移至装有一定量鱼油样品的锥形瓶中,充分混匀。用氢氧化钾标准溶液滴定,滴定过程中要充分摇动。至溶液颜色发生变化,并且保持15 s不褪色,即为滴定终点[25]。酸价计算公式:
X=C×(V-V0)×56.11/m
式中:X为试样的酸价(以氢氧化钾计/mg/g);V为试样消耗氢氧化钾标准溶液的体积/mL;C为氢氧化钾标准溶液的实际浓度/mol/L;V0为乙醇消耗氢氧化钾标准溶液的体积/mL;m为试样质量/g;56.11为氢氧化钾的摩尔质量/g/mol。
1.3.1.5 DHA含量测定
将金枪鱼油甘油酯部分的脂肪酸甲基化并根据AOCS方法Ce-1c 89进行分析[31]。简而言之,将100 mg油溶解在4 mL正己烷中,通过向油溶液中加入200 μL 0.5 mol/L氢氧化钠甲醇溶液进行甲基化,然后将混合物在室温下搅拌2 min。最后,将上层有机层通过无水硫酸钠柱过滤并回收到GC小瓶中,用正己烷稀释10倍后进行分析。
色谱柱:DB-WAX聚乙二醇气相毛细柱(60.0 m×250 μm×0.25 μm),升温程序:50 ℃保持1 min后,以25 ℃/min升至200 ℃,以3 ℃/min升至230 ℃保持15 min,再以3 ℃/min升至250 ℃;载气(He)流速 1.0 mL/min,压力 10 kPa,进样量1 μL;不分流模式。
1.3.1.6 甘油酯(包括甘油一酯,甘油二酯和甘油三酯)得率计算
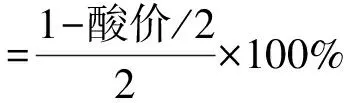
1.3.2 实验设计1.3.2.1 单因素实验
以DHA富集和甘油酯得率为指标,分别选取不同水解参数进行研究,确定最适水油质量比、脂肪酶添加量、反应温度和反应时间。
1.3.2.2 响应面实验
在响应面实验的基础上,选取水油质量比、脂肪酶添加量、反应温度和反应时间4个因素为自变量,以DHA、ω-3含量和甘油酯得率为响应值,根据box-behnken进行响应面分析实验。
2 结果与分析
2.1 金枪鱼油脂肪酸组成
金枪鱼油脂肪酸组成见表1,金枪鱼油中含有36.43%的饱和脂肪酸,24.63%的单不饱和脂肪酸以及38.94%的多不饱和脂肪酸。ω-3脂肪酸占比为30.70%,其中包括24.59%的DHA,5.6%的EPA以及少量的α-亚麻酸(0.51%);相比于较高含量的ω-3脂肪酸,金枪鱼油中的ω-6脂肪酸含量较低,只有3.09%;在饱和脂肪酸中,十六烷酸的含量最高(22.81%),其次是十四烷酸(3.95%);单不饱和脂肪酸中十八碳烯酸和十六碳烯酸的含量最高,分别达到15.49%和7.34%。

表1 金枪鱼油脂肪酸组成
2.2 脂肪酶水解条件单因素实验
以DHA、ω-3含量和甘油酯得率为指标,分别选取不同水解参数进行研究,确定最适水∶油比、脂肪酶添加量、反应温度和反应时间。
2.2.1 水油质量比对DHA、ω-3含量和甘油酯得率的影响
固定反应温度为40 ℃,脂肪酶:鱼油比3%,水解时间为4 h,其他条件保持不变,控制水∶油比2∶1、1∶2、1∶7、1∶15和1∶47,比较水∶油比对富集效果的影响。水油质量比例对富集效果的影响如图1所示,在水∶油比1∶2时, DHA和ω-3含量最高,分别为40.26%和46.84%。DHA和ω-3的含量随着水油质量比例的增大而增大,水油质量比达到1∶2后,甘油酯得率随着水油质量比例的增大而减小,水∶油比为1∶7时,水解反应达到动态平衡。综合考虑甘油酯中DHA的富集量和甘油酯得率,选取1∶7为最优水油质量比例。
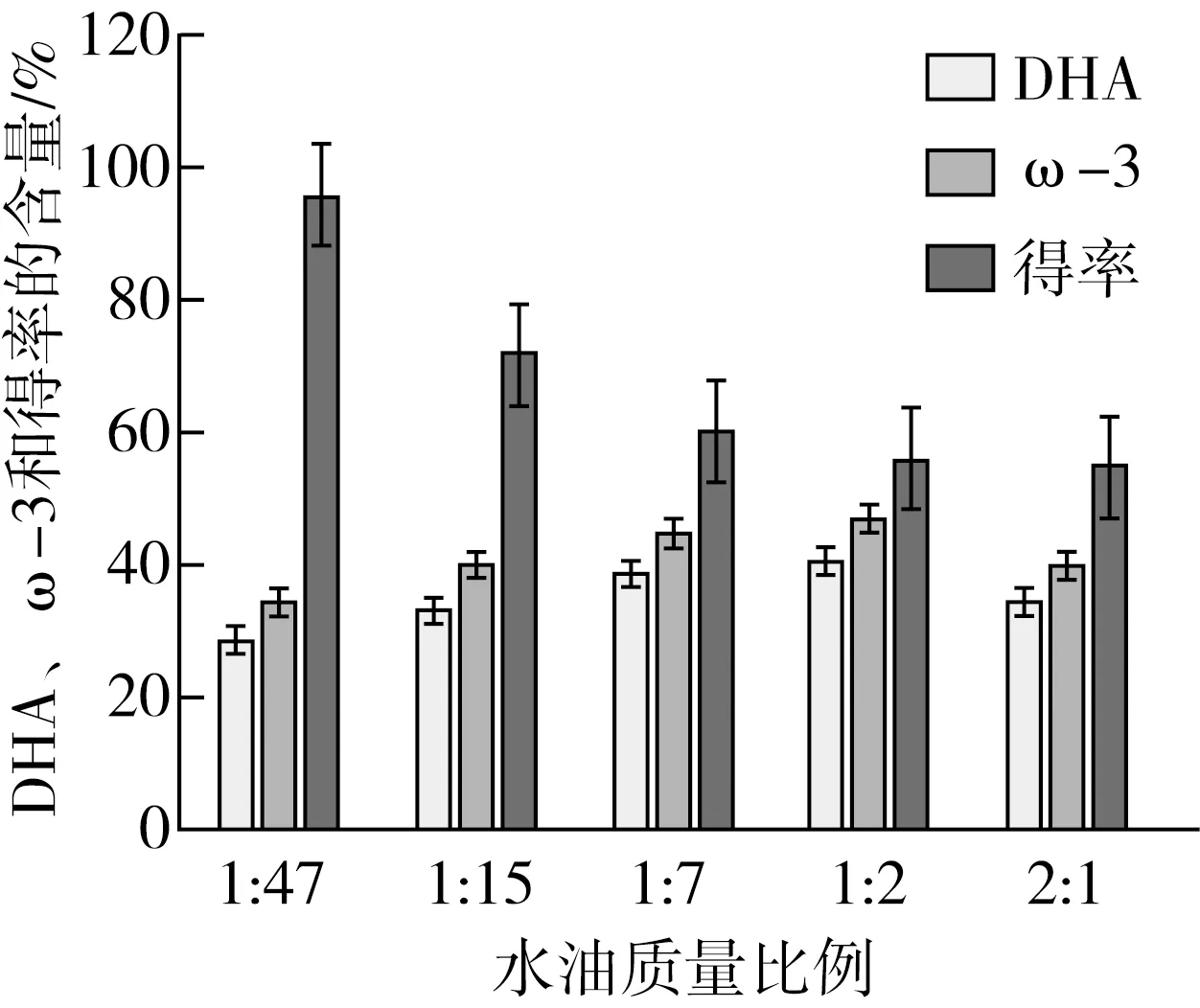
图1 水油质量比例对富集效果的影响
2.2.2 脂肪酶添加量对DHA、ω-3含量和甘油酯得率的影响
脂肪酶添加量对富集效果的影响如图2所示,脂肪酶的添加量对DHA和ω-3的富集量没有显著性的影响。当酶添加量由鱼油质量的1%增加到5%时,甘油酯中的DHA和ω-3质量分数分别保持在38%~40%和44%~46%。此外,甘油酯得率也不随脂肪酶的添加量变化而趋于58%~60%,加酶量为5%时略有上升趋势。结果表明,脂肪酶的添加量在鱼油质量的1%~5%范围,酶量足够,底物达到饱和,因此DHA、ω-3含量和甘油酯得率无明显变化。当酶量超过5%时,DHA和ω-3含量呈现下降趋势,得率呈现上升状态。反应体系中加入较高的酶会导致反应混合物的不当混合,从而促进传质的限制。从成本角度出发考虑,脂肪酶价格昂贵,因此本试验选取1%鱼油质量为最优加酶量。
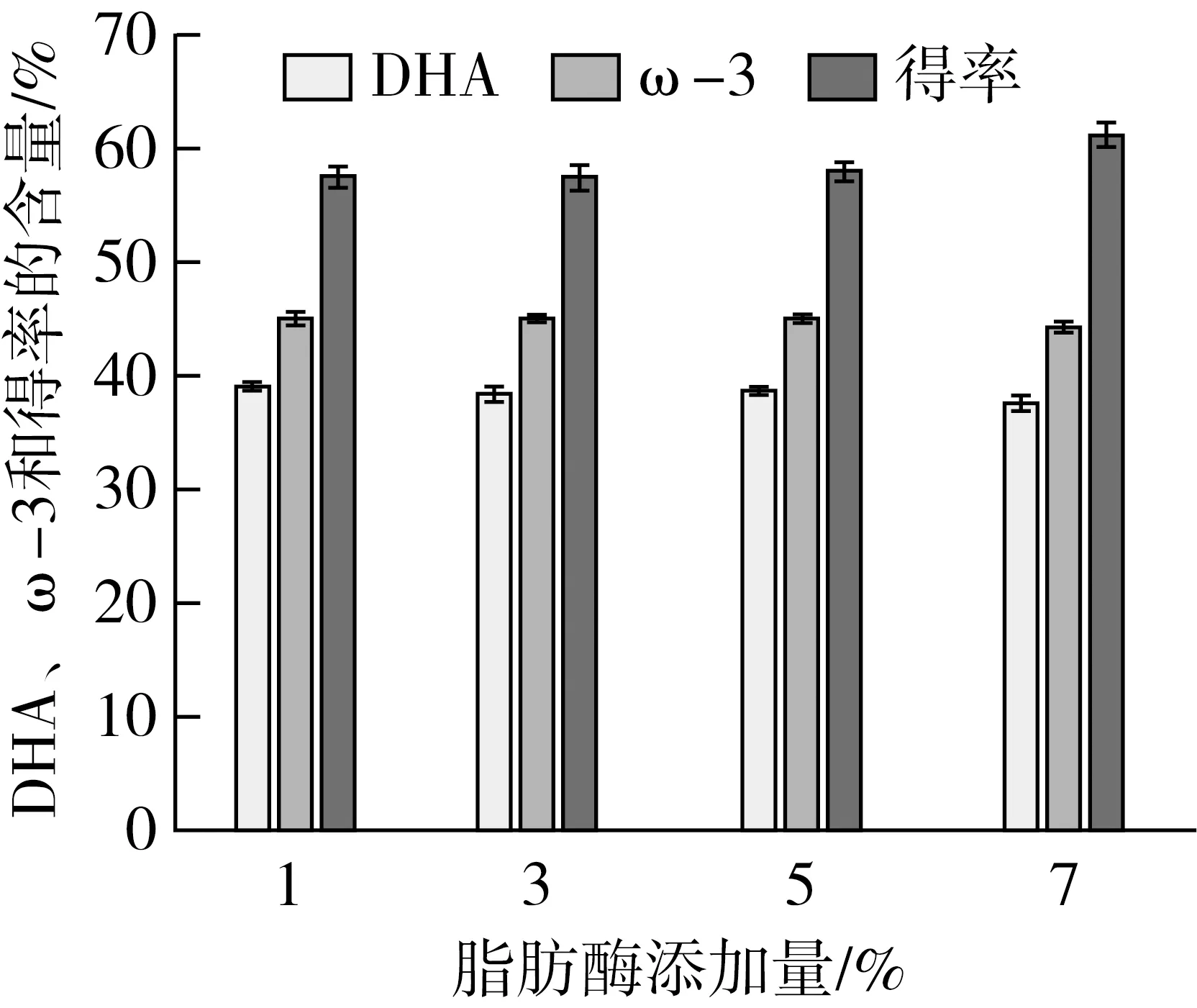
图2 脂肪酶添加量对富集效果的影响
2.2.3 温度对DHA、ω-3含量和甘油酯得率的影响
DHA和ω-3含量在水解温度为40 ℃时达到最高,分别为39.62%和45.93%。DHA和ω-3含量随着温度的升高而升高,达到40 ℃后,DHA和ω-3含量随着温度的升高而减少,温度达到60℃时,DHA和ω-3的质量分数分别减少至34.36%和42.17%。得率在30%~50 ℃趋于58%~60%,50 ℃之后随着温度的升高而增大,60 ℃时得率达到66.79%。这与酶的性质有关。低温抑制酶的活性,酶催化作用受到限制,水解能力减弱,使得水解反应不足以充分进行,进而导致DHA和ω-3含量偏低。在脂肪酶的最适温度效应达到最高,水解能力达到最强。随着温度的继续升高,酶的活性受到限制,水解能力减弱,酸价降低,得率增高。因此选择40 ℃为最佳水解温度。温度对富集效果的影响如图3所示。

图3 温度对富集效果的影响
2.2.4 水解时间对DHA、ω-3含量和甘油酯得率的影响
水解时间对富集效果的影响如图4所示,在水油质量比例、脂肪酶添加量和温度一定的条件下,DHA和ω-3含量无明显变化,结果表明水解时间对结果影响不大,皱褶假丝酵母脂肪酶能够在较短时间内迅速水解脂肪酸组分,延长水解时间对富集效果无太大贡献。由图可知,水解4 h获得的DHA和ω-3含量稍高,因此选取4 h为最佳水解时间。
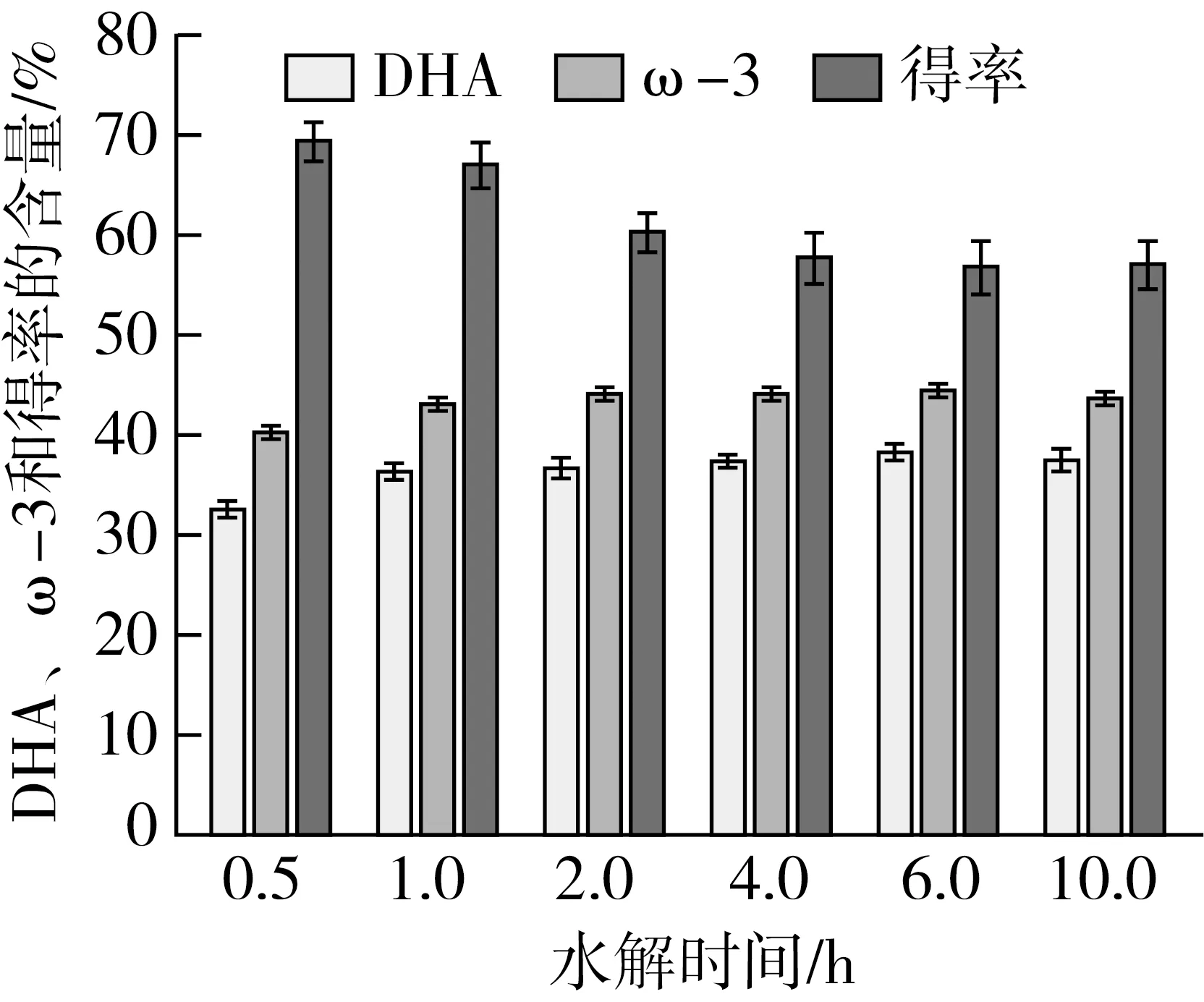
图4 水解时间对富集效果的影响
2.3 Box-Behnken响应面实验
在单因素实验的基础上,使用design expert8.0.6软件对响应面实验进行设计,对水油质量比例、脂肪酶添加量、温度和水解时间进行优化,以甘油酯中DHA含量及甘油酯得率为响应值,设计四因素三水平响应面实验,得出最优水解条件并进行验证分析。金枪鱼油中DHA甘油酯的制备响应面实验因素水平表见表2。Box-Behnken设计及实验结果见表3。

表2 金枪鱼油中DHA甘油酯的制备响应面实验因素水平表

表3 Box-Behnken设计及实验结果
DHA回归模型方差分析表见表4,DHA含量=-4.61+1.27A+1.11C+14.90D-0.01A2-0.09C2-5.04D2。DHA回归模型的P值小于0.000 1, DHA模型影响显著,说明不同条件下所制备的富含DHA的甘油酯差异显著。失拟项P值为0.352 7,远大于0.05,失拟项不显著,说明实验得到的DHA模型选择合适。各因素对实验的影响主次顺序为D>D2>A2>C2>A>C,显然对DHA含量影响最大的是水油质量比例,其次是温度,最后是时间。水油质量比例对结果的影响高度显著(P<0.000 1)。P值大于0.05,温度和水解时间对DHA含量影响不显著,这与其他研究有所不同。温度和水解时间对模型影响不显著,但为维护模型的层次结构不予以消除。
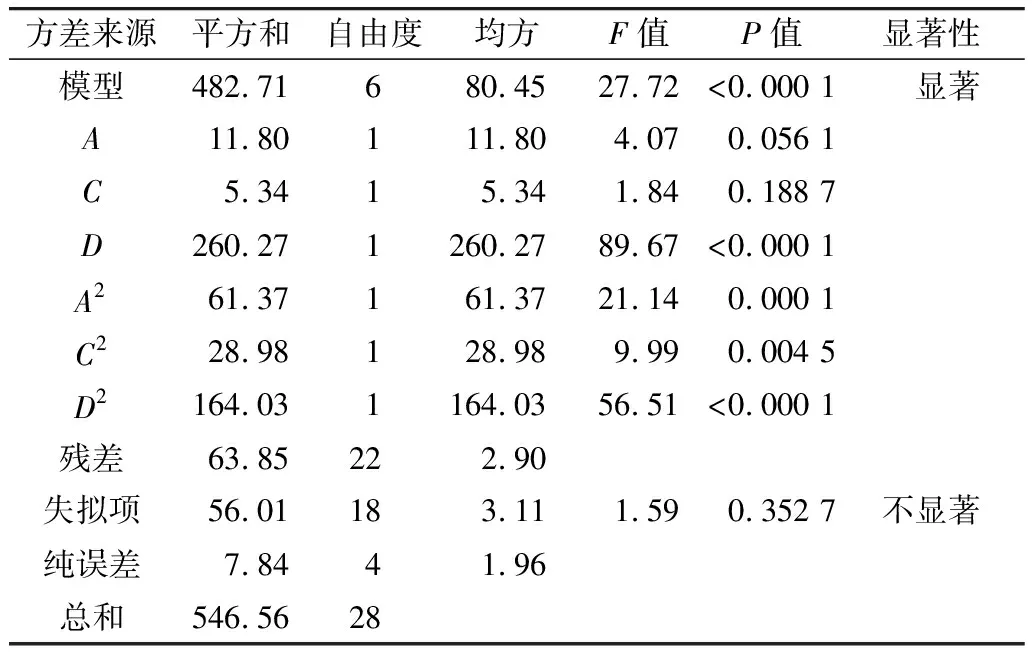
表4 DHA回归模型的方差分析表
注:R2=0.883 2; AdjustedR2=0.851 3。
水油质量比例与温度及水解时间的交互作用对DHA含量的影响的响应面图如图5-6所示。由图5可知,当温度、水解时间和加酶量为定值时,DHA含量随着水油比的增高呈现先升高后下降的趋势。最优水油比落在0.81~1.21之间,水油比在0.81之前,DHA含量随着水油比的增高而增加,水油比在1.21之后,DHA含量随着水油比的增高而呈下降趋势。这主要受两方面影响,第一,酯水解过程可逆,水过少或过多都不利于反应向水解方向进行。第二,脂肪酶作用于油水两相形成的微乳液,水过少时不能形成微乳液;水过多导致油水两相形成的微乳液分层,脂肪酶作用的界面减小。由图6可知,温度的最优范围在42~48 ℃之间,且随着温度的升高,DHA含量呈现先升高后降低的趋势,出现这种现象的原因是因为酶有最适温度,温度过低或过高都会使酶活性减弱,不利于反应的进行。

图5 水油质量比例和时间对富集DHA的影响响应面图
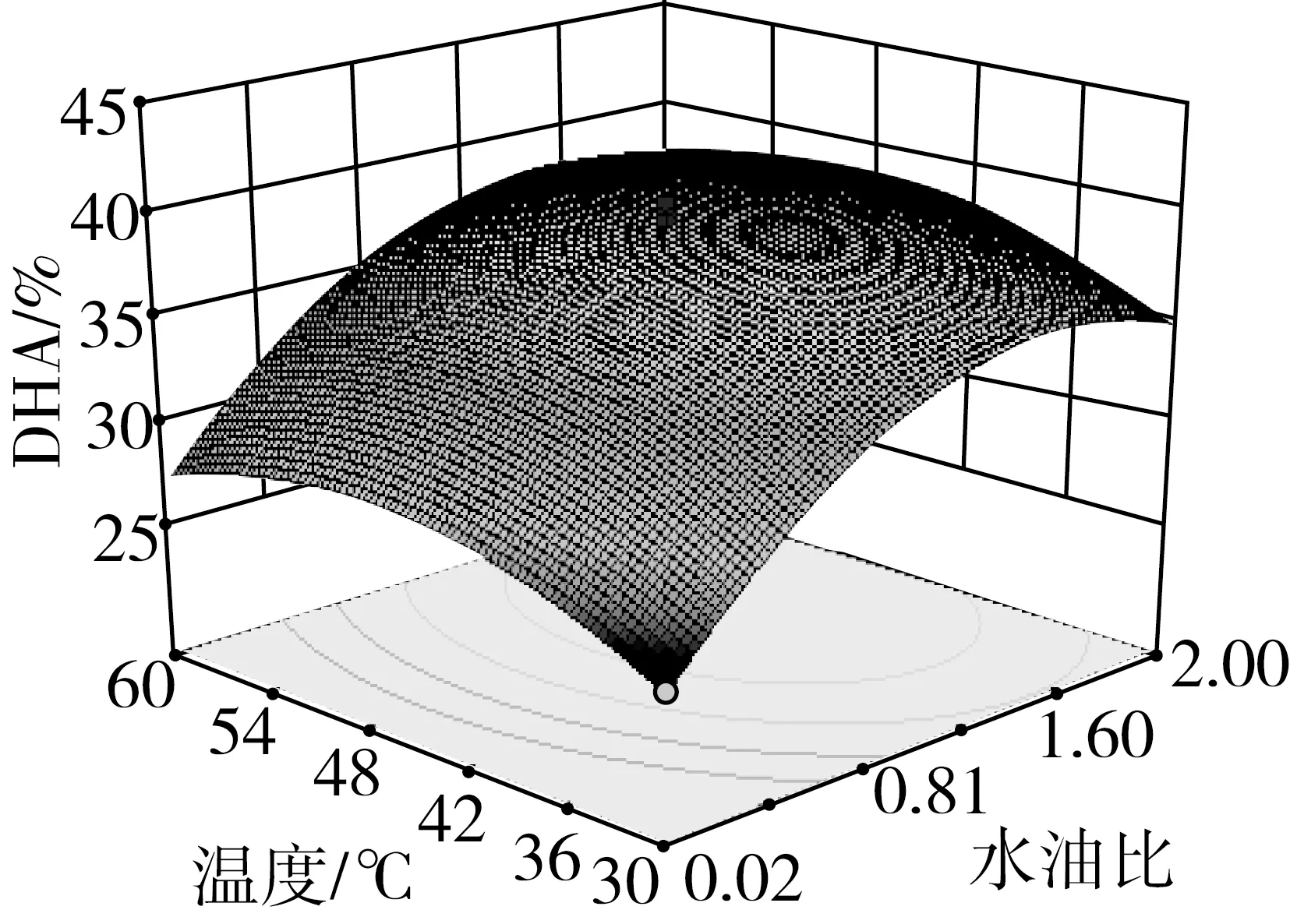
图6 水油质量比例和温度对富集DHA的影响响应面图
得率回归模型方差分析表见表5,甘油酯得率=118.12-0.09A-2.98B-8.02C-47.83D+0.06AC+0.30BC+0.22C2+15.63D2。得率回归模型的P值小于0.000 1, DHA模型影响显著,说明不同条件下制备的富含DHA的甘油酯型鱼油得率差异显著。得率回归模型的失拟项P值为0.059 6,略大于0.05,这表明了得率模型的失拟项不显著,说明实验得到的得率模型选择合适。表5结果显示,各因素对实验的影响主次顺序为C>D>D2>B>C2>A>AC>BC,显然对得率影响最大的是水解时间,其次是水油质量比例,最后是脂肪酶添加量和温度。四个自变量因素水解时间(P<0.000 1),水油质量比例(P<0.000 1),脂肪酶添加量(P<0.05),温度(P<0.05)对甘油酯得率有显著性的影响。其中水解时间和水油质量比为高度显著项。显著因素交互作用的P值均大于0.05,表明各因素的交互作用对得率影响均不显著。
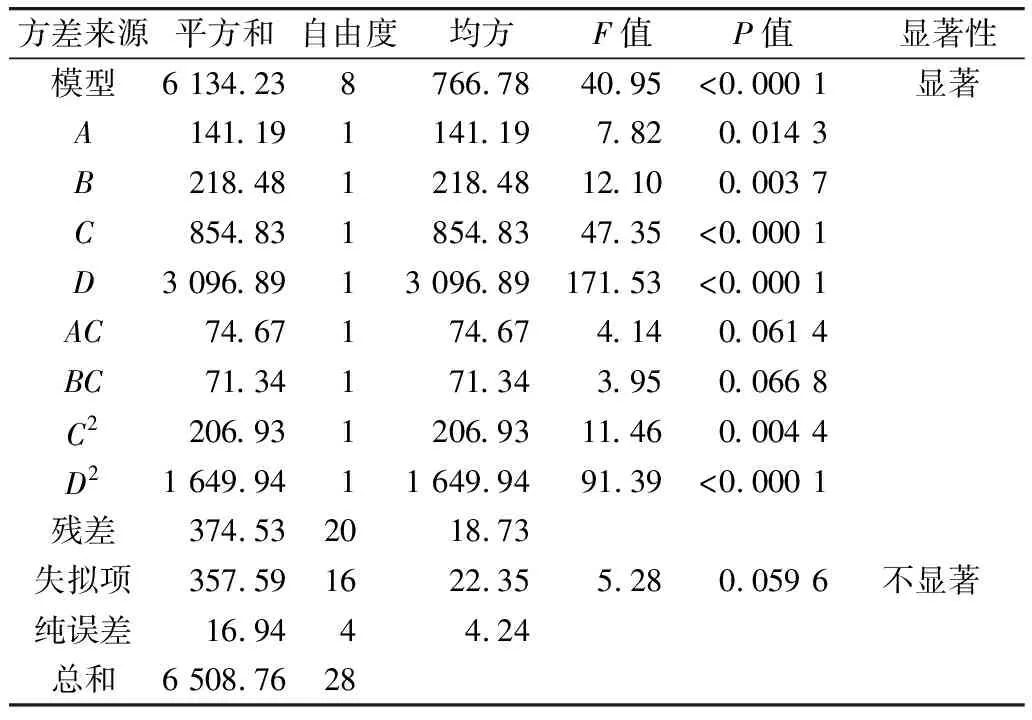
表5 得率回归模型的方差分析表
注:R2=0.942 5; AdjustedR2=0.919 4。
2.4 最优水解条件确定与验证
经过design expert软件分析,综合考虑选出的理论最优水解条件为:温度50 ℃、水解时间3 h、脂肪酶添加量为鱼油质量的1%和水油质量比例为1∶1.7,采用公式拟合得到的预测值为DHA质量分数35.55%、ω-3质量分数42.25%、得率73.85%。经过两次平行实验验证,实测值为 DHA含量36.58%,ω-3质量分数44.68%,得率63.78%,实测值和预测理论值接近,表明模型准确。
3 结论
3.1 单因素实验结果显示,水油质量比例对酶促反应具有明显影响,水油质量比例为1∶2时,富集得到的DHA和ω-3含量均最高;脂肪酶添加量为鱼油质量的1%~5%时,DHA含量、ω-3含量和得率三者都保持稳定;40 ℃时富集效果最佳;DHA和ω-3含量随着水解时间的增加略有增加,得率随水解时间的增加略有下降,变化幅度不大,延长水解时间对增大反应程度无太大作用。
3.2 响应面实验表明,各影响因素交互作用均不显著,最优水解条件为水油质量比例1∶1.7、脂肪酶添加量为鱼油质量的1%、温度50 ℃和水解时间3 h,在此条件下得到的预测值为:DHA质量分数为35.55%、ω-3质量分数为42.25%、得率73.85%。实测值:DHA质量分数为36.58%,ω-3质量分数为44.68%、得率63.78%,与理论预测结果接近。因此模型可以预测DHA、ω-3含量和甘油酯得率。

