桃胶多糖及其协同EGCG抗醉解酒作用研究
左婧驰,陈云,郭馨阳,桂琳,任天星,陈静,卯玉嵘,袁发浒
(江汉大学医学院,湖北武汉430056)
我国饮酒文化自古有之,因过度饮酒引发的疾病问题也伴随而来,节假日期间急性酒精中毒案例更是屡见不鲜。急性酒精中毒往往导致患者胃肠道粘膜溃烂出血,加重肝脏代谢解毒负担,亲脂性乙醇甚至会引起脑组织氧化损伤,危害极大[1-2]。因而,开发高效安全的抗醉解酒产品具有重要意义。
桃胶多糖(peach gum polysaccharide,PGP)是近年来被广泛研究的一种天然来源多糖,其主要由阿拉伯糖、半乳糖、木糖、鼠李糖等以β-糖苷键聚合而成[3]。以往研究表明PGP 具有良好的吸湿保湿性,同时具有良好的黏度和成膜性,具备良好的工业加工属性[4-6],此外,PGP 还具有降血糖、提高免疫力、改善肠道菌群等诸多优良生物学特性,是保健食品开发的重要资源[7-10]。目前,尚未见将PGP 应用于抗醉解酒方面的研究、开发。本研究通过体外、体内试验观察PGP 抑制乙醇析出、保护胃肠道粘膜作用,同时进一步研究PGP 与天然抗氧化剂表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)协同的抗醉解酒作用,并对其生物学机制做分析探讨。
1 材料与方法
1.1 材料与试剂
原桃胶(食品级):香港位元堂药厂有限公司;食用酒精(95%,食品级):河南荣腾食品配料有限公司;透析袋(3 500 D):北京索莱宝科技有限公司;乙醇检测分析试剂盒:美国BioVision 公司;蛋白浓度测定试剂盒:上海碧云天生物科技有限公司;丙二醛(malonaldehyde,MDA)检测试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒、一氧化氮(NO)检测试剂盒、前列腺素 E2(prostaglandin E2,PGE2)测试盒、乙醇脱氢酶(alcohol dehydrogenase,ADH)测定试剂盒、乙醛脱氢酶(acetaldehyde dehydrogenase,ALDH)活性测试盒:南京建成顶浩生物制技有限公司。
1.2 试验动物
昆明小鼠,雄性,体质量22 g~25 g:湖北省疾病预防控制中心,许可证号:SCXK(鄂)2015-0018。小鼠饲养于温度23 ℃~25 ℃、湿度40%~60%的SPF 级动物房内,自由进食饮水。所有动物实验均于江汉大学医学实验动物中心内完成,实验经江汉大学医学伦理委员会批准实施。
1.3 仪器与设备
电子分析天平(ME204E):瑞士梅特勒-托利多;电热恒温水浴锅(HH.S):上海博迅医疗生物仪器股份有限公司;光吸收全波长酶标仪(SP-Max 2300A2):上海闪谱生物科技有限公司;台式高速冷冻离心机(H1650R):湖南湘仪实验室仪器开发有限公司;紫外可见分光光度计(Evolution 300):赛默飞世尔科技(中国)有限公司。
1.4 方法
1.4.1 PGP 对乙醇渗出的影响
以原桃胶为原料,采用徐燕等[3]所述方法提取制备桃胶多糖,即依次经热水浸提、乙醇沉淀、Sevage 去蛋白等工序后提取分离得到桃胶多糖。
以超纯水溶解,分别配制0.5%、1.0%、1.5%、2.0%桃胶多糖溶液。用透析袋夹将透析袋一端夹住,加入10 mL 人工胃液,然后分别加入不同浓度的桃胶多糖溶液和生理盐水,将其放入装有250 mL 生理盐水的广口瓶中,0.5 h 后加入5 mL 食用乙醇于透析袋内,随即夹闭透析袋另外一端,将透析袋完全浸入广口瓶内生理盐水中,用parafilm 封口膜封住瓶口,置于37 ℃培养箱中。采用刘佳[11]所述重铬酸钾酸性还原法,分别于试验起始点 0、5、10、15、20、30、40、50、60、90 min 测定透析袋外溶液的乙醇浓度,以610 nm 处吸光度表示。
1.4.2 PGP 对急性酒精中毒小鼠的解酒作用
将雄性昆明小鼠分为6 组,每组8 只,试验开始前8 h 禁水禁食,以0.5 mL/25 g 剂量分别给予生理盐水0%、0.5%、1.0%、1.5%、2.0%PGP 灌胃,0.5 h 后,再以0.4 mL/25 g 分别给予60%食用乙醇灌胃制备急性酒精中毒模型。试验开始后,记录小鼠翻正反射消失的时间为小鼠醉酒潜伏期时长,翻正反射消失至小鼠翻正反射再次恢复的时长为醉酒睡眠时间。
1.4.3 PGP 协同EGCG 对急性酒精中毒小鼠的血清乙醇含量的影响
与单独使用PGP 观察对小鼠急性酒精中毒模型试验操作类似,分别设空白对照组、模型组、2%PGP预处理组、2 % PGP+100 mg/kg EGCG 预处理组、2 %PGP+200 mg/kg EGCG 预处理组、2 % PGP+400 mg/kg EGCG 预处理组,每组15 只小鼠,除对照组外以等体积生理盐水灌胃外,其余各组在干预后0.5 h 后均0.4 mL/25 g 分别给予60%食用乙醇灌胃,分别于乙醇灌胃后0.5、1.0、1.5、2.0 h 采集小鼠眼眶静脉血,分离血清,按BioVision 乙醇检测试剂盒操作指南检测血清乙醇含量。
1.4.4 PGP 协同EGCG 对急性酒精中毒小鼠的肝组织、胃组织生化指标的影响
小鼠于乙醇灌胃2.5 h 后,采用颈椎脱臼法处死,解剖小鼠,分离出胃及肝脏,纵向剖开小鼠胃,生理盐水洗去胃内容物,观察小鼠胃肠粘膜损伤情况。按生化检测试剂盒的使用说明分别检测胃组织MDA 含量、NO 含量、PGE2 含量、SOD 活力及肝组织 ADH 活力、ALDH 活力。
1.4.5 数据处理与统计学分析
数据采用graphpad prism 6.0 软件进行分析处理,计量数据以均值±标准差表示,组间比较采用单因素方差分析,检验水平α=0.05。
2 结果与分析
2.1 PGP浓度依赖性抑制体外乙醇渗出速率
以透析袋法体外模拟乙醇吸收试验,分别以0.5%、1.0%、1.5%、2.0%的PGP 溶液预处理,与生理盐水对照相比,各浓度PGP 预处理后,乙醇析出速率如图1所示(以重铬酸钾酸性还原反应液OD610nm表示[12])。

图1 不同浓度PGP 对体外模拟乙醇吸收的影响Fig.1 Effects of different concentrations of PGP on simulated ethanol absorption in vitro
由图1 可知乙醇析出速率均下降,且随着PGP 浓度的增加,乙醇析出速度越慢。同时,可见空白对照组在试验开始后乙醇析出线性增加,60 min 后乙醇析出基本完全,而PGP 处理后,乙醇析出速率仅于试验开始30 min 内呈现线性快速析出,而后析出速度明显减缓,且随着PGP 浓度的增加,最终析出的乙醇总量相应减少。表明PGP 具有吸附乙醇分子,减缓乙醇渗出的作用。
2.2 PGP延长小鼠醉酒潜伏期、缩短醉酒后睡眠时长
不同浓度PGP 对小鼠醉酒潜伏期及酒后睡眠时长的影响如图2 所示。
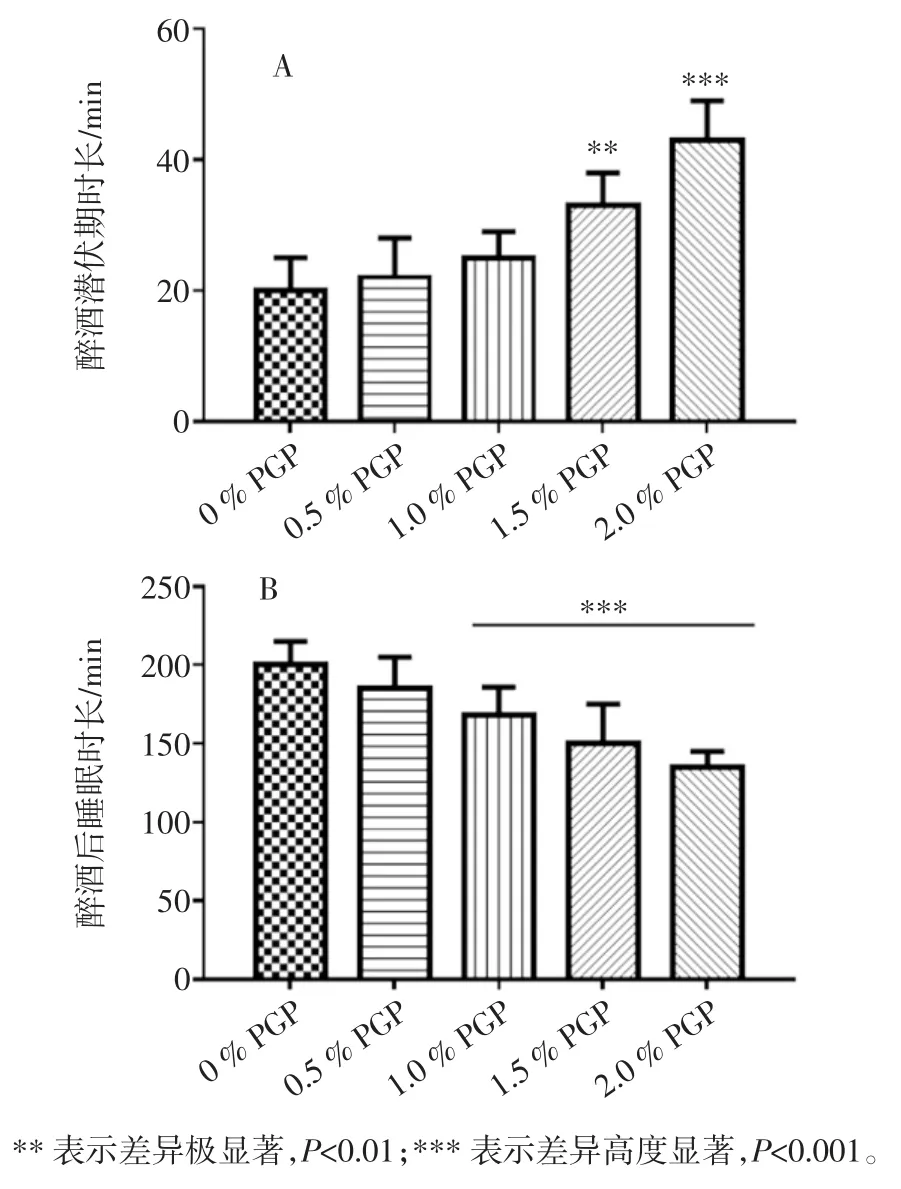
图2 不同浓度PGP 对小鼠醉酒潜伏期及酒后睡眠时长的影响Fig.2 Effects of different concentrations of PGP on drunken latency and sleep length in mice
小鼠经60%食用乙醇灌胃造模后,随着灌胃PGP浓度的增加,可见小鼠醉酒潜伏期随之延长(图2A),浓度为1.5 %、2.0 %的PGP 处理组分别较空白对照(0 %PGP)的醉酒潜伏期时长显著提高(P<0.01,P<0.001)。
醉酒后睡眠时间对比如图2B 所示,可见1 %、1.5 %及2%的PGP 灌胃预处理后的小鼠均较空白对照小鼠的睡眠时间缩短且差异显著具有统计学意义(P<0.001),随着PGP 浓度的升高,相应的睡眠时间逐渐缩短。
2.3 PGP协同EGCG显著降低醉酒小鼠血清乙醇浓度
动态追踪PGP 与EGCG 协同作用对醉酒小鼠血清中乙醇浓度的变化,如表1 所示。
小鼠血清乙醇浓度在灌胃酒精后,血清乙醇浓度先逐渐升高后下降。在2%PGP 单独干预及2%PGP加不同浓度的EGCG 干预后,在监测的0.5、1.0、1.5、2.0 h 这4 个节点,均分别较模型组小鼠的血清乙醇浓度下降,且随着EGCG 浓度的增加,血清乙醇浓度降幅相应增加。
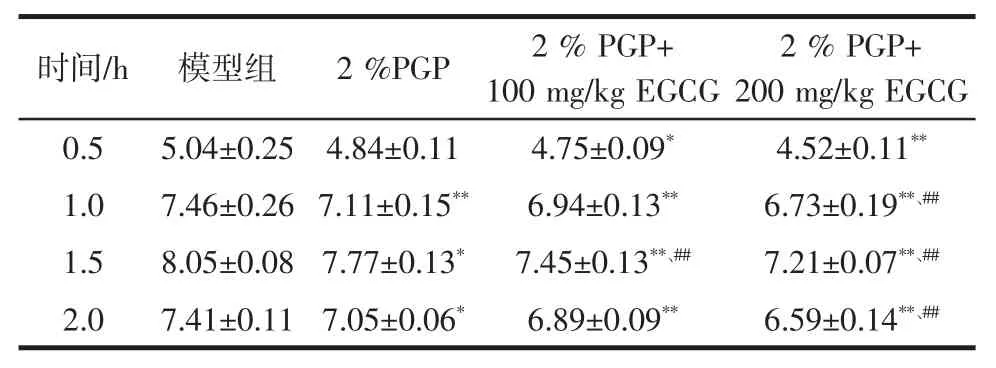
表1 PGP 与EGCG 对醉酒小鼠血清乙醇浓度变化的影响Table 1 Effects of PGP and EGCG on serum alcohol concentration in drunken mice
2.4 PGP协同EGCG显著缓解急性乙醇性胃粘膜损伤
解剖小鼠后,分离出小鼠胃,剖开后清洗去除胃内容物后,小鼠胃粘膜组织形态如图3 所示。
由图3 可知,模型组小鼠胃粘膜组织整体充血红胀,并有多处出血点及少量糜烂(图3B);2%PGP 预处理组小鼠胃粘膜组织充血显著减轻,可见局部、分散的血管充盈红胀(图3C);2 % PGP 与不同浓度EGCG 共同处理后,小鼠胃粘膜组织充血情况显著改善,且随着EGCG 浓度的增加,胃粘膜组织出血点随之减少,2%PGP+400 mg/kg EGCG 处理组小鼠胃粘膜外观与空白对照组接近,偶见零星点状充血(图3D~F)。

图3 PGP 协同EGCG 对小鼠胃粘膜损伤的保护作用Fig.3 Protective effect of PGP combined with EGCG on gastric mucosal injury in mice
为进一步深入分析PGP 与EGCG 对乙醇性小鼠胃粘膜损伤的保护作用[13-15],检测了胃组织的氧化损伤指标MDA 含量及SOD 活力,如表2 所示。
模型组小鼠胃组织MDA 含量较空白对照组显著增加、SOD 活力显著下降,呈现明显地氧化性损伤。而PGP 干预后,氧化损伤指标得到明显逆转,且随着EGCG 浓度的升高,逆转程度相应升高。
一氧化氮(NO)是胃组织重要的保护因子,胃粘膜损伤后NO 的合成增加并可抑制胃酸分泌,有利于胃粘膜损伤后的修复过程[14,16-18]。如表2 所示,小鼠灌胃后NO 水平显著下降,经PGP 或PGP 与不同浓度的EGCG 预处理后的小鼠NO 水平较模型组有显著逆转,且PGP 与EGCG 协同干预后,NO 水平较单独使用PGP 的小鼠上升幅度增加(P<0.05)。同样地,另一种胃组织保护因子,前列腺素E2(PGE2)[18-19]与呈现出与NO 一样的变化趋势,PGP 及EGCG 可显著抑制因大剂量乙醇对胃组织损伤导致的PGE2 含量的损失。
2.5 PGP协同EGCG提高醉酒小鼠肝脏乙醇代谢酶活
肝脏是机体代谢乙醇最主要的器官(大于90 %),乙醇在肝内经乙醇脱氢酶(ADH)催化后转化为乙醛,再由乙醛脱氢酶(ALDH)催化转为乙酸,而后进一步分解并最终转为二氧化碳和水。其中ADH 和ALDH是乙醇代谢最为关键的酶[20-22],表3 所示为各组小鼠ADH、ALDH 活力变化情况。
由表3 可知,经PGP 预处理后,小鼠肝脏ADH活力较模型组(6.78±0.51)U/mg pro 显著增加(7.38±0.63)U/mg pro,P<0.05,且 EGCG 分别与 100、200、400 mg/kg EGCG 联用后,ADH 活力均较单独使用2%PGP 组小鼠升高,且2%PGP+400 mg/kg EGCG 组较单独2 % PGP 组具有非常显著统计学的差异(P<0.01)。与ADH 变化趋势一致,2%PGP 亦可增加小鼠ALDH 活力(504.45±30.31)U/mg pro,且 PGP 与不同浓度的EGCG 联用后一样地较单独使用PGP 具有更高的ALDH 水平,呈剂量依赖性增加,差异均有统计学意义(P<0.01)。
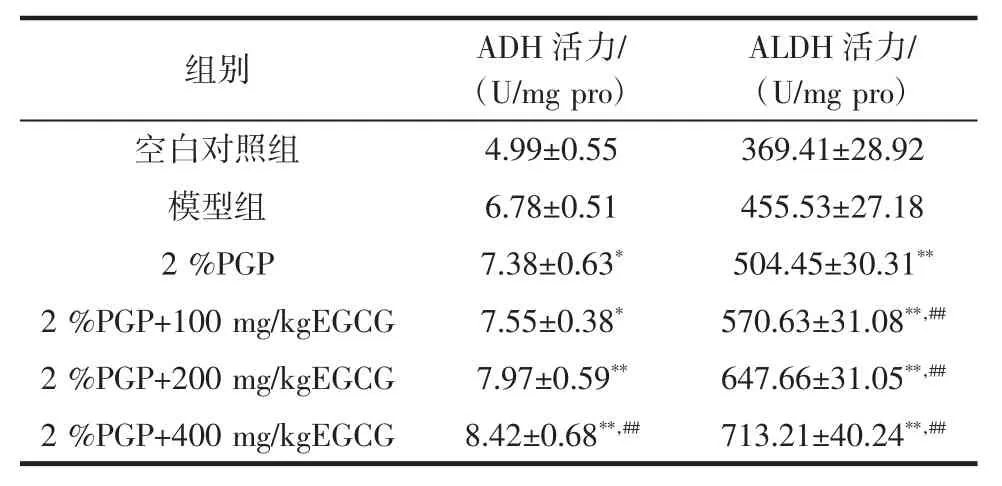
表3 PGP 与EGCG 对醉酒小鼠肝组织ADH 及ALDH 活力变化的影响Table 3 Effects of PGP and EGCG on ADH and ALDH activities in liver tissue of drinking mice
3 结论
本研究分别从体外试验及动物实验证实了桃胶多糖可吸附乙醇分子,抑制乙醇吸收入血,显著延长急性醉酒小鼠的醉酒潜伏期,缩短小鼠醉酒后睡眠时间,具有良好的抗醉、解酒方面的应用前景。此外,系统分析了桃胶多糖与天然抗氧化剂EGCG 联用后对小鼠醉酒的影响,结果表明,桃胶多糖与EGCG 联用可显著增强桃胶多糖的抗醉、解酒方面的作用,其内在机制包括:显著减少乙醇所致胃组织氧化性损伤、增强胃组织清除氧自由基能力;增强胃黏膜屏障防御作用;提升肝内乙醇代谢酶系的活力,促进乙醇分解代谢。

