萱草叶枯病菌粗毒素液对分化芽生理生化代谢的影响
杨丽莉,杨 睿,常建忠,蒋 丹
(山西省农业科学院旱地农业研究中心,山西太原030031)
萱草(Hemerocallis hybrida)是百合科萱草属多年生宿根植物,国内本土大花萱草通常易感染锈病和炭疽病菌。国外引进的大花萱草新品种[1]特别易感染一种新型病菌——萱草叶枯病(Kabatiella microsticta)[2],主要为害叶片,形成病斑,并不断蔓延,尤其对红运萱草的危害达到70%以上。针对萱草叶枯病的致病菌国内外学者已找到了病菌敏感的杀菌剂[2-4]。但是,园林绿化大面积喷施杀菌剂势必会对环境造成污染,同时加大了园林的管理难度。因此,最有效的方法是对其进行抗叶枯病性状改良,提高其抗病性。
研究叶枯病菌毒素液对深入了解病原菌致病机制、利用毒素就寄主抗病性进行快速检测、筛选抗病材料是十分重要的[5]。本试验就萱草叶枯病菌毒素液对红运萱草愈伤组织分化芽生长的影响和防御酶(SOD、POD、CAT)活性变化进行了研究,旨在为探索叶枯病发生机制和利用病菌毒素液进行抗病突变体筛选提供依据。
1 材料和方法
1.1 材料
1.1.1 供试萱草苗 从国外引进分株2~3 年生易感染叶枯病的品种红运,在山西省农业科学院东阳试验示范基地种植。
1.1.2 供试菌株 萱草叶枯病菌(Kabatiella microsticta Bubak(syn.Aureobasidium microstictum(Bubak)W.B.Cook)),由吉林农业大学植物病理教研室分离鉴定并保存。
1.1.3 保护酶测定试剂盒 采用南京建成生物工程研究所生产的试剂盒。SOD 试剂盒(测总),羟胺法(货号为A001-1);POD 试剂盒(植物,货号为A084-3);CAT 可见光试剂盒(货号为A007-1)。
1.2 方法
1.2.1 叶枯病菌毒素培养 受体材料为大花萱草红运的愈伤组织分化芽。红运的组织培养为专利技术[6]。
1.2.2 叶枯病菌粗毒素液的制备和毒力检测 其参照文献[7]进行。
1.2.3 叶枯病菌粗毒素液培养试验 受体为大花萱草红运愈伤组织继代培养分化出的1~2 cm 的分化芽。继代培养基中分别添加浓度20%,40%,60%的病菌毒素液,分别标记为1,2,3 号,同时以不添加毒素液为对照(CK),高压灭菌后备用。选取大小基本一致的萱草分化芽,剪去上部叶片,每瓶8 株,每处理3 瓶,3 次重复。(25±1)℃,16 h 光/8 h暗,光照强度2 800 lx。观察生长状况。
1.3 测定项目及方法
1.3.1 生长量指标的测定 分别在分化芽的第0,8,16,24,32 天称其鲜质量,绘制生长量曲线。调查成活数,计算存活率。

1.3.2 保护酶活性的测定 采用南京建成生物工程研究所试剂盒法测定保护酶活性。在处理前和处理后第2,7,14,21 天分别进行保护酶活性的测定。保护酶提取液制备和测定均按试剂盒标准进行。以双蒸水为对照,3 次重复。分别计算总SOD、POD 和CAT 酶活力。
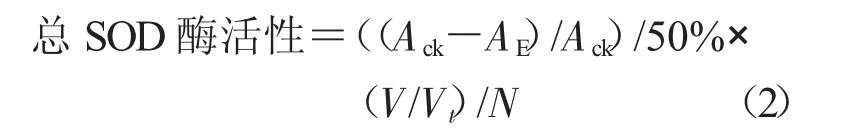
式中,总SOD 酶活性为每克组织在1 mL 反应液中SOD 抑制率达50%时所对应的SOD 量为一个SOD 活力单位(U)(U/g);Ack为对照OD 值;AE为样品OD 值;V 为反应液总体积(mL);Vt为取样量(mL);N 为匀浆液浓度(组织鲜质量(g)/匀浆介质体积(mL),按1%计)。
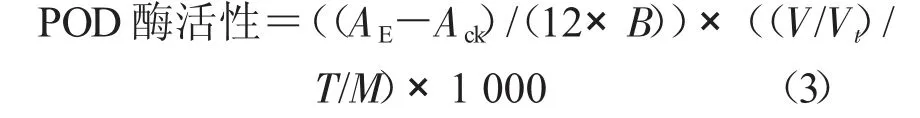
式中,POD 酶活性为37 ℃下,每毫克组织蛋白每分钟催化1 μg 底物的酶量定义为一个酶活力单位(U/mg);Ack为对照OD 值;AE为样品OD 值;B 为比色光径(1 cm);V 为反应液总体积(mL);Vt为取样量(mL);T 为 反应时间30 s;M 为匀浆蛋白浓度(mg/mL),以1.0 mg/mL 计算。
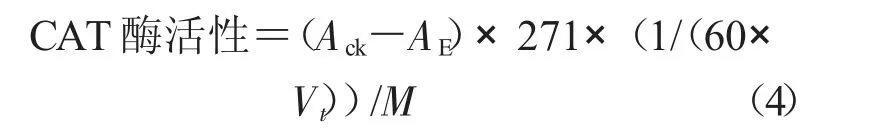
式中,CAT 酶活性为每毫克组织蛋白每秒钟分解1 μmol H2O2的量为一个活力单位(U/mg);271 为斜率的倒数;Ack为对照OD 值;AE为样品OD 值;Vt为取样量(mL);M 为匀浆蛋白浓度,以1.0 mg/mL计算。
1.4 数据处理与分析
数据处理采用Excel 2007 进行,单因素方差分析采用SPSS 软件进行,采用LSD 法进行平均值间多重比较。
2 结果与分析
2.1 叶枯病菌粗毒素液对分化芽生长的影响
用添加不同浓度叶枯病菌粗毒素液的固体培养基对愈伤组织分化芽进行培养,结果发现,病菌毒素液对分化芽均有不同程度的毒害作用,主要表现在叶片出现水渍型黄化、生长缓慢和致死效应,并随着培养时间的延长毒害作用加剧。前3 d 各处理的毒害作用表现均不明显;3 号样品在7 d 左右时叶尖部开始发黄,并向下蔓延;2 号和1 号则出现在10~15 d;随着培养时间的延长,3 号整株失绿,生长停滞,逐渐死亡;2 号和1 号的生长状态与3 号相似,但是毒害作用较轻,受伤害程度大小依次为3 号>2 号>1 号(图1)。

从表1 可以看出,随着毒素液浓度的增加抑制作用增强。毒素液浓度在20%(1 号)时,分化芽生长势比较旺盛;达到40%(2 号)时生长缓慢;达到60%(3 号)时,前16 d 时生长速度虽然不及1 号和2 号,但是还有缓慢生长,之后生长趋于停滞状态。从不同处理增长量的方差分析结果可以看出,前8 d,1 号与CK 间没有显著差异,2 号和3 号与CK和1 号间在0.05 水平上差异显著;到第32 天时,1、2、3 号和CK 之间在0.05 水平差异均显著。说明病菌毒素液对分化芽生长的影响是非常巨大的,浓度达到60%时,分化芽生长极其缓慢,甚至停止生长。
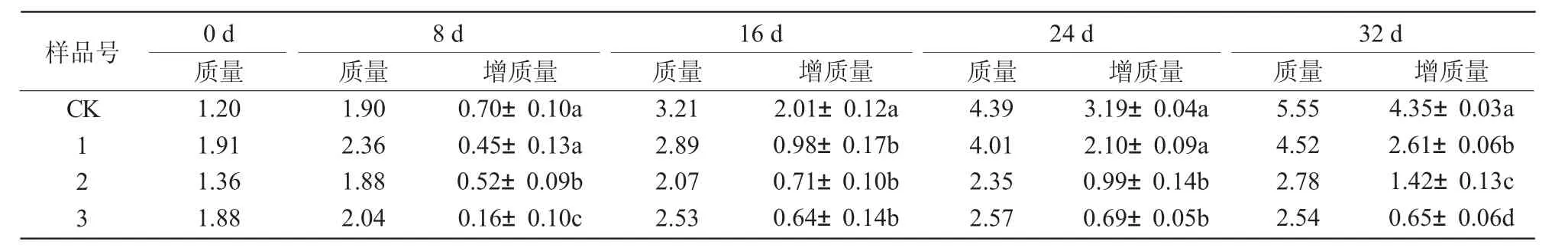
表1 叶枯病菌粗毒素液对分化芽生长的影响 g
2.2 叶枯病菌粗毒素液对分化芽的致死作用
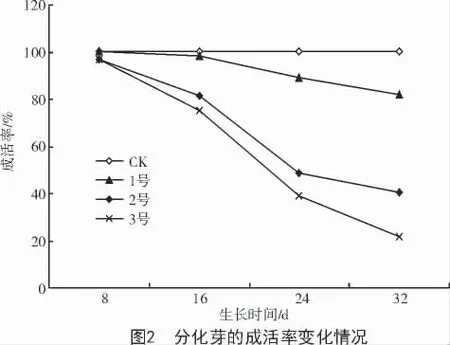
叶枯病菌粗毒素液对分化芽的生长产生很大的抑制和伤害作用,进一步影响到了成活率。从图2 可以看出,毒素液对成活率的影响在前16 d 尚不明显,16 d 后十分明显。同一浓度下,随着培养时间的延长,成活率有不同程度的下降。菌液浓度增加,分化芽成活率显著下降,其中,菌液浓度在40%(2 号)、生长24 d 时,成活率下降到了50%;32 d时,降到40%左右。菌液浓度在60%(3 号)时,从16 d 起,成活率下降幅度明显高于1,2 号,在32 d时成活率只有20%左右。说明20%浓度(1 号)的菌液对分化芽成活率的影响不明显,40%浓度(2 号)时的死亡率达到40%~50%,60%浓度(3 号)有强致死效应。结合分化芽的生长状况分析得出,在培养基中添加病菌毒素液浓度为40%是一个筛选的合理剂量,培养时间为24 d 较适宜。
2.3 叶枯病菌粗毒素液对防御酶活性的影响
2.3.1 对SOD 酶活性的影响 SOD 催化O2-·歧化反应生成O2和H2O2,其活性被认为是抗逆境的重要指标[8-9]。培养基中添加叶枯病菌粗毒素液对SOD酶活性均有不同程度的影响,导致分化芽SOD 酶活性呈现先升高后下降的趋势,升高的幅度与毒素液浓度呈正相关(图3)。SOD 酶活性在第2 天达到最高值;7 d 内,3 号维持在最高水平,1,2 号缓慢下降,14 d 时下降到CK 水平;之后持续下降,在21 d时,SOD 酶活性达到最低,1,2,3 号均低于CK,其中,3 号最低,其次依次为2 号和1 号。说明分化芽接种到含病菌毒素液的培养基上,在毒素逆境条件作用下,分化芽细胞迅速启动SOD 酶防御系统,酶活性迅速升高,清除O2-·自由基,并持续在较高水平。毒素液浓度越高,对细胞的毒害作用越强,酶活性升高的幅度越大。随着逆境时间的延长,细胞受毒害作用持续增强,SOD 酶系统不足以清除植株中积累的大量超氧阴离子自由基,细胞逐渐衰老死亡,SOD 酶活性持续下降。在3 个处理中,1 号和2 号比3 号受伤害小。

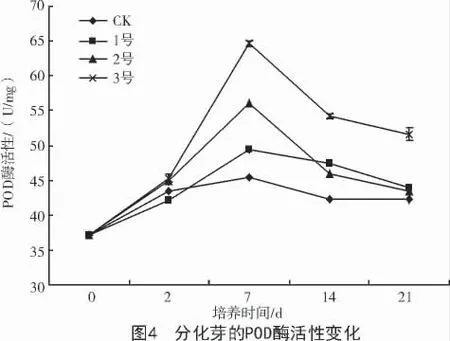
2.3.2 对POD 酶活性的影响 POD 是植物体内普遍存在的氧化还原酶,它不仅参与木质素、酚类物质及植保素的合成,还作为整个代谢途径的调节子,是细胞内重要的内源活性氧的清除剂,是公认的与植物抗性相关的酶[9-10]。培养基中添加叶枯病菌粗毒素液分化芽POD 酶活性先升高后下降(图4)。培养24 h,POD 酶活性略有升高,培养到第7 天病症出现时,酶活性才迅速升高,升高的幅度与添加的毒素液浓度呈正相关,与接种大豆花叶病毒后的反应相同[11]。随着毒素液培养时间的延长,酶活性下降,下降的幅度与毒素液浓度呈负相关。在21 d时,3 号酶活性最高,与1,2 号和CK 间显著差异。说明毒素浓度越高对植株的刺激作用越强,细胞以提高POD 酶活性来应对逆境环境,可能是细胞的应激反应和防御机制[12]。
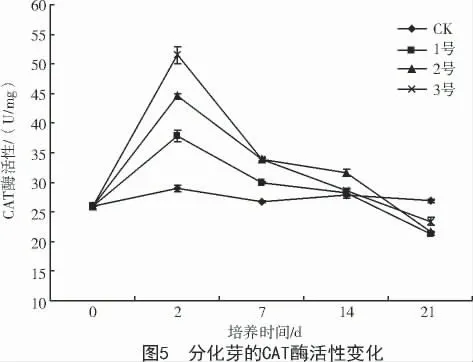
2.3.3 对CAT 酶活性的影响 CAT 存在于需氧的生物体内,在消除过氧化物酶体中的H2O2时起到重要作用[13]。培养基中添加叶枯病菌粗毒素液分化芽CAT 酶活性先升高后下降,升高的幅度与毒素液浓度呈正相关(图5)。CAT 酶活性在第2 天达到峰值,各处理之间、各处理与CK 之间均呈显著差异。之后酶活性下降,在21 d 时接近CK 水平。
3 结论与讨论
本研究结果表明,叶枯病菌毒素液对大花萱草分化苗生长具有一定的毒害作用,使得植株生长量、存活率和保护酶活性等方面存在着明显的剂量差异。病菌毒素液剂量低,毒害作用弱;剂量高,毒害作用强。这一结果对于室内进行抗病资源的筛选与鉴定具有十分重要的参考价值[14],20%~40%的剂量范围是适合的筛选剂量。结合诱变育种进行抗病突变体选择压筛选,获得抗病突变体材料,对大花萱草抗叶枯病育种具有十分重要的意义。
参与植物体内多种生理代谢过程的SOD、POD和CAT 以及PAL 和PPO 等酶系与植物抗性密切相关[15]。其中,SOD 酶是植物与病原物识别过程中产生初始抗性信息的一个关键酶,其主要功能是通过歧化反应清除超氧阴离子自由基,因此,SOD 常作为抗性机制起作用[16];POD 酶属于氧化酶系统,是细胞内重要的内源活性氧的清除剂。有研究发现,在病原菌染后,植物体内细胞保护酶活性发生了相应变化[11,17]。MONTALBINI 等[18]研究发现,接种烟草花叶病毒(Tobacco mosaic virus,TMV)后,烟草叶片细胞SOD 酶活性明显加强。朱友林等[19]在对玉米大斑病菌侵染玉米的研究中发现,抗病品种POD 基因等防卫基因较感病品种更快速被诱导表达。吴岳轩等[20]研究发现,杂交稻感染白叶枯病菌后,叶片中POD 活性升高。本试验中,萱草分化芽在经不同浓度的粗毒素液培养后,3 种酶的活性都有不同程度的变化,呈现不同程度的先升高后降低,活性升高的程度与毒素液的浓度呈正相关,并显示显著差异,与接种病菌后的反应是一致的。低浓度毒素液对分化芽的伤害作用较轻,浓度增加,伤害作用加剧。酶活性峰值出现的时间依防御酶的种类不同而不同。SOD 和CAT 酶活性峰值出现在第2 天,POD酶活性峰值出现在第7 天。因此,分化芽通过各级信号传导激活防御酶系统,启动与抗病性有关的基因得到表达,从而应对病菌毒素液的伤害。这一结果为利用病菌毒素液作为选择压筛选抗病突变体提供了理论依据。

