吕梁黑山羊成纤维细胞培养过程中霉菌污染的清除
吴苏君,王 曦,李 希,罗惠娣,毛杨毅,贺东昌,周胜花,李春艳,张 丽,郭慧慧,薛丽娜,党文庆
(山西省农业科学院畜牧兽医研究所,山西太原030032)
细胞培养作为一种体外增殖技术目前被广泛应用于教学、科研、临床实验、生物产品制备等领域,其虽然涉及因素繁多,但污染控制是其成功的关键。可能引发细胞发生污染的微生物有支原体、细菌、黑胶虫、霉菌等,其中,霉菌污染在雨季或潮湿环境中尤为常见[1]。
细胞被霉菌污染后,其生长速度、细胞形态、生长特性均会受到不同程度的影响[2]。在霉菌污染发生早期,培养液变化肉眼几乎不可见,倒置显微镜下观察可见细胞间有树枝状的菌丝悬浮在培养液中[3];在霉菌污染发生后期,肉眼可见培养液中有圆饼状白色或浅黄色漂浮物,倒置显微镜下可见细胞间有纵横交错的菌丝,细胞生长分散、变圆漂起,脱落死亡[4],这对细胞相关研究将产生严重影响。因此,发现细胞培养液被霉菌污染后应尽快清除。常见的霉菌清除方法有动物体内除菌法[5]、低速离心除菌法[6]、药物除菌法[7]等,这些方法各有优劣,本研究选用药物除菌法。
吕梁黑山羊是山西省优良的肉皮绒兼用地方品种,于1983 年被列入《山西省家畜家禽品种志》,是珍贵的畜种资源[8-9]。
本研究采集吕梁黑山羊耳部组织,体外培养耳源成纤维细胞[10-13],添加不同浓度两性霉素B 对细胞培养液中霉菌进行清除,比较不同浓度药物的清除效果,进而构建稳定的细胞培养体系,以期为后续研究吕梁黑山羊的种质资源利用奠定基础。
1 材料和方法
1.1 试验材料
吕梁黑山羊(0~3 月龄)耳缘组织采自山西省农业科学院畜牧兽医研究所克隆基地试验羊场。
胎牛血清FBS 购自Hyclone 公司;DMEM 购自Gibco 公司;DPBS、胰蛋白酶、二甲基亚砜(DMSO)、Hoechst 33342,均购自Sigma 公司;两性霉素B 溶液购自Biotopped 公司;其他试剂均为国产分析纯。24 孔板及细胞培养皿购自Thermo 公司。
1.2 试验方法
1.2.1 吕梁黑山羊耳缘成纤维细胞的原代培养、传代培养、冻存和复苏 选择0~3 月龄的吕梁黑山羊,获取耳尖皮肤组织(1 cm2),4 h 内带回实验室。将组织块放入75%酒精中浸泡30 s 消毒,漂洗后剔除残留毛发和软骨组织剪成约1 mm2的小块,均匀接种于60 mm 培养皿中,倒置培养4~6 h,待组织块贴壁后,加入细胞培养液(DMEM+1%双抗+15%FBS)3~4 mL,每隔2 d 更换一次培养液,5~7 d 后观察组织块周围有无细胞迁出,待原代培养的单层细胞汇合度达到80%时,进行传代培养或冷冻保存。细胞汇合度达到80%时,弃去培养液,DPBS 洗涤3 遍,加入0.2%胰蛋白酶消化细胞,终止消化后收集细胞悬液,1 000 r/min 离心5 min,弃去上清液。如需传代,加入细胞培养液重悬后均匀接种;如需冻存,加入预冷的冻存液(DMEM+10%(V/V)DMSO+15%(V/V)FBS,4 ℃保存)混匀,移入冻存管,在细胞程序降温盒中-80 ℃冰箱过夜,后移至液氮罐中长期保存。细胞复苏时,从液氮罐中取出冻存管,浸入37 ℃温水中快速解冻,待完全融化后移入15 mL 离心管中加入细胞培养液至10 mL,1 000 r/min 离心5 min;弃上清液,加入细胞培养液重悬细胞,接种至60 mm 细胞培养皿中,置于37 ℃的5%CO2饱和湿度培养箱中培养。次日更换培养液,待细胞汇合度达到80%时即可传代。
1.2.2 霉菌污染情况观察 肉眼及高倍显微镜下观察:疑为霉菌污染的细胞及对照组细胞在显微镜下直接观察,根据培养液及细胞形态学变化,对比判断有无污染。
1.2.3 霉菌污染后处理 疑为霉菌污染的细胞培养液中分别添加浓度为2.5,25,250 μg/mL 的两性霉素B。细胞每天洗涤3 遍后更换培养液,正常培养传代,在换液数小时后定时观察细胞及培养液情况,连续处理14 d。
1.2.4 细胞生长曲线的测定 两性霉素B 连续处理14 d 后,取霉菌污染消除且细胞恢复正常生长的试验组和对照组,待细胞汇合度达到80%时,消化细胞,1 000 r/min 离心5 min 后弃上清液,加细胞培养液重悬,以1×104个/孔接种至24 孔板中培养。每24 h 计数细胞,每次计数重复3 次,取平均值,连续计数7 d 后,根据时间和细胞密度绘制细胞生长曲线。
2 结果与分析
2.1 细胞原代、传代培养及冻存、复苏培养
通过组织块贴壁培养法成功分离出吕梁黑山羊耳缘组织成纤维细胞,培养5~6 d 即可观察到有细胞从组织块边缘向外迁出,培养10 d 后能清晰分辨出组织块周围有梭形且边缘立体的成纤维细胞。形态学观察可见细胞主要呈梭形、多角形或不规则形,细胞排列分散(图1-A);细胞传代后生长状态良好,形态正常(图1-B)。

2.2 显微镜观察霉菌污染情况
疑为霉菌污染的细胞肉眼下可观察到浅黄色的漂浮物,呈薄蘑菇伞状,有中心,可随培养液晃动漂动,培养液有轻微浑浊;高倍显微镜下可观察到从中心发散开去的菌丝,细胞分布稀疏,生长速度显著降低,一些细胞变圆漂起,从皿底脱落。
2.3 药物处理后霉菌及细胞状态观察

表1 3 组浓度两性霉素B 处理霉菌污染的效果及细胞状态
当吕梁黑山羊细胞培养过程中发现霉菌污染时,对比不同浓度两性霉素B 处理霉菌污染的效果及细胞状态(表1)。由表1 可知,细胞培养液中两性霉素B 的添加质量浓度为2.5 μg/mL 时,无法抑制培养液中霉菌继续生长;两性霉素B 的添加质量浓度为250 μg/mL 时,细胞会大量死亡;两性霉素B 的添加质量浓度为25 μg/mL 时,既可抑制霉菌生长还可保持细胞活性,是发生霉菌污染时理想的使用浓度。
2.4 细胞生长曲线的绘制
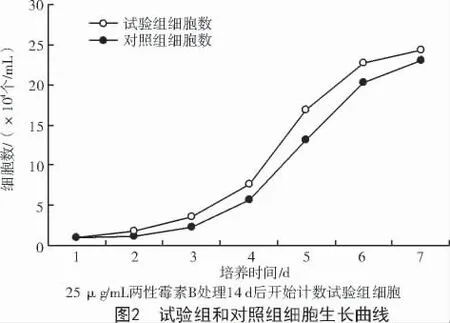
选择细胞培养液中添加两性霉素B 质量浓度为25 μg/mL 的试验组和对照组绘制细胞生长曲线。根据细胞计数结果,以单位细胞密度为纵坐标、培养时间为横坐标绘制生长曲线,如图2 所示,试验组和对照组细胞生长曲线呈S 形分布,1~3 d 细胞处于适应期,生长缓慢;3~6 d 细胞处于指数生长期,生长旺盛;6~7 d 细胞处于平台期。试验组细胞增殖能力刚开始稍弱于对照组,说明细胞需要一段时间逐渐恢复,之后恢复正常生长,霉菌污染已被去除。
3 结论与讨论
细胞培养过程出现霉菌污染是常见且较难处理的问题。细胞被霉菌污染后,生长速度变慢,即使在不影响细胞存活率的条件下,霉菌产生的毒素也会破坏细胞DNA,对细胞造成损伤。有研究发现,在短时间低剂量作用条件下,霉菌毒素并不会诱导DNA 出现损伤,而作用时间延长则可通过增加细胞内活性氧含量造成氧化应激,进而对DNA 造成损失,才显示出其基因毒性,表明细胞对霉菌毒素有短期抵抗力。但霉菌毒素对动物机体的损伤比较明显,它会增加动物相关脏器质量和体质量、引发胃肠功能紊乱,导致腹泻、肝肿大和食欲减退[14-15]。细胞在霉菌污染后期,会由于毒性作用及营养耗尽而脱落死亡,对细胞相关研究产生严重影响。
通常情况下,细胞被霉菌污染后应直接灭菌丢弃,但若细胞来源有限、难以替代或者污染不严重,就需要采取措施清除霉菌污染。对比清除霉菌的不同方法清除霉菌污染,各有优缺点。杨卫兵等[6]用低速多次离心去除法清除霉菌污染,对细胞损伤低,所需试验条件简单,但对人员要求较高,试验中容易出现清除霉菌污染不彻底的现象。黄文敬等[16]在细胞培养基中加入适量的两性霉素B,可以有效降低脐带分离培养的污染率,且不影响脐带间充质干细胞的增殖和干性表达,但该试验只针对霉菌污染的预防,未涉及霉菌污染的清除。赵世祯等[17]采用多次洗涤细胞和连续传代的方法清除霉菌,简单有效,但耗时长。吴介恒等[2]在培养液中添加正常剂量5 倍浓度的双抗来清除早期的霉菌污染。田启超等[7]研究发现,在霉菌污染早期,细胞培养液中添加青霉素(100 IU/mL)、链霉素(100 IU/mL)、两性霉素(10 μg/mL),隔天换液,重复2~3 次,同时细胞培养箱用饱和硫酸铜清洁后用过氧乙酸熏蒸,可有效控制霉菌污染,但操作繁杂,仅适用于霉菌污染发生早期。本研究为不影响后续细胞研究,彻底清除霉菌污染,采用细胞培养液中添加抗生素的方法。
多烯大环内酯抗生素通过与细胞膜内的固醇相互作用,改变细胞渗透性造成细胞内容物外溢来发挥作用,对霉菌、丝状真菌等有很好的抑制作用,且毒副作用较低[18]。其中,制霉菌素与两性霉素B结构类似,对真菌的敏感性较好[19]。制霉菌素多被用于抑制念珠菌,两性霉素B 可广泛用于抑制隐球菌、球孢子菌、念珠菌、毛霉、曲菌等,且毒性反应较小[20]。由于霉菌种类鉴别耗时耗力,会延误挽救细胞的时机,故本研究选用抗真菌范围更广的两性霉素B 来清除细胞中的霉菌。黄文敬等[16]研究发现,将两性霉素B 作为一种抗真菌、抗酵母菌以及抗霉菌制剂加入细胞培养液中使用时,通常有效的质量浓度是25 mg/L,在30 mg/L 时有细胞毒性,会降低充质干细胞的细胞增殖能力,但不影响细胞整体的增殖能力。杨卫兵等[6]研究表明,两性霉素B 使用浓度过高可致细胞死亡,浓度过低时则不能抑制霉菌生长。故本研究在细胞培养液中添加两性霉素B时,设置3 组梯度浓度,结果显示,在细胞培养液中加入2.5 μg/mL 的两性霉素B,不能抑制霉菌生长,导致培养液随时间延长而浑浊,细胞大量死亡;而加入250 μg/mL 的两性霉素B 在抑制霉菌的同时还会导致细胞大量死亡,显微镜下可见大量细胞碎片,推测为两性霉素B 浓度太高,对细胞生长不利;而在细胞培养液中加入25 μg/mL 的两性霉素B,既可抑制霉菌生长还可保持细胞活性,是发生霉菌污染时理想的使用浓度。在细胞用两性霉素B 处理14 d 后,绘制细胞生长曲线,发现细胞的生长和增殖速度均恢复正常。说明吕梁黑山羊成纤维细胞中的霉菌污染已被彻底清除,无复感。本研究在细胞被霉菌污染时及时使用两性霉素B 对其进行清除,建立了一种细胞污染处理机制,在细胞培养实际工作中具有很高的操作性,实用性强,具有借鉴价值。
污染重在预防,在细胞培养过程中,要时刻警惕霉菌及其他污染,制定严格规范的细胞培养间日常管理消毒制度,定期对细胞、试剂、耗材、仪器进行污染检测,规范实验操作和记录流程,把污染的可能性降到最低,提高试验结果的稳定性和可靠性。

