具有降解对硝基酚功能的硝化菌
张辰媛 俞汐音 陈诗源 张永明
摘 要: 硝化细菌是城市污水处理厂水处理系统中的重要功能菌.该硝化菌能否抵御有毒污染物的冲击,是衡量污水处理系统能否稳定运行的指标之一.用对硝基酚(PNP)对普通的硝化菌进行驯化,得到一种具有降解PNP功能的硝化菌.结果表明:经过驯化后的硝化细菌同时具有降解硝基酚和硝化功能.在含有质量浓度为100 mg·L-1 PNP的溶液中,与普通硝化菌相比,经过驯化后的硝化菌对NH4+-N去除速率高出33%.此外,驯化后的硝化菌对PNP的去除速率是普通硝化菌的33倍.
关键词: 对硝基酚(PNP); 硝化菌; 生物降解; 硝化反应
中图分类号: TQ 174.75 文献标志码: A 文章编号: 10005137(2019)04040606
Abstract: Nitrifier is an important function bacteria in municipal wastewater treatment plant.It is one of the indexes to evaluate whether or not the wastewater treatment system including the nitrifier could operate stably with shock of toxic pollutants.Common nitrifying bacteria were acclimated with pnitrophenol (PNP) to obtain special nitrifying bacteria with function for biodegradation of PNP.Experimental results showed that the nitrifying bacteria had function for simultaneous ammonium N removal and PNP biodegradation.In the solution containing 100 mg·L-1 PNP,the acclimated nitrifying bacteria had a 33% higher removal rate of NH4+N than the common nitrifying bacteria.In addition,PNP removal rate with the acclimated bacteria was as 33 times as that with common bacteria.
Key words: pnitrophenol (PNP); nitrifying bacteria; biodegradation; nitrification
0 前 言
随着环境保护意识的日益加强,各种污水都需经过适当处理后才能够排放到自然环境中.其中生活污水的处理占有重要的份额.据统计,全国每年产生的生活污水近500亿吨[1].对生活污水的处理,几乎都是采用生物方法进行的.在生活污水处理中,硝化反应是重要的一个环节[2-4].因为硝化细菌的培养或驯化周期较长[5-7],一旦硝化菌的生物活性受到影响,会导致污水处理厂的出水达不到排放标准[8-9].严重时,会导致整个污水处理厂的生物系统崩溃.此外,全国许多城镇污水处理厂在处理生活污水的同时,往往会接纳部分工业废水进行混合处理.通常各个工厂在接入生活污水管网之前都需要进行一定程度的预处理,避免城镇生活污水处理厂的活性污泥体系受到一定程度的冲击而导致处理效率下降甚至造成污染事故.但是在现实中,因为一些工业废水的预处理工艺不够合理或突发事故等种种原因,一些带有生物毒性的工业废水会突然进入到生活污水体系.如何保证污水处理厂的微生物体系在遇到突如其来的含有生物毒性的工业废水时,仍能正常進行生物反应,是各城镇污水处理厂需要考虑的问题.其中很重要的一个方面是保证污水处理厂的硝化细菌在此情况下仍具有生物活性.
在各种工业废水中,对硝基酚(PNP)是一种典型的、具有生物毒性的化学物质[10-12].PNP在工业领域被广泛地用作农药、医药、染料等精细化学品的中间体[13-15],用于制造非那西丁、扑热息痛、农药1605、显影剂米妥尔、硫化草绿GN、硫化还原黑CL、硫化还原黑CLB、硫化还原蓝RNX、硫化红棕B3R,也用作皮革防霉剂以及酸值指示剂[16-18].在使用过程中,PNP往往会存在于这些行业的废水中,并进入城镇污水处理厂,从而有可能对污水处理厂的生物系统造成一定的毒害或冲击[19-20].在本研究中,以PNP为对象,培养驯化出一种能耐受PNP毒性的硝化细菌,并与常规的硝化细菌进行比较,探讨硝化细菌在遇到PNP时的特性,为提高城镇污水处理厂的生物系统抵御有毒污染物的能力提供理论和实践依据.
1 材料与方法
1.1 化学试剂以及PNP和氯化铵溶液的制备
购置于上海探索平台的PNP、氯化铵(NH4Cl)、磷酸二氢钾(K2HPO3)、葡萄糖、碳酸氢钠(NaHCO3)和一些微量元素均为分析纯.培养基制备时,将10 g PNP和7.7 g NH4Cl分别溶解于1000 mL去离子水(18 MW,Millipore MilliQ净水器,美国)中,得到10 g·L-1 PNP和含N量为2000 mg·L-1的NH4+N储备溶液.通过将40 g NaHCO3溶解于1 L MilliQ去离子水中制备缓冲液,将21.75 g K2HPO3和4.26 g KH2PO3溶于1 L相同的水中,得到含碘营养液.
实验时,将储备溶液用自来水稀释,以获得所需要的初始PNP和NH4+N质量浓度.每1 L实验配水加入3 mL缓冲溶液、3 mL磷溶液和100 mg葡萄糖.
1.2 污泥驯化
污泥取自上海长桥水质净化厂.对所取污泥分为两个阶段进行驯化.第一阶段,各取300 mL污泥置于2个1 L量筒中,加入20 mL的NH4+N储备溶液,再定容至1000 mL,得到40 mg·L-1初始NH4+N溶液,同时加入250 mg葡萄糖作为碳源,加入10 mL的NaHCO3缓冲溶液和3 mL的磷营养溶液.每日曝气23.5 h,再沉降0.5 h,倒出上清液.每天以同样方法更换相同体积的新鲜培养基,在30 ℃条件下驯化4周,得到含有常规硝化菌的活性污泥.
在第二阶段驯化时,将部分经第一阶段驯化后的污泥置于1 L体积的量筒中,并加入PNP,使其质量浓度逐渐增加至100 mg·L-1,经过2~3周的驯化得到具有降解PNP功能的硝化污泥.而另一部分含有常规硝化菌的活性污泥作为对比,仍维持第一阶段的驯化方法不变.
1.3 硝化与PNP生物降解实验
实验分为两组,使用2个250 mL的锥形瓶置于120 r·min-1,30 ℃的摇床中.其中,一个摇瓶加入普通硝化污泥,另一个摇瓶加入PNP驯化的硝化污泥,即2个摇瓶分别含有普通硝化菌和经PNP驯化的硝化菌(以下简称驯化硝化菌).第一组实验,在2个摇瓶中加入等量NH4+N储备溶液,得到50 mg·L-1的初始NH4+N溶液,同时加入等量缓冲液、磷营养溶液,定容至150 mL,以比较普通硝化菌和驯化硝化菌单独进行硝化反应的反应速率.第二组实验在第一组的基础上,向2个摇瓶中增加PNP储备液,使得加入的PNP质量浓度为100 mg·L-1,其余物料完全一致,对比突然加入PNP时上述2种硝化菌硝化反应的受影响程度以及PNP的降解速率.每一组实验均加入质量浓度为100 mg·L-1的葡萄糖.对于所有实验,以1 h为间隔取样以测量PNP,NH4+N和NO3-N的质量浓度.
1.4 分析方法
使用Ultimate 3000高效液相色谱仪测定PNP质量浓度,检测限为0.05 mg·L-1.流动相为甲醇/水溶液(V(甲醇) ∶ V(水溶液)=70 ∶ 30),流速为1 mL·min-1,检测波长254 nm,色谱柱为ZORBAX SBC18(5 μm,4.6 mm×250 mm,Agilent),柱温为30 ℃.使用Autochem 1200全自动间断分析仪测定NH4+N和NO3-N质量浓度.每个液体样品在测量前通过0.22 μm孔径的膜过滤器(型号:MCE13mm,中国)过滤.
2 结果与讨论
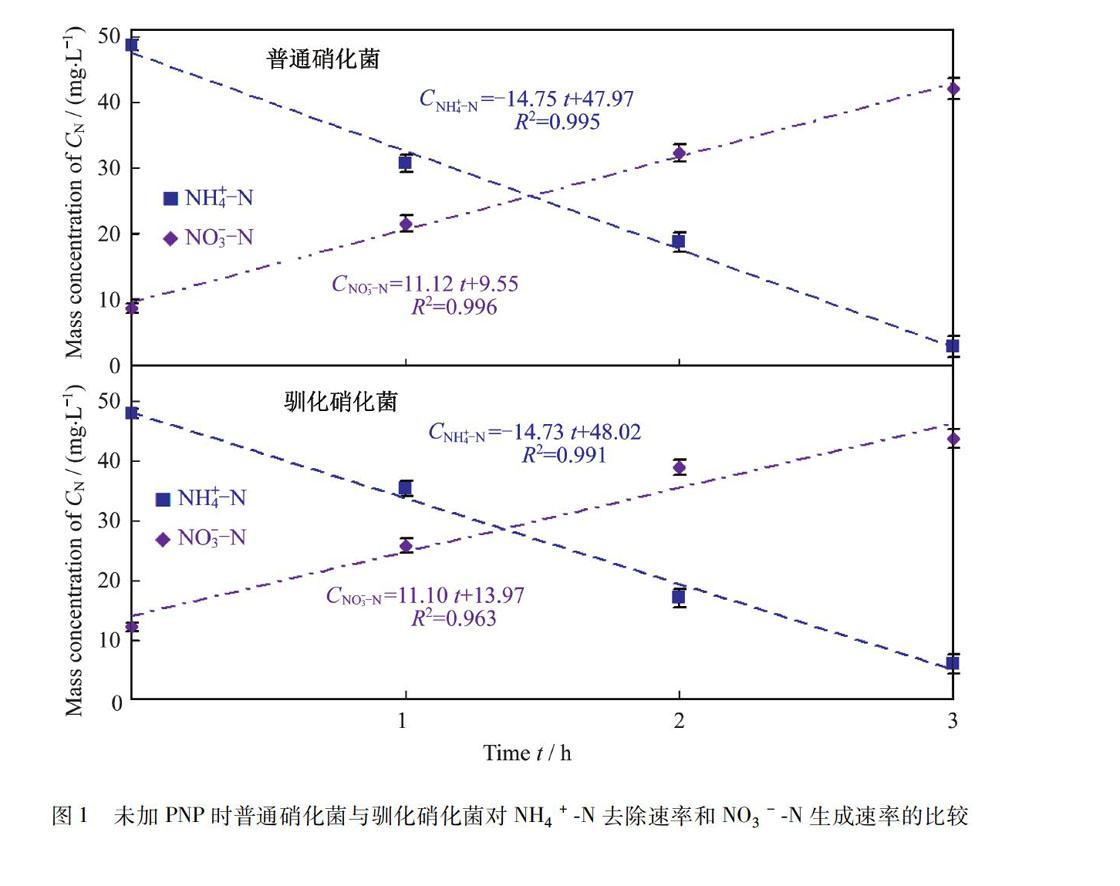
2.1 未加PNP时普通硝化菌与驯化硝化菌的比较
图1所示是普通硝化菌和驯化硝化菌在未加PNP时硝化速率的比较(R为相关系数).从图1中可以看出,未加PNP时,2种硝化菌对NH4+N的去除速率和NO3-N生成速率几乎一样.由此可以看出,经过PNP的驯化之后,微生物的硝化功能几乎没有变化.比较NH4+N的去除速率和NO3-N的生成速率可以发现,NH4+N的去除速率比NO3-N的生成速率略微快一些.这是因为在每一组实验中,还加入了质量浓度为100 mg·L-1的葡萄糖,导致部分NH4+N通过异养同化的方式去除,总的NH4+N去除速率(k)包括硝化速率(kN)和异养合成速率(kH),即:k=kN+kH.在没有加入PNP时,kN占k的75%左右.
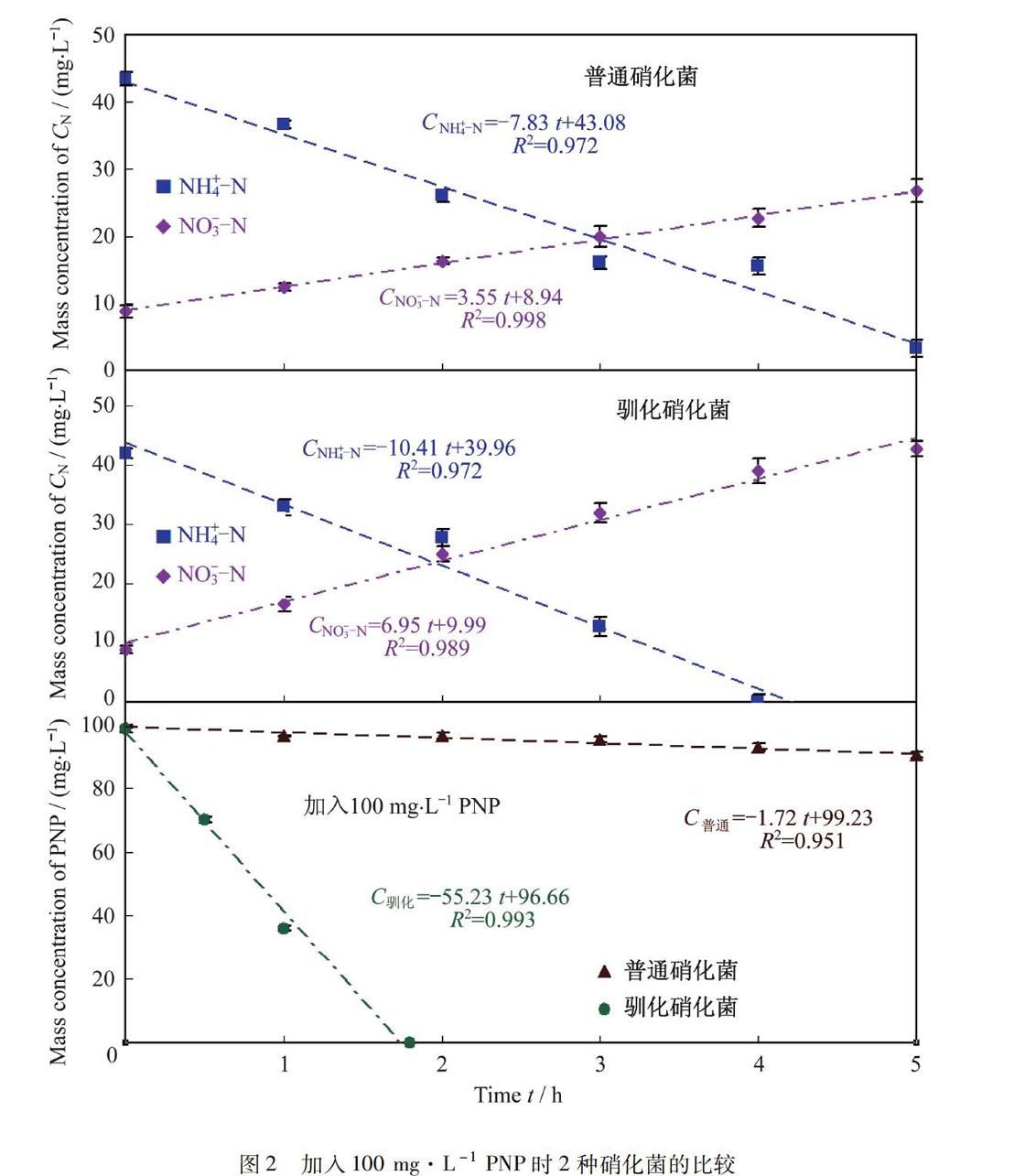
2.2 添加PNP时普通硝化菌与驯化的硝化菌的比较
图2是将100 mg·L-1的PNP分别加入到50 mg·L-1(干重)的普通和驯化硝化细菌中时,硝化速率与PNP降解速率的比较.由图2可以看出,当加入100 mg·L-1 PNP时,驯化硝化菌比普通硝化菌对NH4+N去除速率快33%.相比未加入PNP时,普通硝化菌对NH4+N去除速率则下降了88%,而驯化硝化细菌只下降41%.从图2中还可以看出,驯化硝化菌在降解PNP时,驯化硝化菌对PNP的降解速率是普通硝化菌的32倍.同时,驯化硝化菌的NO3-N生成速率几乎是普通硝化菌的2倍.在好氧条件下,PNP的生物降解途径主要是通过单加氧反应得以降解[21].结果表明,经过PNP驯化的硝化菌或微生物菌群既有硝化功能,又存在单加氧酶,因此,在突然接触到PNP时,仍能保持较好的硝化速率,同时还具有对PNP的降解性能.
3 结 论
经过PNP驯化过的硝化菌在突然接触到PNP时,相比普通硝化菌仍能保持较高的硝化速率,同时还具有较好降解PNP的性能.该研究结果对于提高耐受有毒污染物冲击的污水处理生物系统具有一定理论和实际意义.
参考文献:
[1] 程哲婉.我国农村水污染问题制度分析及对策 [J].江南论坛,2017(9):30-32.
CHENG Z W.Institutional analysis and countermeasures of rural water pollution problems in China [J].Jiangnan Forum,2017(9):30-32.
[2] 齐勇,陶濤,吴韵瑕,等.低温下生物膜流化床工艺硝化反应动力学研究 [J].环境工程学报,2013,7(5):1831-1836.
QI Y,TAO T,WU Y X,et al.Research on nitrification kinetics of moving bed biofilm technology under low temperatures [J].Chinese Journal of Environmental Engineering,2013,7(5):1831-1836.
[3] 叶柳,王淑莹,赵凯峰,等.含盐生活污水处理中的硝化菌种群优化(英文) [J].北京大学学报(自然科学版),2010,46(3):422-428.
YE L,WANG S Y,ZHAO K F,et al.Nitrifying population optimization in municipal saline wastewater treatment [J].Acta Scientiarum Naturalium Universitatis Pekinensis,2010,46(3):422-428.
[4] 苗红霞.城镇生活污水处理厂深度处理工艺探讨 [J].山东工业技术,2017(24):47.
MIAO H X.Discussion on advanced treatment technology of urban domestic sewage treatment plant [J].Shandong Industrial Technology,2017(24):47.
[5] 盛晓琳,崔灿灿,王家德,等.硝化污泥富集及其强化高氨氮冲击的中试研究 [J].环境科学,2018,39(4):1697-1703.
SHENG X L,CUI C C,WANG J D,et al.Pilotscale experiment on enrichment of nitrifying activated sludge and its application in enhancing a wastewater biological treatment system against ammonia shocking loads [J].Environmental Science,2018,39(4):1697-1703.
[6] 楊宏,胡银龙.硝化细菌的培养及包埋固定化中试 [J].环境科学,2018,39(6):2763-2769.
YANG H,HU Y L.Nitrifying bacteria culture in entrapment immobilization [J].Environmental Science,2018,39(6):2763-2769.
[7] ANNA G,SEBASTIAN Z ·,JOANNA S.Filamentous bacteria in the nitrifying activated sludge [J].Water Science and Technology,2018,77(11):2709-2713.
[8] 陆立海,陈国宁,苏柳,等.硝化细菌在污水净化中的研究与应用 [J].绿色科技,2019(2):68-69.
LU L H,CHEN G N,SU L,et al.Research and application of nitrifying bacteria in sewage purification [J].Journal of Green Science and Technology,2019(2):68-69.
[9] OUYANG F,ZHAI H Y,JI M,et al.Physiological and transcriptional responses of nitrifying bacteria exposed to copper in activated sludge [J].Journal of Hazardous Materials,2016,301:172-178.
[10] LIU X,ZHAO L H,LAI H,et al.Highly effective degradation of pnitrophenol over MoS2 under visible light illumination [J].Catalysis Letters,2017,147(8):2153-2159.
[11] QIAN J J,YUAN A L,YAO C K,et al.Highly efficient photoreduction of pnitrophenol by protonated graphitic carbon nitride nanosheets [J].ChemCatChem,2018,10(20):4747-4754.
[12] MIRANZADEH M,KASSAEE M Z.Solvent effects on arc discharge fabrication of durable silver nanopowder and its application as a recyclable catalyst for elimination of toxic pnitrophenol [J].Chemical Engineering Journal,2014,257:105-111.
[13] ZHANG X,YANG Y S,LU Y,et al.Bioaugmented soil aquifer treatment for pnitrophenol removal in wastewater unique for cold regions [J].Water Research,2018,144:616-627.
[14] KITAGAWA W,KIMURA N,KAMAGATA Y.A novel pnitrophenol degradation gene cluster from a grampositive bacterium,Rhodococcus opacus SAO101 [J].Journal of Bacteriology,2004,186(15):4894-4902.
[15] ZHANG H,JI Q Q,LAI L D,et al.Degradation of pnitrophenol(PNP) in aqueous solution by mFe/CuairPS system [J].Chinese Chemical Letters,2019,30(5):1129-1132.
[16] ALAN W J.Early drug discovery and the rise of pharmaceutical chemistry [J].Drug Testing and Analysis,2011,3(6):337-344.
[17] 夏志新,张音波,余煜棉,等.卡尔曼滤波法用于扑热息痛5组分混合体系分析 [J].广州大学学报(自然科学版),2004(5):416-419.
XIA Z X,ZHANG Y B,YU Y M,et al.Simultaneous spectrophotometry determination of five components by Kalman Filtering [J].Journal of Guangzhou University (Natural Science Edition),2004(5):416-419.
[18] 于凤刚,李彦锋,周林成,等.Fenton强化铁炭微电解工艺处理硫化红棕中间体废水 [J].环境科学与技术,2009,32(10):149-152.
YU F G,LI Y F,ZHOU L C,et al.Treatment of sulphur red brown intermediate by Fenton oxidation and ironcarbon microelectrolysis [J].Environmental Science and Technology,2009,32(10):149-152.
[19] PARK J,BAE S.Formation of Fe nanoparticles on waterwashed coal fly ash for enhanced reduction of pnitrophenol [J].Chemosphere,2018,202:733-741.
[20] KIM M,BAE S.Immobilization and characterization of Fe(0) catalyst on NaOHtreated coal fly ash for catalytic reduction of pnitrophenol [J].Chemosphere,2018,212:1020-1029.
[21] YANG L H,ZHANG Y M,BAI Q,et al.Intimately coupling of photolysis accelerates nitrobenzene biodegradation,but sequential coupling slows biodegradation [J].Journal of Hazardous Materials,2015,287:252-258.
(責任编辑:郁 慧)

