肿瘤相关成纤维细胞的生物学特征及Transwell共培养对胃癌细胞生长和转移的影响
邵久针,王颖钰,印 鑫,许尤琪,沈明勤
(1. 南京中医药大学附属中西医结合医院中药药理毒理实验室,江苏 南京 210028;2. 江苏省中医药研究院中药药理毒理实验室,江苏 南京 210028;3. 江苏省第二中医院肿瘤科,江苏 南京 210008)
胃癌是常见的恶性肿瘤,位于全球发病率第5位、死亡率第3位,而我国属胃癌高发国家,发病与死亡例数约占世界的50%,是癌症防治的重点[1]。癌症的演化过程中,肿瘤细胞会积极募集成纤维细胞等基质细胞,营造低氧高酸性的肿瘤微环境,对肿瘤的发生、增殖、转移和凋亡具有重要的调节作用[2]。在胃肠道肿瘤中,基质细胞占肿瘤质量的50%以上,与胃正常成纤维细胞(normal fibroblasts,NFs)相比,胃癌相关成纤维细胞(cancer associated fibroblasts,CAFs)作为存在于肿瘤间质中的成纤维细胞亚群,是肿瘤微环境中重要的基质细胞[3],可通过分泌基质细胞衍生因子-1(stromal cell derived factor-1,SDF-1)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、转化生长因子β(transforming growth factor β,TGFβ)、半乳糖凝集素-1(Galectin-1)等细胞因子,重塑细胞外基质[4],促进肿瘤细胞的增殖、转移,并增强肿瘤的耐药性。
目前,研究偏向以传统的单细胞培养或接触式共培养模式,探究CAFs促癌增殖和转移作用,而基于Transwell共培养体系探究CAFs与NFs对不同比例胃癌细胞影响的报道较少。本研究在分离鉴定原代人CAFs、NFs细胞及形态学特征的基础上,通过构建CAFs/NFs-胃癌细胞Transwell共培养模型,探究成纤维细胞对不同比例胃癌细胞增殖、迁移和侵袭的影响及初步机制,既达到成纤维细胞与胃癌细胞非接触式生长,又保证了细胞间正常信号传导及相互影响,更接近于人体肿瘤微环境,为研究基于肿瘤微环境CAFs、NFs对胃癌细胞的影响提供研究思路、方法与参考。
1 材料
1.1 细胞与试剂人胃癌细胞MGC-803(货号:HXC-0136),购自南京宏新。胎牛血清(Gibco);DMEM不完全高糖培养液(江苏凯基); CXCR4拮抗剂AMD3100(APExBIO);DAPI、BSA(Sigma);全蛋白抽提试剂盒、BCA蛋白浓度测定试剂盒(碧云天);TRIzol(Invitrogen); cDNA第一链合成试剂盒、SYBR Green Master Mix (诺唯赞);Matrigel基底胶(BD);活性氧(reactive oxygen species,ROS)测定试剂盒、乳酸测定试剂盒(南京建成); α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)(BM0002)、β-actin(BM0627)抗体,均购自博士德; 波形蛋白(Vimentin)抗体(ab92547)、羊抗兔二抗(ab6721),均购自Abcam;羊抗鼠二抗(A21010-1)、Dylight488羊抗兔IgG(A23220),购自Abbkine;Transwell 24孔板(Corning,costar3422聚碳脂膜, 膜直径6.5 mm,孔径8.0 μm);Transwell 6孔板(Corning,costar3412聚碳脂膜, 膜直径24 mm,孔径0.4 μm)。
1.2 仪器Heracell 150i二氧化碳培养箱、NanoDrop one紫外分光光度计、TCA5020普通PCR仪、ABI 7500荧光定量PCR循环仪、Varioskan flash全波长多功能酶标仪(Thermo Fisher);PowerPac Basic电泳仪(Bio-Rad);Primo Vert倒置显微镜、Axioskop 2 plus荧光显微镜(ZEISS); Spectrumlab 752s紫外可见分光光度计(上海棱光)。
2 方法
2.1 CAFs、NFs的分离纯化及传代培养收集于江苏省第二中医院肿瘤科接受胃癌手术切除治疗患者的胃癌组织和配对癌旁组织标本,于冰上用含双抗的PBS清洗,弃上皮和脂肪组织,剪至1 mm3组织块,加入少量含20%胎牛血清及双抗的DMEM培养基,于37 ℃、5% CO2培养箱静置孵育,4~5 d换液后,每隔48 h换液。待细胞长满后,以10%胎牛血清培养基进行常规传代培养,取第3~9代成纤维细胞进行实验。本研究获得江苏省第二中医院伦理委员会批准,编号为201609001。
2.2 CAFs、NFs的鉴定
2.2.1形态学鉴定 倒置相差显微镜下观察CAFs、NFs从组织块分离纯化情况,常规传代培养,记录其生长状况和形态学特征。
2.2.2免疫荧光法检测α-SMA、Vimentin 取对数生长期的CAFs、NFs,加入含盖玻片的6孔板中,常规培养24 h后,4%多聚甲醛固定,0.5% Triton X-100溶液通透20 min,1% BSA封闭30 min。分别加入一抗α-SMA和Vimentin孵育过夜,二抗Dylight488孵育30 min,DAPI染核5 min,于荧光显微镜观察并拍照记录。
2.2.3qPCR检测α-SMA、Vimentin TRIzol法提取CAFs、NFs总RNA,经浓度、纯度测定符合要求后,用cDNA第一链合成试剂盒逆转录cDNA,以α-SMA、Vimentin基因上、下游引物扩增,并进行实时荧光定量PCR,以GAPDH为内参照,在凝胶成像系统进行PCR结果分析。2-ΔΔCT法计算α-SMA、Vimentin基因的相对表达量。引物序列如下:GAPDH,5′-GAAGGTCGGAGTCAACGGAT-3′(forward primer),5′-CCTGGAAGATGGTGATGGG-3′(reverse primer);α-SMA,5′-TATCCCCGGGACTAAGACGG-3′(forward primer),5′-CACCATCACCCCCTGATGTC-3′(reverse primer);Vimentin,5′-CGGGAGAAATTGCAGGAGGA-3′(forward primer),5′-AAGGTCAAGACGTGCCAGAG-3′(reverse primer)。
2.2.4Western blot检测α-SMA、Vimentin 取对数生长期的CAFs、NFs裂解30 min,离心取上清液。BCA法测定蛋白含量,进行SDS-PAGE凝胶电泳,转至PVDF膜,5%脱脂奶粉封闭,以α-SMA、Vimentin为一抗,β-actin为内参,4 ℃孵育过夜,二抗室温孵育1 h,加入ECL曝光显色。
2.3 MTT法绘制CAFs、NFs的生长曲线取对数生长期的CAFs、NFs,以每孔4×103个接种至96孔板,设6个复孔及空白组,依次在培养0、1、2、3 d后,加入MTT溶液20 μL,继续培养4 h后弃上清,加入150 μL DMSO溶液后,振荡10 min,于波长492 nm下测定各孔吸光度值,并绘制生长曲线。
2.4 成纤维细胞对不同比例胃癌细胞增殖和转移的影响
2.4.1构建CAFs/NFs-肿瘤细胞Transwell悬挂式非接触共培养体系 取CAFs、NFs,以每孔1.6×105个种植于Transwell 6孔板,24 h达到对数生长期后,调整MGC-803细胞密度分别为低密度1.2×108·L-1(L组)、中密度2.4×108·L-1(M组)、高密度4.8×108·L-1(H组),每孔1.5 mL种植于Transwell小室共培养48 h,在确保共培养体系细胞高产出率的同时,又可体现不同比例共培养体系的差异性。同时设置上层为MGC-803细胞,下层为基础培养液的空白对照(C组)。
2.4.2MTT法检测细胞增殖活力 分别取CAFs、NFs共培养L、M、H组MGC-803细胞,以每孔4×103个接种于96孔板,设5个复孔及空白组,于0、1、2、3、4、5 d后进行MTT实验,绘制细胞生长曲线。分别取48、72 h处吸光度值进行显著性检验,分析共培养体系对胃癌细胞增殖活力的影响。
2.4.3Transwell法检测细胞的迁移和侵袭能力 细胞迁移实验中,取CAFs以每孔3.6×104个种植于Transwell 24孔板,设置3个复孔,培养24 h后,取CAFs共培养L、M、H组的MGC-803细胞,以每孔6×104个种植于Transwell小室共培养48 h。预冷甲醇固定,0.1%结晶紫染色并拍照。NFs共培养组同上。
细胞侵袭实验中,以1 ∶8稀释Matrigel基质胶,胶凝后,CAFs以每孔3.6×104个种植于24孔板,设置3个复孔,培养24 h后,取CAFs共培养L、M、H组的MGC-803细胞,以每孔1.2×105个种植于Transwell小室共培养48 h。预冷甲醇固定,0.1%结晶紫染色并拍照。NFs共培养组同上。
2.5 AMD3100对CAFs-胃癌细胞共培养体系的影响取CAFs以每孔1.6×105个种植于Transwell 6孔板,24 h后调整MGC-803细胞密度分别为L组、M组、H组,以每孔1.5 mL种植于Transwell小室共培养24 h后,加入AMD3100(10 mg·L-1)至小室继续刺激24 h,并设置空白对照(C组)。分别取上述MGC-803细胞,以每孔4×103个接种于96孔板,设5个复孔及空白组,分别培养48、72 h后,MTT法测定各孔吸光度值。
2.6 成纤维细胞对不同比例胃癌细胞影响的初步机制
2.6.1pH计测定肿瘤微环境酸化情况 取CAFs以每孔1.6×105个种植于Transwell 6孔板,24 h后调整MGC-803细胞密度分别为L组、M组、H组,以每孔1.5 mL种植于Transwell小室共培养,分别于24、48 h取共培养体系上清液测定pH值。
2.6.2乳酸酶法检测细胞分泌乳酸情况 分别取上述共培养体系24、48 h细胞培养液,离心取上清液,根据试剂盒说明操作,于530 nm处测定吸光度值,并计算乳酸含量。
2.6.3DCFH-DA法检测CAFs中ROS水平 取上述共培养后CAFs,根据试剂盒说明操作,以10 μmol·L-1DCFH-DA孵育30 min,于激发波长488 nm,发射波长525 nm处测定吸光度值。
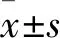
3 结果
3.1 CAFs、NFs的分离纯化组织块接种7 d后,可见CAFs、NFs逐渐沿组织块边缘呈放射状生长,形态呈长梭形、扁平星形、多角形等,CAFs细胞生长速度较快,14 d左右状态良好,NFs生长速度较慢,21 d左右状态良好。细胞消化传代后移入培养瓶,培养至第3代时得到纯化的成纤维样细胞,镜检未见上皮样细胞。
3.2 CAFs、NFs的鉴定
3.2.1形态学特征 如Fig 1所示,CAFs、NFs形态、大小无明显差异,通常含1~3个核,呈梭形、多角形、不规则形等,可随细胞间连接方式的变化而改变。相比NFs,CAFs生长速度较快,重叠生长现象更明显。CAFs、NFs在3~6代时活力旺盛,形态呈梭形,7代以后逐渐出现胞体偏肥大现象,但继续培养,胞体变小,呈长梭形紧密排列,细胞群呈栅栏状、放射状、旋涡状等。17、18代时,细胞活力减弱,不易呈梭形,并出现胞体肥大、光亮度下降、大量颗粒物质、空泡等老化现象。
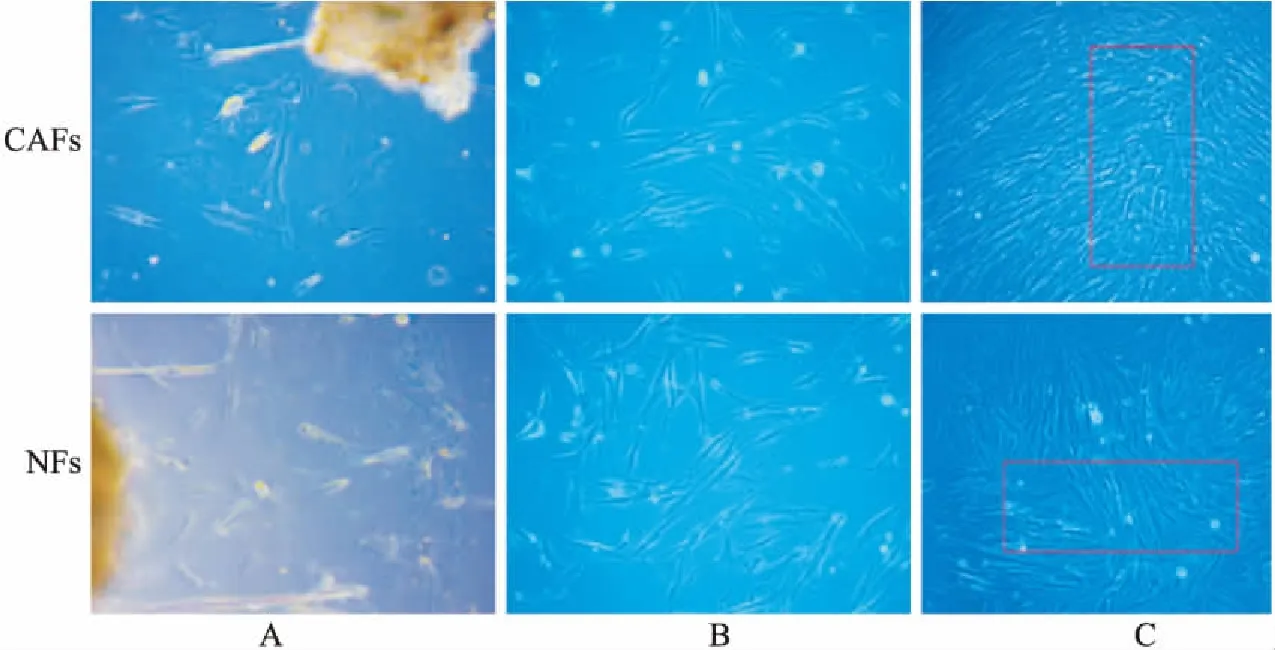
Fig 1 Isolation, purification and overlapping growth of human CAFs, NFs cells(×100)
A: CAFs and NFs cells grew radially along the margin of tissue mass; B: CAFs and NFs cells(the fourth generation) were vigorous and mostly in the shape of long spindle; C: Both CAFs and NFs cells appeared overlapping growth phenomenon(circled in red box), but the phenomenon of CAFs cells was more obvious.
3.2.2α-SMA、Vimentin的表达 如Fig 2A、B、C所示,通过免疫荧光法、qPCR、Western blot测定,CAFs高表达α-SMA和Vimentin,而NFs呈低表达或阴性(P<0.01)。经鉴定,CAFs高表达癌相关成纤维细胞激活标志物α-SMA和成纤维细胞标记物Vimentin,NFs保留了Vimentin的表达,分离纯化成功,原代培养细胞为人胃癌相关成纤维细胞(CAFs)和正常成纤维细胞(NFs),为后期研究提供可靠的细胞模型。
3.3 CAFs、NFs的生长曲线如Fig 2D所示,分离纯化的CAFs、NFs生长状态良好,纯化和培养条件较为适合,CAFs增殖能力和细胞活性均强于NFs。
3.4 成纤维细胞对不同比例胃癌细胞的影响如Fig 3所示,CAFs共培养组MGC-803细胞活力L组>M组>H组,NFs共培养组L、M组相近>H组,仅有CAFs低密度共培养组MGC-803细胞活力明显高于未共培养组,迁移、侵袭结果与48 h处吸光度结果保持一致。表明胃癌细胞与成纤维细胞CAFs、NFs共培养受比例影响较大,在一定空间内,随胃癌细胞比重的增加,共培养体系可能会反过来抑制肿瘤细胞的增长和转移。同时,空白对照组、L、M、H组的MGC-803细胞吸光度值差异无显著性,证明此共培养体系选用的接种密度不影响胃癌细胞活性。


Fig 3 Proliferation, migration and invasion of co-cultured MGC-803 cells(×100)


CAFs共培养组促癌增长与转移能力强于NFs组,肿瘤细胞离开共培养体系后,CAFs促癌增殖能力逐渐减弱,趋向于未共培养组,如Fig 3C所示(72 h)。但NFs在一定程度上也可促进肿瘤细胞的增殖和转移,可能与肿瘤细胞诱导NFs分化为CAFs的过程及成纤维细胞的高度异质性有关。
3.5 AMD3100对CAFs-胃癌细胞Transwell共培养体系的影响如Fig 3C所示,AMD3100-CAFs-胃癌细胞共培养组与常规CAFs-胃癌细胞共培养组吸光度值差异均有显著性。在低密度组、空白组共培养体系中,AMD3100均可抑制胃癌细胞的增长,离开共培养体系后,其抑癌增殖能力逐渐减弱。但随着胃癌细胞比重增加,AMD3100可能会减弱CAFs高密度共培养体系的抑癌效果。
3.6 CAFs-胃癌细胞Transwell共培养体系酸化情况如Fig 4A所示,与空白组相比,CAFs共培养体系pH值降低,表明CAFs为胃癌营造出“高酸性”的肿瘤微环境,并随共培养时间延长而酸性增强。其中,高密度共培养组CAFs层pH值明显低于低、中密度共培养组,而胃癌层并无明显现象。
3.7 CAFs-胃癌细胞Transwell共培养体系乳酸及ROS含量如Fig 4B、4C所示,在共培养体系胃癌层中,低密度共培养组乳酸含量低于空白组,而高密度共培养组高于空白组,并随共培养时间延长乳酸含量降低。在共培养体系CAFs层,乳酸、ROS含量均高于空白组,且随着胃癌密度增大而增加。
4 讨论
肿瘤异质性是恶性肿瘤的特征之一,可使肿瘤的生长转移、药物敏感性、预后等方面产生差异[5],主要体现在肿瘤细胞本身结构特点、行为差异性,以及微环境随肿瘤发展的动态变化。研究显示,CAFs和NFs不仅可以促进肿瘤的发生、发展,也可抑制肿瘤的生长[6-7],同时NFs也可表达α-SMA等癌相关成纤维细胞标志物[8],推翻了以往对成纤维细胞的认知,但具体发生机制尚未阐明。AMD3100是CXCR4的特异性小分子拮抗剂,普遍认为通过阻断SDF-1/CXCR4等信号通路,抑制胃癌细胞的生长与转移[9]。但2018年Berning等[10]发现,AMD3100可促进尤文肉瘤细胞的增殖,并激活受体酪氨酸激酶信号传导,但目前胃癌研究中尚未发现相关报道。CAFs在形态、来源和功能等方面均体现出高度异质性,近几年来,此异质性作用逐渐得到国外学者重视,然而国内报道寥寥无几,值得进一步关注。
本实验通过对人CAFs、NFs的生物学分析,发现CAFs、NFs的形态、大小无明显差异,可能与CAFs来源于静息状态成纤维细胞(NFs)有关。筛选出较为适宜探究CAFs促癌功效的共培养体系,发现CAFs、NFs对肿瘤细胞的促进和抑制作用受共培养比例影响较大,低密度CAFs-肿瘤细胞共培养体系更能明显提高胃癌细胞的增殖、迁移和侵袭能力,高密度共培养体系可能会抑制肿瘤细胞的增殖和转移,并通过3种不同比例共培养,最大程度表现出肿瘤微环境的异质性效果。首次发现CAFs-AMD3100可明显抑制低密度胃癌细胞活性,而促进中高密度胃癌细胞增长,表明肿瘤异质性在CAFs细胞及其SDF-1/CXCR4通路均有体现,为后期探究肿瘤微环境对肿瘤细胞的促进或抑制作用、AMD3100对肿瘤胞的异质性影响提供实验参考与思路。
Pavlides等[11]提出一种新的能量传递机制“反Warburg效应”,即肿瘤细胞分泌过氧化氢,有针对性触发CAFs的氧化应激,导致CAFs线粒体吞噬,产生更多ROS,诱发连锁反应,并通过糖酵解方式产生乳酸、酮等高能量线粒体原料[12],促进癌细胞获得混合糖酵解/OXPHOS表型,以提高代谢可塑性并提供能量[13]。研究发现,胃肠道肿瘤患者体内氧化应激水平升高,少量ROS可促进肿瘤细胞产生,但过高浓度ROS可导致胃癌细胞凋亡。本实验通过不同比例共培养刺激CAFs的“反Warburg效应”,发现低密度共培养组分泌少量的乳酸和ROS,并具有促癌效果,而高密度共培养组酸度过低,乳酸、ROS过高可能与抑制肿瘤细胞活力有关。此模型的建立,有助于利用肿瘤微环境的正反Warburg效应,对肿瘤代谢依赖性和耐药性作用机制进行深入探究。
肿瘤生长转移是一个多因素、多步骤的协同演变过程,受肿瘤微环境及众多细胞因子相互影响,具体机制尚未明确。CAFs可以促进肿瘤细胞增殖、转移和侵袭,且基因组相对稳定,不易耐药。积极探索CAFs与NFs差异性及与肿瘤细胞的相互作用,对从肿瘤微环境多方向、多靶点治疗胃癌有重要意义,为肿瘤的综合治疗和抗肿瘤转移提供了实验依据,也为多组份、多靶点的中医药防治肿瘤术后转移提供了可能和新的研究方向。
(致谢:本实验在江苏省中医药研究院中药药理毒理实验室完成,非常感谢本课题组全体老师和同学的指导和帮助。)