低致敏牛乳清蛋白的酶法制备
李 燕,伊 洋,石 径,王世杰,罗永康,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.中国农业大学 北京食品营养与人类健康高精尖创新中心,北京 100083;3.石家庄君乐宝乳业有限公司,石家庄 050299)
β-乳球蛋白(β-lactoglobulin,β-LG)占牛乳清蛋白的50%[1],对胃酸和蛋白酶有部分抵抗性,经过消化道后仍有部分蛋白结构保持完整,因此是乳清蛋白中最主要的过敏原之一[2-3]。人乳中不含β-LG,调查发现,乳蛋白过敏人群中对β-LG过敏的人占82%[4]。如何采用适宜的方案对乳蛋白进行改性,在保留乳蛋白本身营养价值的同时有效降低β-LG的抗原性具有重要的现实意义。
蛋白酶水解是改变牛乳蛋白抗原性最有效的方法之一,其操作过程条件比较温和,对牛乳中的营养物质破坏相对较少,并且酶解产生的短肽更有利于人体吸收。已有研究报道,蛋白酶解可降低β-LG的过敏原性,并提高其功能性[5]。尽管大部分乳蛋白过敏患者可以接受深度水解的配方乳粉,但仍然有小部分人对蛋白水解物有过敏反应,如过敏性皮炎[6],这可能是由于水解物中的某些小肽段仍具有抗原性[7]。酶解改性能够破坏乳蛋白的非线性表位与线性表位,抗原表位是否保留很大程度上取决于乳蛋白水解度及酶解使用的酶种类[8]。当蛋白酶水解度合适时,可以破坏乳清蛋白的抗原线性表位,降低其致敏性;但当水解度过小时,反而可能暴露乳清蛋白内部的抗原表位,导致其抗原性有所增强;而深度水解可以将乳清蛋白水解成很小的肽段或是氨基酸,从而降低其抗原性,但是深度水解的酶解物一般具有比较严重的苦味,这可能会影响水解产物的应用。因此选择适宜的蛋白酶并确定恰当的水解条件是蛋白质酶法改性的关键。
本研究以浓缩乳清蛋白粉80(whey protein concentrate 80,WPC80)作为酶解原料,通过酶解技术降低乳清蛋白中β-LG的抗原性,以水解度、分子质量分布及抗原性为主要检测指标,筛选β-LG抗原性较低的酶解产物进行苦味评价,确定最适宜的蛋白酶及酶解条件,为制备低致敏乳清蛋白产品提供理论基础。
1 材料与方法
1.1 材料与试剂
WPC80 君乐宝乳业集团。
碱性蛋白酶、胰蛋白酶、风味蛋白酶 丹麦Novozymes公司;β-LG、辣根过氧化物酶(horseradish p e r o x i d a s e,H R P)标记羊抗兔免疫球蛋白G(i m m u n o g l o b u l i n G,I g G)、邻苯二甲醛(o-phthalaldehyde,OPA)美国Sigma公司;牛血清白蛋白(bovine serum albumin,BSA)美国Amresco公司;多克隆抗体(兔抗β-LG血清)上海裕信生物科技有限公司;其他试剂均为分析纯 北京化学试剂公司。
1.2 仪器与设备
MultiskanMK3酶标仪 美国Thermo-Scientific公司;ZW-A微量振荡器 江苏省金坛市荣华仪器制造有限公司;Vortex-Genie 2漩涡混合器 美国Scientific Industries公司;3590 96孔酶标板 美国Corning公司;FD-1PF冷冻干燥机 北京德天佑科技发展有限公司;UNICO-2600A紫外-可见分光光度计 美国Unico公司;CXTH-3000高效液相色谱仪 北京创新通恒有限公司;TGL-16A冷冻离心机 长沙仪器仪表有限公司。
1.3 方法
1.3.1 乳清蛋白水解
将WPC80配制成质量浓度15 g/100 mL的溶液,用碱性蛋白酶、胰蛋白酶及复合酶进行酶解,以加酶量为5 000 U/g(酶活/底物质量)加入蛋白酶,酶解条件如表1所示,酶解过程中用1 mol/L HCl或1 mol/L NaOH溶液维持稳定的pH值。酶解时间均为3h,每隔30 min各取样1 次,将得到的样品用沸水浴灭酶10 min,冷却后离心(12 000 r/min,10 min)。将所得上清液的pH值调至中性,真空冷冻干燥后于-20℃贮藏。
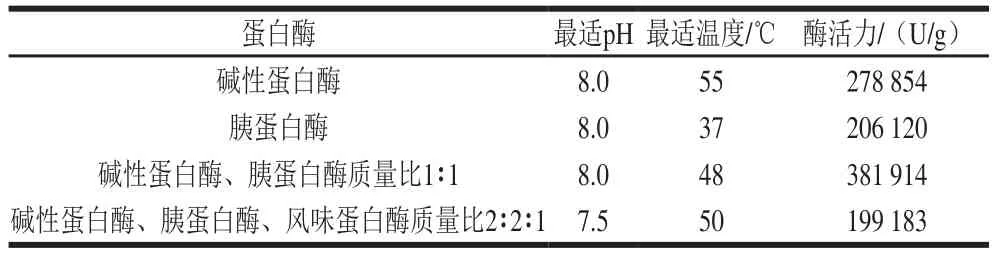
表1 酶反应条件和酶活力Table1 Reaction conditions and activities of various enzymes
1.3.2 水解度测定
参照Nielsen等[9]的方法,并稍作修改。称取200 mg OPA溶解于5 mL无水乙醇中,加入150 mL 0.3 mol/L四硼酸钠溶液、250 mg十二烷基硫酸钠及200 mg二硫苏糖醇,定容至250 mL,待用。将WPC80酶解物稀释600 倍,取400 μL加入4 mL上述OPA溶液中,振荡混匀,室温反应2 min,测定340 nm波长处的光密度(optical density,OD)(OD340nm)。配制浓度分别为0、0.2、0.4、0.6、0.8、1.0 mmol/L的L-丝氨酸溶液,与上述OPA溶液反应2 min,测定OD340nm,绘制标准曲线。水解度按下式计算。

式中:c为由标准曲线计算所得L-丝氨酸浓度/(mmol/L);V为乳清蛋白酶解液体积/L;m为WPC80质量/g。
1.3.3 分子质量分布测定
参考Xie Ningning等[10]的方法,采用高效液相色谱法检测WPC80酶解物的分子质量分布,并稍作修改。配制5 mg/mL WPC80酶解物溶液,0.45 µm滤膜过滤待用。
高效液相色谱条件:色谱柱为COSMOSIL 5 C18-PAQ(4.6 mm×250 mm,5 µm);流动相A为含0.1 g/100 mL三氟乙酸的超纯水,流动相B为含0.1 g/100 mL三氟乙酸的乙腈;柱温40℃,进样量25 μL,检测波长214 nm,流速0.5 mL/min;洗脱条件:55%流动相A,45%流动相B,时间40 min。
以细胞色素C(1 2 3 6 2 D a)、抑肽酶(6 511.4 Da)、杆菌肽(1 423 Da)、Gly-Gly-Tyr-Arg(四肽,451 Da)和Gly-Gly-Gly(三肽,189 Da)作为标准物。
1.3.4 间接竞争酶联免疫吸附法确定最佳抗原包被质量浓度与兔抗血清稀释倍数
采用棋盘法确定β-LG最佳包被质量浓度与兔抗血清最佳稀释倍数。β-LG稀释为不同质量浓度后,以每孔100 μL加入96孔酶标板中,4℃冷藏过夜;同时将兔抗血清进行梯度稀释,与等体积0.01 mol/L 磷酸缓冲溶液(phosphate buffer saline,PBS)混合,4℃冷藏过夜;将96孔酶标板溶液倒出后,每孔用250 μL 0.01 mol/L PBS洗涤3 次,晾干后,每孔加入100 μL封闭液,37℃温育1h后洗板。将梯度稀释的兔抗血清溶液加入96孔酶标板内,每孔100 μL,37℃温育1h后洗板。HRP-羊抗兔IgG稀释10 000 倍后加入96孔酶标板中,每孔100 μL,37℃温育1h后洗板。将显色液3,3’,5,5’-四甲基联苯胺(3,3’,5,5’-tetramethylbenzidine,TMB)溶液加入96孔酶标板内,每孔100 μL,37℃反应10 min;每孔加入50 μL 2 mol/L H2SO4终止液。测定每孔OD340nm,OD340nm接近1.0时抗原抗体反应最敏感,由此确定最佳抗原β-LG包被质量浓度和兔抗血清稀释倍数。
1.3.5β-LG抗原性测定
使用间接竞争酶联免疫吸附法[11-12]测定水解乳清蛋白中β-LG的抗原性,具体步骤为:1)抗原包被:配制1.0 μg/mLβ-LG溶液,加入96孔酶标板内,每孔100 μL,4℃冷藏过夜;2)抗原与抗体反应:配制0.5 mg/mL WPC80酶解物溶液,与等体积稀释后的兔抗血清混合,4℃冷藏过夜;3)封闭:倒出96孔酶标板中溶液后,每孔用250 μL 0.01 mol/L PBS洗涤3 次,晾干后,每孔加入100 μL封闭液,37℃温育1h后洗板;4)加样:将2)中配制的溶液加入96孔酶标板内,每孔100 μL,37℃温育1h后洗板;5)加酶标二抗:HRP-羊抗兔IgG稀释10 000 倍后加入96孔酶标板中,每孔100 μL,37℃温育1h后洗板;6)显色:将显色液TMB溶液加入96孔酶标板内,每孔100 μL,37℃反应10 min;7)终止反应:每孔加入50 μL 2 mol/L H2SO4终止液;8)OD测定:用酶标仪检测OD450nm和OD630nm,每孔OD=OD450nm-OD630nm。
标准曲线的制作:a)将系列质量浓度(0.125、0.25、0.5、1、2、4、8、16、32 μg/mL)β-LG溶液经酶联免疫吸附法测定,将各质量浓度溶液对应的OD转化为B/B0,其中B0为无抗原竞争体系的OD,B为有抗原抑制时的OD,以B/B0为纵坐标,以β-LG抗原相应质量浓度(ρ)的对数(lgρ)为横坐标,制作标准曲线;b)标准曲线的Logit线性回归:选择标准曲线上B/B0和lgρ呈最明显线性相关的部分,计算标准曲线上每个标准点的Logit(B/B0),以Logit(B/B0)作为纵坐标再制作对应于lgρ的标准曲线,对Logit(B/B0)进行线性回归分析,得出线性回归方程及相关系数;c)抗原性的表示:根据待测样品在酶联免疫吸附法中测得的B/B0,计算待测样品中β-LG的抗原性(以等价的质量浓度表示)。
1.3.6 苦味评价
参考李学林等[13]的方法,并稍作修改。以WPC80、丹麦3080深度水解乳清蛋白粉作为参比品。将WPC80的苦味值定为0,丹麦3080深度水解乳清蛋白粉苦味值定为4。将参比品和不同酶解方案中抗原性最低的样品配成质量浓度为10 g/100 mL的溶液,用于苦味评价。
取20 mL参比溶液于纸杯中,在纸杯上标出溶液的苦味值,评价者将其含于口中15 s,测试时口腔做漱口动作,以便于舌根及舌侧的苦味感受区可以充分感受到苦味,吐出后用清水漱口5 次,直到口腔内无味道。
取20 mL样品溶液于纸杯中,对比参比溶液,评价者根据表2的描述确定苦味等级并记录,再根据同一级别内不同样品相对苦味的大小确定具体的苦味值并记录。清水漱口5 次,直到口腔内无味道,再进行下一个样品的测定。此外,评价者对样品进行评价时,均采用低苦度向高苦度的方法对样品进行测试。
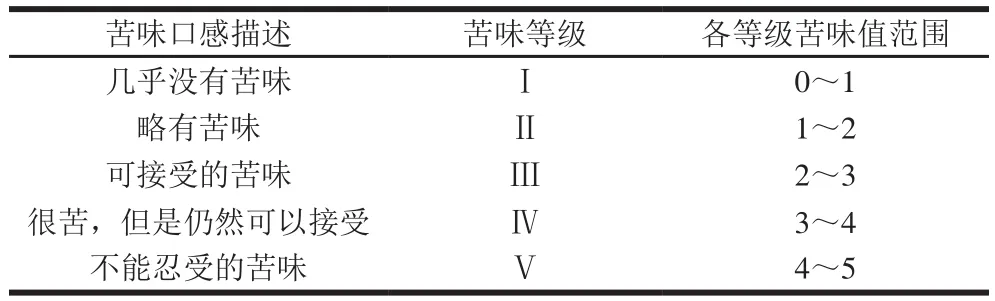
表2 苦味评价参照表Table2 Criteria for bitter taste evaluation
1.4 数据处理
实验数据以平均值±标准差表示,每组实验重复3 次,使用Excel 2010软件进行处理并作图,运用SPSS 20.0软件进行差异分析和相关性分析。
2 结果与分析
2.1 WPC80酶解产物的水解度测定
由图1可知,酶解时间0.5h内,4 种酶解方案的酶解速率最快,后期趋于平稳。复合酶的酶解能力在酶解1.0h后明显高于单酶,这可能是由于多种酶复合水解时,酶的作用位点更加广泛,酶解能力因此增强[14]。碱性蛋白酶+胰蛋白酶组的水解度在2.0h内与碱性蛋白酶+胰蛋白酶+风味蛋白酶组基本相同,2.0~3.0h内碱性蛋白酶+胰蛋白酶+风味蛋白酶组的水解度略高。
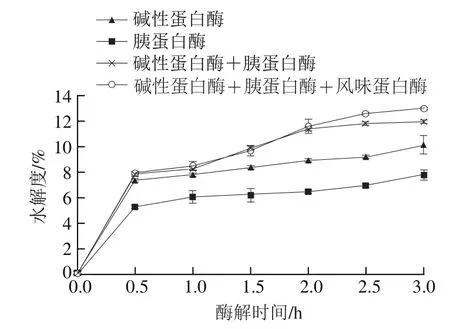
图1 不同酶解方案WPC80酶解产物的水解度Fig.1 Hydrolysis degrees of WPC80 hydrolysates with different proteases
2.2 WPC80酶解产物的分子质量分布
由图2可知,与原料乳相比,酶解后的WPC80中小于1 000 Da的组分含量显著增加,大于2 000 Da的组分含量显著减少。碱性蛋白酶、碱性蛋白酶+胰蛋白酶及碱性蛋白酶+胰蛋白酶+风味蛋白酶组WPC80酶解产物的分子质量分布相近,且产物小分子质量组分含量明显小于胰蛋白酶组。van Beresteijn等[15]发现,乳清蛋白水解肽分子质量低于3 400 Da时不容易引起过敏反应。酶解2.5h时,碱性蛋白酶、碱性蛋白酶+胰蛋白酶及碱性蛋白酶+胰蛋白酶+风味蛋白酶组WPC80酶解产物中,分子质量小于3 000 Da的组分分别占96.63%、93.10%和95.50%,高于其他酶解时间点,其中分子质量小于500 Da组分的含量分别占44.43%、50.68%和56.77%,分子质量500~1 000 Da的组分分别占32.04%、23.76%和21.84%,分子质量1 000~2 000 Da的组分分别占16.66%、14.95%和13.72%。Carvalho等[16]研究发现,乳清蛋白水解肽诱发免疫反应的最小分子质量在3 000~5 000 Da范围内,本研究中酶解2.5h时此范围内的水解肽相对较少。

图2 不同酶解方案WPC80酶解产物的分子质量分布Fig.2 Molecular mass distribution of WPC80 hydrolysates with different proteases
2.3 β-LG最佳抗原包被质量浓度与兔抗血清最佳稀释倍数
由表3可知,OD340nm接近1.0时抗原抗体反应最敏感,因此确定抗原β-LG的最佳包被质量浓度为1.0 μg/mL,兔抗血清稀释倍数为1∶25 000。

表3 不同β-LG包被质量浓度和兔抗血清稀释倍数时的OD340 nmTable3 Determination of coating concentration of β-LG antigen and rabbit anti-β-LG serum dilution
2.4 β-LG的抗原性
由图3可知,蛋白酶水解能够显著降低WPC80中β-LG的抗原性,但不能完全消除,这与Yao Mingjing等[17]的研究结果相同。Rosendal等[18]对市售12 种水解乳配方进行研究,发现其中仍有残余的β-LG抗原性,水解程度低的配方乳中β-LG的残留抗原性更高。碱性蛋白酶组水解2h时水解产物中的β-LG抗原性最低,为0.67 μg/mL;碱性蛋白酶+胰蛋白酶组和碱性蛋白酶+胰蛋白酶+风味蛋白酶组水解2.5h时的β-LG抗原性最低,分别为0.79、1.50 μg/mL;胰蛋白酶组的β-LG抗原性随酶解过程不断下降,在3h时降至2.27 μg/mL。碱性蛋白酶组与碱性蛋白酶+胰蛋白酶组水解后残余的β-LG抗原性明显高于另外2 种酶解方案,但是碱性蛋白酶组酶解不同时间时的残余β-LG抗原性波动较大,这与江连洲等[19]的研究结果一致,这可能是由于随着酶解过程的进行,乳蛋白结构发生变化,使内部的抗原表位暴露,从而引起抗原性的波动。
2.5 WPC80酶解产物的苦味评价
由表4可知,胰蛋白酶酶解3.0h产物、碱性蛋白酶+胰蛋白酶及碱性蛋白酶+胰蛋白酶+风味蛋白酶酶解2.5h产物苦味值较低,且无显著性差异(P>0.05),评价者描述这3 种溶液(10 g/100 mL)的苦味很淡。碱性蛋白酶酶解2.0h产物苦味值较高,有明显的苦味。含有疏水性氨基酸的短肽是酶解产物苦味的主要来源[20],研究表明,胰蛋白酶水解得到的肽段多以Arg和Lys为C末端残基,产生的疏水肽较少,因此苦味较低[21],而碱性蛋白酶作用部位是羧基侧芳香族或疏水性氨基酸,疏水基团暴露,水解物的苦味增强[22]。

表4 不同酶解方案WPC80酶解产物及对照样品的苦味评价表Table4 Bitter taste evaluation of WPC80 hydrolysates with different proteases and control samples
3 结 论
碱性蛋白酶、碱性蛋白酶+胰蛋白酶及碱性蛋白酶+胰蛋白酶+风味蛋白酶组WPC80酶解产物的分子质量明显低于胰蛋白酶组,其中碱性蛋白酶组和碱性蛋白酶+胰蛋白酶组分别在酶解2.0、2.5h时残余β-LG抗原性达到最低,分别为0.67、0.79 μg/mL,但碱性蛋白酶组酶解产物苦味较明显,因此选择碱性蛋白酶+胰蛋白酶制备低抗原性WPC80酶解物,其酶解条件为底物质量浓度15 g/100 mL、加酶量5 000 U/g(50%碱性蛋白酶+50%胰蛋白酶)、酶解温度48℃、酶解pH 8.0、酶解时间2.5h。

