印度梨形孢促进棉花幼苗生长及诱导提高苗期抗旱性研究
潘 锐,邓 晶,胡爱兵,张文英
(1.长江大学作物抗逆技术研究中心,湖北 荆州 434025;2.荆州农业科学院棉花研究所,湖北 荆州 434000)
棉花是世界上最重要的天然纤维作物,陆地棉(GossypiumhirsutumL.)是世界上最重要的棉花栽培种,占全球棉花种植面积的90%以上。中国是世界最大的产棉国,最大的纺织大国和纺织品出口大国,棉花产业在国民经济发展中起很重要的作用。夏季正值棉花的生长期,在降雨量少的新疆棉区和处于副热带高温高压覆盖下的长江中下游棉区,干旱成为制约棉花产量的因素之一。

印度梨形孢真菌(Piriformosporaindica)可以定殖于植物根部[9],促进植物生长[10],改善植株形态[11],增强植物对氮、磷、硫等矿物质的吸收能力,提高植物对生物与非生物逆境的忍耐力[12-14]。前人研究表明,Piriformosporaindica能诱导提高小白菜[15]、大麦[16]、油菜[11]、紫花苜蓿[12]、花生[17]、芝麻[18]、玉米[19]等作物的抗旱性。目前,印度梨形胞对棉花抗旱性效应方面的研究尚未见报道。本试验以干旱敏感棉花品种沙洋505-3A为试验材料,通过自然干旱处理和PEG-6000模拟生理干旱,研究接种印度梨形孢对棉花幼苗生长及诱导抗旱性的影响,为提高棉花抗旱性的实践提供理论依据。
1 材料与方法
1.1 试验材料
沙洋505-3A(干旱敏感品种),由国家棉花中期种质库(河南安阳)提供。印度梨形孢菌种,由德国耶拿大学Ralf Oelmüller教授提供。
1.2 试验设计
1.2.1 种子和真菌预处理 选取颗粒饱满,大小一致的棉花种子,用0.5%次氯酸钠(NaClO)处理10 min,清水冲洗5次后浸泡3 h,播种到育苗盘(96孔)中,生长至3叶1心期;印度梨形孢接种到PDA培养基中生长6~8周,挑选活力充足的菌块接种到ASP培养基中,放置在温度为25℃,150 r·min-1的恒温摇床中培养10 d备用。
1.2.2 共生体系的构建 将印度梨形孢加入无菌水中(1 mg:100 ml),用搅拌机打散并混合均匀制成菌液。挑选整齐一致棉花幼苗,移栽至小生长盆(9 cm×13 cm,直径×高)中,并在幼苗根系注射1ml菌液,共生培养12d后随机挑选5株幼苗,蒸馏水冲洗根系泥沙后,剪成1 cm长小段, 10% KOH处理12h,1% HCl浸泡5 min后洗净,0.04%台盼蓝染色制片,显微镜(Nikon Ri260)下观察根系孢子定殖情况。
1.2.3 自然干旱处理 将接菌(P+,下同)和不接菌(P-,下同)的幼苗取出,冲洗干净移栽至装有等质量已烘干细沙的生长盆中,每盆4株,每个处理20盆,各80株苗。每盆浇200 ml的Hoagland营养液后,干旱(D+,下同)处理组不再浇水,非干旱(D-,下同)组正常浇水,处理20 d。试验设置4次重复。
1.2.4 PEG干旱处理 将接菌和不接菌的幼苗取出,冲洗干净后移栽在有孔的泡沫板上,泡沫板置于装有1.8 L 50% Hoagland溶液的塑料生长盆(28 cm×15 cm×15 cm,长×宽×高)中,每盆4株,每个处理20盆。空气泵通空气缓苗2 d后开始PEG-6000处理,浓度设置为15%、20%(W/V),对照组(CK)加等体积蒸馏水,处理24 h。试验设置4次重复。
1.3 测定指标和方法
1.3.1 形态指标 接种印度梨形孢20 d后,测量棉花株高、茎粗、叶面积;用WinRHIZO根系分析系统测量植株根系参数(下同);将地上部分和地下部分分离,称量鲜重后105℃杀青,75℃烘干至恒重测量干重。自然干旱处理7d后采集照片,测量株高、茎粗、根系参数。PEG胁迫处理48 h后采集照片。
1.3.2 叶片光合作用参数 接种印度梨形孢20 d后采用LI-6400光合作用仪(LI-COR),LED内置红蓝光源,光强800 μmol·m-2·s-1测量净光合速率(Pn)、蒸腾速率(Tr)、胞间CO2浓度(Ci)、气孔导度(Gs)。
1.3.3 叶片温度 干旱处理7 d后用红外热成像(IRBIS plus 3)仪采集叶片温度。PEG胁迫下用红外热成像仪从0~24 h每1 h采集一次热红外图像。
1.3.4 叶片光谱反射率 干旱处理7 d后用FieldSpec 4 Wide-Res Field Spectroradiometer便携式地物光谱仪测量倒三叶叶片的光谱,测量范围为350~2 500 nm,光谱间隔3 nm@700 nm,每个叶片读取3次数据。
1.3.5 数据处理 试验数据采用Excel 2010处理和作图,DPS 9.05数据处理软件进行方差分析。
2 结果与分析
2.1 印度梨形孢在棉花幼苗根系定殖
共生12 d后,棉花植株根系镜检图片(图1)可以看到:印度梨形孢的厚垣孢子成串排列于根系内,且分布密集,数量多。印度梨形孢成串排列是其进入植株根内的典型特征,表明印度梨形孢成功进入棉花根系内并有效定殖。
2.2 印度梨形孢对棉花幼苗生长的影响
棉花幼苗接种印度梨形孢共生生长20 d后,调查其生长状况(图2),分析可知:接菌植株(P+,下同)对比不接菌植株(P-,下同),株高、茎粗、叶面积分别增加了32.4%、15.8%和20.5%,均达到显著水平(P<0.05,下同)。表明接种印度梨形孢可以促进棉花幼苗生长。
沙洋505-3A接种印度梨形孢共生20 d后扫描根系生长参数(表1),分析可知:接种印度梨形孢后,总根长、根总表面积、根体积和根尖数分别增加了23.9%、9.2%、35.6%和62.5%,均达到显著水平。表明接种印度梨形孢后,促进了沙洋505-3A根系的生长,根系形态发生改变,侧根数量显著增加。

图1 印度梨形孢在棉花幼苗根部的定殖Fig.1 Colonization of Piriformospora indicaon the root of cotton

注:不同小写字母表示差异显著(P<0.05),下同。Note: Different lowercase letters indicate significate difference (P<0.05), the same below.图2 接种印度梨形孢20 d的棉花幼苗生长状况Fig.2. Piriformospora indica affected morphological growth on cotton seedling after 20 d of treatment

处理Treatment总根长Total rootlength/cm根总表面积Total root surface area/cm 2根体积Root volume/cm 3根尖数Root tip numberP+218.76±11.059a14.14±0.395a0.301±0.017a498.32±45.886aP-176.62±9.824b12.95±0.260b0.222±0.012b306.60±24.000b
注: 同列不同小写字母表示显著性差异(p<0.05), 下同.
Notes: Different lowercase letters in same column indicate significant difference (p<0.05). The same below.
沙洋505-3A接种印度梨形孢20 d后生物量测定(表2)分析可知:接种印度梨形孢后沙洋505-3A地上部分鲜重和干重分别增加了27.7%和39.2%,地下部分鲜重和干重分别增加了20.3%和20.7%,均达到显著差异。表明印度梨形孢定殖于棉花根系内显著促进棉花地上部分和地下部分干物质的累积。
2.3 印度梨形孢对棉花幼苗光合作用的影响
对接种印度梨形孢20 d后棉花幼苗的光合作用参数(图3)分析可知:接种印度梨形孢棉花植株对比未接菌的植株净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度、蒸腾速率分别提高了29.1%、55.9%、20.1%和51.1%。表明接种印度梨形孢增强了沙洋505-3A的光合作用。其中,气孔导度增加最为显著,继而引起胞间CO2浓度上升,净光合作用增加。
2.4 印度梨形孢诱导提高棉花的抗旱性
2.4.1 干旱胁迫下印度梨形孢对棉花地上部形态的影响 调查接种印度梨形孢对沙洋505-3A抗旱性的影响,由图4可以看到:P+D-(接菌,不干旱,下同)和P-D-(未接菌,不干旱)对比,接菌棉花植株的株高、真叶数目、叶面积等明显大于不接菌植株,促生作用显著;P+D+(接菌,干旱)和P-D+(未接菌,干旱)对比,接菌的植株干旱处理7 d后其叶片卷曲和萎蔫下垂程度明显比未接菌的植株减轻。测量棉花植株的株高和茎粗(图5),分析可知:干旱胁迫7 d后,未接菌植株株高和茎粗分别降低23.3%和8.7%;接菌植株株高和茎粗分别降低14.1%和5.3%。说明接种印度梨形孢降低了干旱胁迫对棉花植株生长的抑制效应,诱导提高了棉花的抗旱性。
2.4.2 干旱胁迫下印度梨形孢对棉花根系形态的影响 调查接种印度梨形孢干旱处理7 d后根系性状(图6),从根系扫描图分析可知:对比P+D-和P+D+,接菌植株在干旱条件下侧根数量显著增加,根长变化不明显;对比P-D-和P-D+,不接菌植株在干旱条件下侧根数量变化不明显,但根长显著增加。从分析得到的根系指标(表3)可知:干旱7 d后,接菌植株总根长、总根表面积、根体积、根尖数分别增加了9.6%、9.9%、3.8%和21.3%;不接菌植株总根长、总根表面积、根体积分别增加了11%、27.7%、12.2%,根尖数降低5.2%。这表明接种印度梨形孢植株在干旱条件下,主要是通过增加侧根数量来响应逆境;未接菌植株在干旱条件下,主要的根系形态变化是根长和表面积显著增加。二者在根系形态结构上存在显著差异。

表2 接种印度梨形孢20 d后棉花植株地上部、地下部干鲜重

图3 接种印度梨形孢20 d后的棉花幼苗光合作用参数Fig.3 Photosynthetic parameters of cotton seedling inoculated with Piriformospora indica for 20 days
2.4.3 干旱胁迫下印度梨形孢对棉花叶温的影响 热红外图像中提取叶温(图7),干旱处理前,接种印度梨形孢植株叶片温度高于未接菌植株。干旱处理7 d后,未接菌植株叶片平均温度上升0.97℃;接菌植株叶片平均温度上升0.34℃。这表明接种印度梨形孢减缓了干旱条件下棉花叶片温度的上升,在一定程度上维持了叶片的正常生长代谢。
2.4.4 干旱胁迫下印度梨形孢对棉花叶片光谱反射率的影响 分析叶片的光谱反射率图像可知:350~780 nm为色素相关波段(图8a),光谱曲线在400~480 nm和650~720 nm两个波段各有1个由于色素强烈吸收产生的波谷,干旱胁迫后接菌和不接菌植株波谷反射率均升高,且不接菌植株升高更显著。这说明干旱胁迫后,植株叶片吸收光能降低,且不接菌植株比接菌植株降低更显著;在1 350~1 480 nm和1 820~2 000 nm两个波段各有一个随含水量升高而降低的波谷(图8b),干旱胁迫后接菌和不接菌植株波谷反射率均升高,且不接菌植株升高更显著。说明干旱胁迫后,植株叶片含水量降低,且接种印度梨形孢减缓了棉花植株叶片含水量的降低。

注:P+D-: 接菌不干旱;P-D-: 不接菌不干旱;P+D+: 接菌干旱;P-D+:不接菌干旱。Note:P+D- means inoculated with Piriformospora indica and without drought treatment; P-D-means non-inoculated with Piriformospora indica and without drought treatment; P+D+ means inculated with Piriformospora indica and with drought treatment; P-D+ means non-inoculated with Piriformospora indica and with drought treatment.图4 干旱胁迫和接种印度梨形孢对棉花幼苗植株形态的影响Fig.4. Morphological characters of cotton seedlings inoculated with Piriformospora indica or drought stress

图5 干旱胁迫和接种印度梨形孢对棉花幼苗株高、茎粗的影响Fig.5 Plant height and stem diameter of cotton seedlings inoculated with Piriformospora indica or drought stress
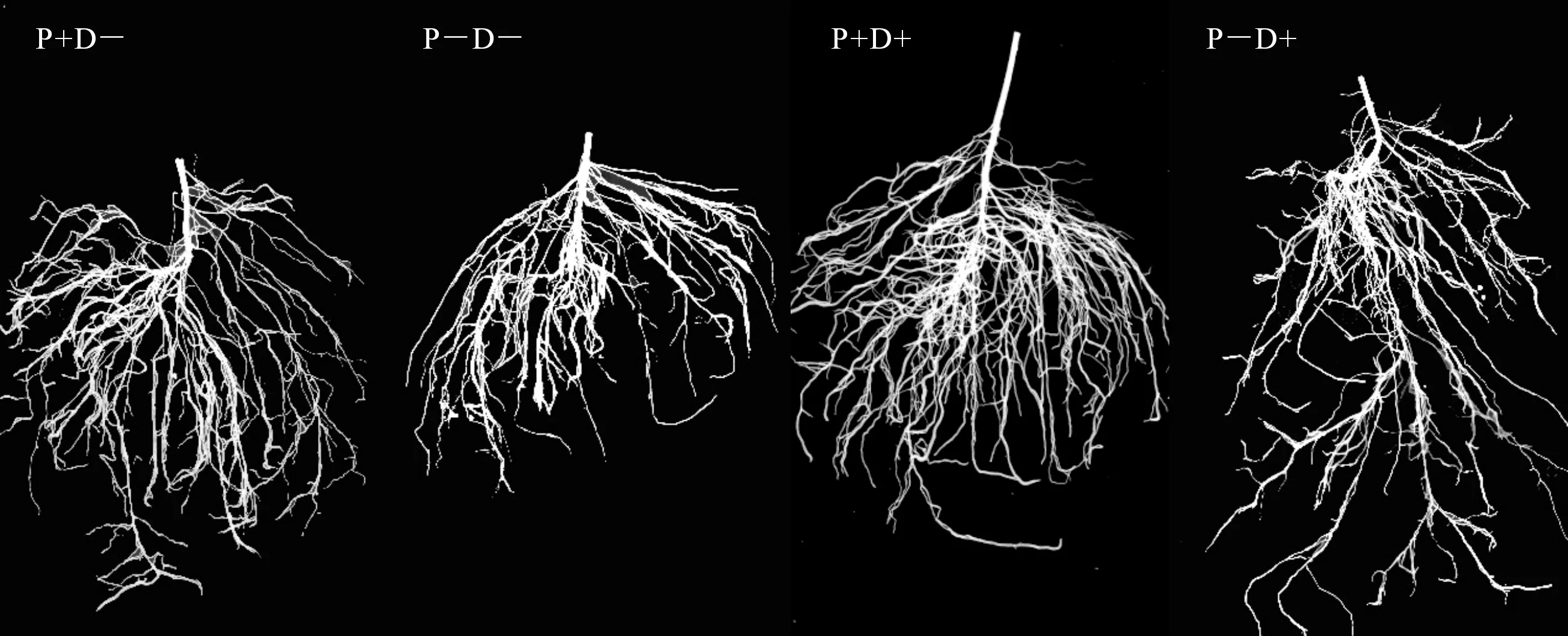
图6 各处理棉花幼苗根系扫描图Fig.6 The scanning picture of root system of cotton seedlings under different treatments

处理Treatment总根长Total root length/cm总根表面积Total root surface area/cm2根体积Root volume/cm3根尖数Root tip numberP+D-262.7±17.406b18.1±0.368b1.823±0.047a325.1±33.6bP+D+287.8±6.861a19.9±0.441a1.884±0.275a394.3±32.5aP-D-234.1±30.020c13.0±0.260c1.221±0.012c306.6±24.0cP-D+259.9±5.642b16.6±0.580b1.370±0.041b290.8±32.1c

图7 干旱处理0、7 d接菌和不接菌植株红外图像和叶片温度Fig.7 The thermography image and leaf temperature of cotton plants inoculated withPiriformospora indica under drought treatment for 0 and 7 days

图8 各处理棉花叶片色素(a)和水分(b)相关波段反射率Fig.8 Reflectance of leaf pigments and water related bands of cotton plants inoculated withPiriformospora indica under drought stress for 7 days
2.4.5 干旱胁迫下印度梨形孢对棉花MDA含量的影响 由接种印度梨形孢干旱处理7 d后MDA含量(图9)分析可知:干旱处理7 d后接种和不接种印度梨形孢植株分别与P+D-和P-D-2个处理相比MDA含量上升9.9%和19.1%,且不接菌植株达到显著水平(P<0.05),接菌植株不显著。这说明:接种印度梨形孢可以缓解干旱胁迫下棉花植株产生MDA。
2.4.6 PEG胁迫下印度梨形孢对棉花形态的影响 PEG胁迫48 h后植株形态(图10a)可以看出:接种和不接种印度梨形孢植株在15%PEG胁迫下均出现叶片失水萎蔫下垂,且未接种印度梨形孢植株叶片下垂更显著;20%PEG胁迫后接种和不接种印度梨形孢植株叶片失水比15%PEG胁迫下更显著,且不接菌植株出现茎秆倒伏的现象。叶片形态图(图10b)可以看出:接菌植株叶片在15%和20%PEG胁迫下卷曲程度和萎蔫程度均较未接菌植株减轻。这说明15%和20%PEG胁迫下,接种印度梨形孢减缓了对植株形态学的影响,维持了植株生长。
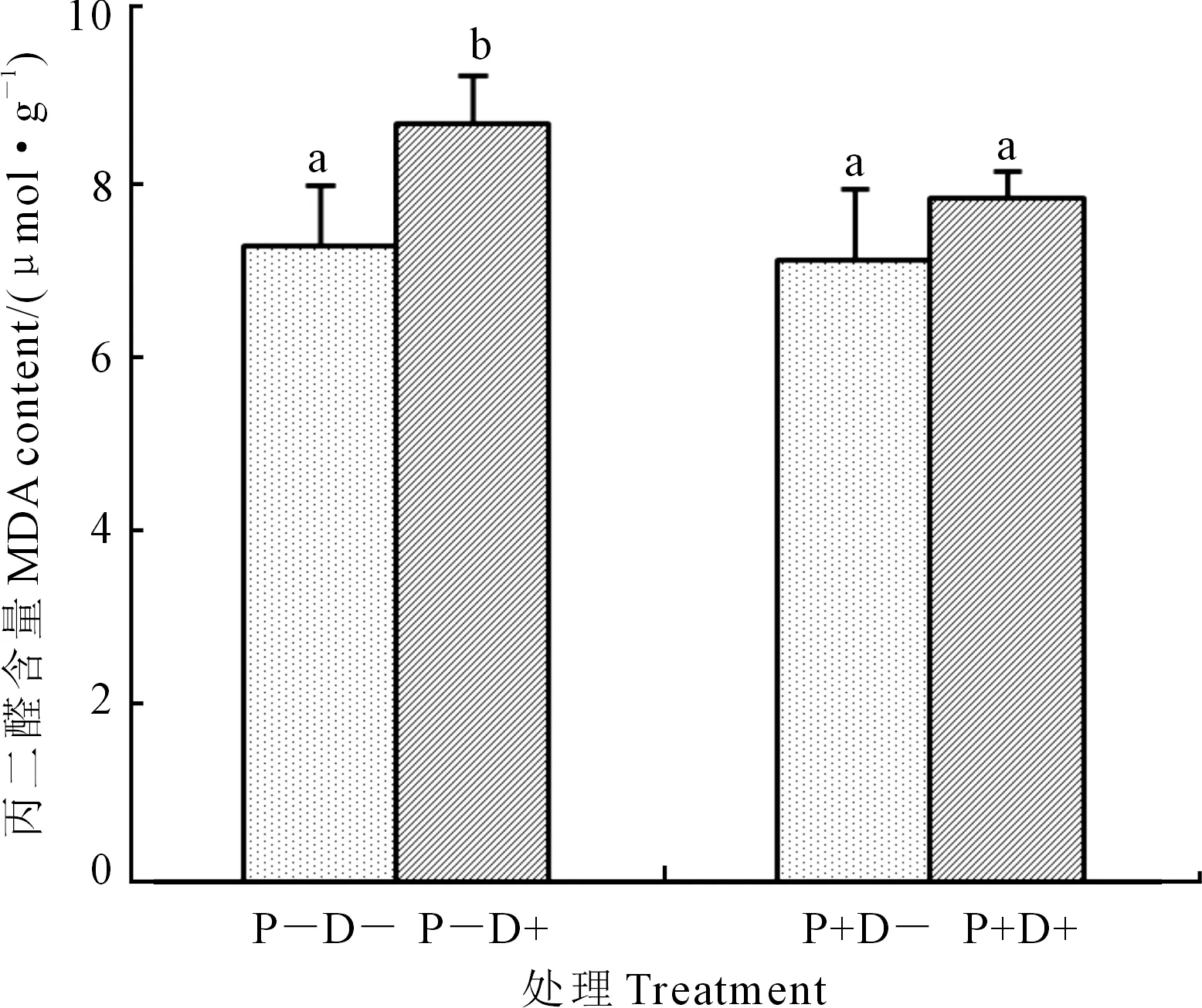
图9 干旱胁迫7 d后各处理MDA含量Fig.9 MDA content of cotton plants inoculated withPiriformospora indica under drought stress for 7 days

注:从左至右依次为:P+CK, P+15%PEG, P+20%PEG, P-CK, P-15%PEG, P-20%PEG。Note: From left side to right side in order:P+CK, P+15%PEG,P+20%PEG,P-CK, P-15%PEG, P-20%PEG.图10 PEG胁迫48 h后接菌和不接菌植株(a)和倒三叶叶片形态(b)对比Fig.10 Plant morphology of whole plant (a), backward third leaf (b) of cotton inoculated withPiriformospora indica under PEG induced drought stress for 48 h
2.4.7 PEG胁迫下印度梨形孢对棉花叶温的影响 记录接种和不接种印度梨形孢棉花植株遭受不同浓度PEG胁迫后的实时温度(图11),分析可知:接种和不接种印度梨形孢棉花植株在0、15%、20%PEG胁迫下叶片实时温度逐渐升高;接菌植株在0、15%、20%PEG胁迫下叶温均低于未接菌植株;未接菌植株在15%和20%PEG胁迫下叶温上升幅度大于未接菌植株。这说明随着PEG浓度的升高,叶片叶温逐渐升高,接种印度梨形孢减缓了棉花植株在PEG胁迫下叶温的升高,维持叶片的正常生长。
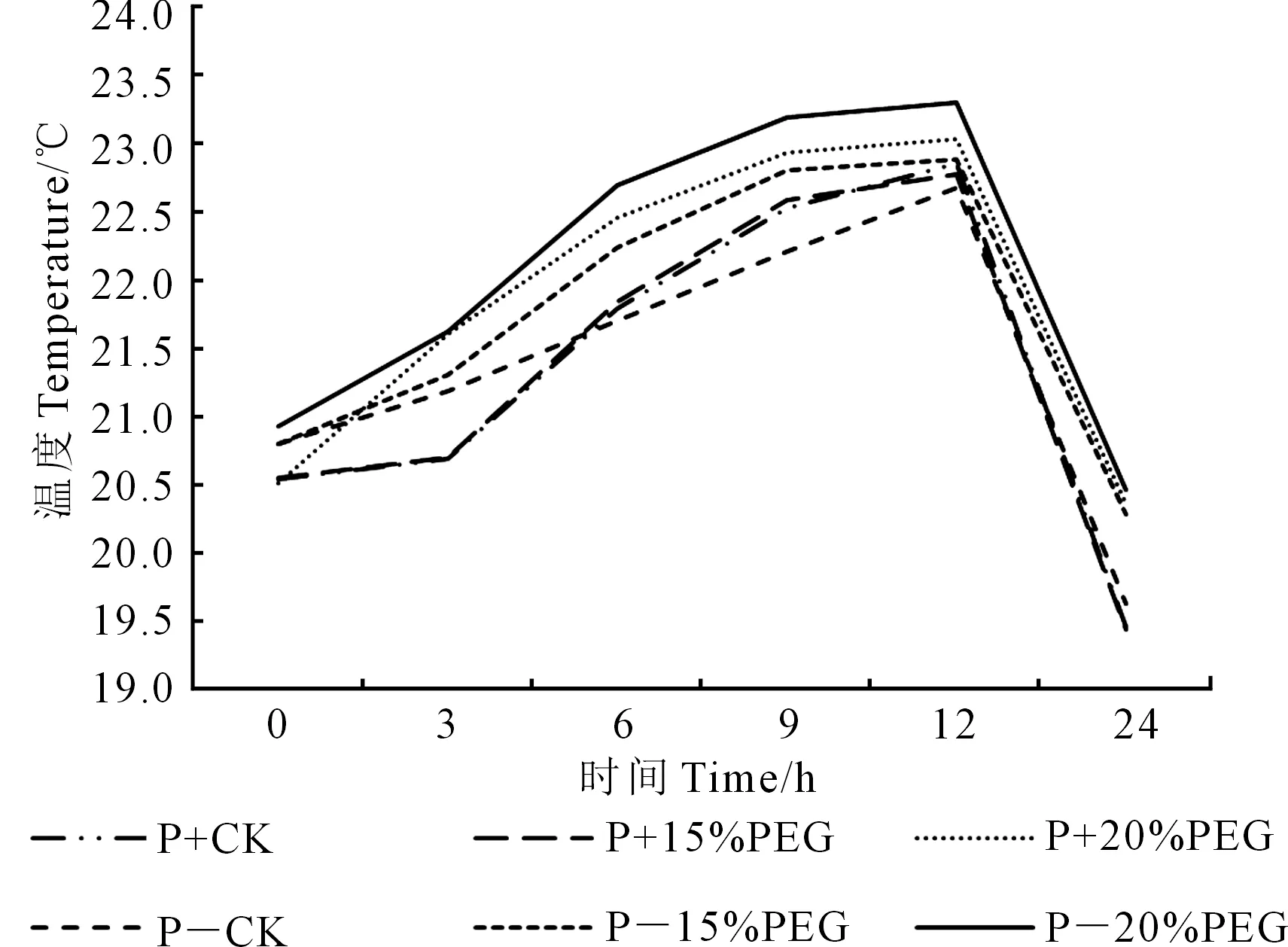
图11 不同浓度PEG胁迫下印度梨形孢对棉花叶片温度变化的影响Fig.11 Real time leaf temperature of cotton plants inoculated with Piriformospora indica under different concentrations of PEG stress
3 讨 论
1)光合作用是植物生长过程中固定能量的主要途径[20]。棉花幼苗接种印度梨形孢后,气孔导度增加进而增加了叶片的胞间CO2浓度,净光合作用速率上升,干物质累积加快,体现在作物表型上即株高、茎粗、叶面积等显著增加。这与印度梨形孢促进油菜[11]、芝麻[18]、玉米[21]、水稻[10]等作物生长的研究结果一致。
2)植物遭受非生物胁迫后会通过植株表型的可塑性来适应逆境[22-25],干旱胁迫下最主要的应激性反应体现在作物根系上[26-27]。未接菌植株干旱条件下根系根长增加明显,侧根数量无明显增加;接菌植株干旱条件下侧根大量增加,总根长显著增加。相较而言,通过增加侧根的方式增大根表面积和体积具有较多优势:侧根数量越多,根系在土壤中覆盖面积越广,水分来源越丰富;增加侧根数量比延长根长吸收水分时运输路径短、速度快;长时间干旱时根系细胞凋亡,根系过长易脱落[26]。发达的根系能促进植物生长并提高其抗逆性[28]。接种印度梨形孢后总根长、根表面积、根体积、根尖数增加,有利于植株吸收水分和营养物质,促进生长,这可能也是接菌植株具有更强抗旱性的一个因素。
3)棉花遭受干旱胁迫后,植株体内水平衡失调[29],细胞内水势降低[30],叶片萎蔫下垂,自然干旱和PEG生理干旱结果一致。水分是植株体内多种代谢反应的必要条件,对植株的正常生长意义重大[29]。接种印度梨形孢植株在干旱条件下能减缓叶片失水,保持叶片外部正常形态和内部正常代谢反应,这一点与光谱参数中水分相关波段结果一致。叶片是植物光合作用、蒸腾作用等重要生理代谢反应的场所,叶片的降温能力与作物的抗逆性高度相关[31]。叶温不仅与环境相关,也受叶片辐射吸收率、气孔、叶偏转角、水分分布等因素影响[32]。叶片降温的主要方式为蒸腾作用,但此过程需要大量的水分。在干旱条件下,叶片水分减少引发气孔关闭,叶温上升[31]。接种印度梨形孢叶片本身的气孔导度升高,并且能维持较高的叶片含水量,具有良好的降温方式。在15%和20%PEG生理干旱胁迫下,胁迫0~24 h之间,接种印度梨形孢植株的叶温始终维持在低于未接种植株水平。接种印度梨形孢有助于维持叶片的水分平衡和温度稳定,保持正常的生理代谢,是诱导提高棉花抗旱性的重要途径。
4)MDA是植物细胞膜过氧化作用的产物之一,是评价植物细胞膜损伤的重要因素[6-7]。。前人的研究均表明,接种印度梨形孢能显著提高植株体内SOD、POD、CAT等多种氧化保护酶的活性,增强植株的清除活性氧的能力,减缓MDA的累积。本试验中,接种印度梨形孢植株干旱胁迫后MDA含量显著低于不接菌植株。这表明减缓细胞膜在干旱条件下的损伤,是印度梨形孢诱导提高棉花抗旱性的另一个因素。
5)接种印度梨形孢的棉花植株在形态指标上表现出抗旱性的增强,其分子调控机制尚需进一步研究。惠非琼等[33]研究表明,干旱胁迫下,接种印度梨形孢的烟草植株干旱相关蛋白基因RD29A、ERD1、ERD10A、SDIR表达量均显著上调。孙超等[34]的研究结果也表明,接种印度梨形孢能显著提高小白菜中干旱相关蛋白CBLl和RD29A的表达量,进而提高小白菜的抗旱性。因此,印度梨形孢可能是通过调控干旱相关基因表达量来诱导提高作物抗旱性的。但是在棉花中,这一机制尚不清楚,这将是下一步研究的方向。
4 结 论
1)接种印度梨形孢,可显著提高棉花幼苗净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度、蒸腾速率,从而使棉花株高、茎粗和叶面积显著增加,促进棉花幼苗生长。
2)在干旱条件下,接种印度梨形孢可以促进棉花根系生长,显著增加棉花幼苗根尖数,提高棉花幼苗的抗旱性。
3)接种印度梨形孢可以维持叶片在干旱环境下正常的叶温,降低处理前后棉花幼苗的叶温差,保持幼苗叶片的色素含量和含水量,维持正常的生理代谢,提高棉花苗期的抗旱性。
4)接种印度梨形孢可以提高棉花幼苗在干旱环境下清除丙二醛(MDA)的能力,降低对植物细胞的损伤,从而提高棉花苗期的抗旱性。
综上所述,接种印度梨形孢通过增强光合作用和促使根系根系伸长、增粗、增加侧生根数量促进棉花生长,并且通过维持叶片水分和叶片温度保持叶片正常代谢,改变根系结构来诱导提高棉花的抗旱性,对干旱地区棉花的抗旱性研究具有重要意义。

