利用手持技术探究维生素C与补铁片同服促进亚铁吸收的原因
马艳清

摘 要:文章探讨了用氧气传感器和pH传感器检测维生素C对Fe2+的保护机制。该实验操作简便,实验现象较为明显,可用作学生分组探究或教师课堂演示实验。
关键词:维生素C;硫酸亚铁;氧气传感器;pH传感器
一、问题的提出
Fe2+和Fe3+之间的相互转化是苏教版高中化学必修一专题三第二单元的重难点内容。教师在备课时创造情境讲解常常会选择“补铁片”作为载体。“补铁片”的说明书中一般有“维生素C与本品同服,有利于本品吸收”的介绍说明。众所周知,维生素C(Vitamin C,简称Vc)分子式为C6H8O6,是一种很强的抗氧化剂,即还原剂,其分子中的烯二醇基在弱酸性介质中可以将Fe3+还原成Fe2+,反应式为:2 Fe3+ + C6H8O6 = 2 Fe2+ + C6H6O6 +2H+
而补铁片中的铁元素是以亚铁形式存在的,在溶液中易氧化水解,反应式为:4Fe2+ + O2 + 10H2O = 4 Fe(OH)3 +8H+
那么Vc与之同服利于吸收的原因究竟是Vc用于和氧化剂反应还是用于还原三价铁呢?
二、实验过程
(一)仪器与试剂
仪器:威尼尔数据采集器(LabQuest2),氧气传感器,pH传感器,250mL四颈烧瓶,烧杯,量筒(50mL、100mL),电子天平,胶头滴管、单孔橡胶塞,铁架台,磁力搅拌器,洗瓶,药匙,止水夹,研钵
试剂:蒸馏水,FeSO4·7H2O,维生素C片(东北制药集团沈阳第一制药有限公司,100mg/片)
(二)实验装置及步骤
由于该实验最终拟用于高中课堂实验,因此本实验的进行均在室温下进行,同时维生素C片也使用了日常药店随手可以买到的。
实验一:硫酸亚铁溶于水
(1)稱量2.0g FeSO4·7H2O装好待用。
(2)组装实验仪器(如图1)并检查装置气密性。
(3)将氧气传感器、pH传感器与数据采集器相连,打开软件。
(4)量取150mL蒸馏水倒入四颈烧瓶中,启动软件开始收集数据。
(5)将FeSO4·7H2O迅速倒入四颈烧瓶中,同时打开磁力搅拌器调整转速为10,加快晶体溶解。观察并记录现象,收集数据。
实验二:Vc片溶于水
取10片Vc药品称量,记录总质量。将其研磨成粉末,取两片质量的Vc粉末装好待用。剩余步骤同实验一
实验三:硫酸亚铁、Vc片共同溶于水
(1)称量2.0g FeSO4·7H2O装好待用。取10片Vc药品称量,记录总质量。将其研磨成粉末,取两片质量的Vc粉末装好待用。
(2)剩余步骤同实验一。
(3)约15s后Vc粉末完全溶解,继续将FeSO4·7H2O迅速倒入四颈烧瓶中,观察并记录现象,继续收集数据。
三、实验结果与分析
(一)实验一、实验二和实验三结果
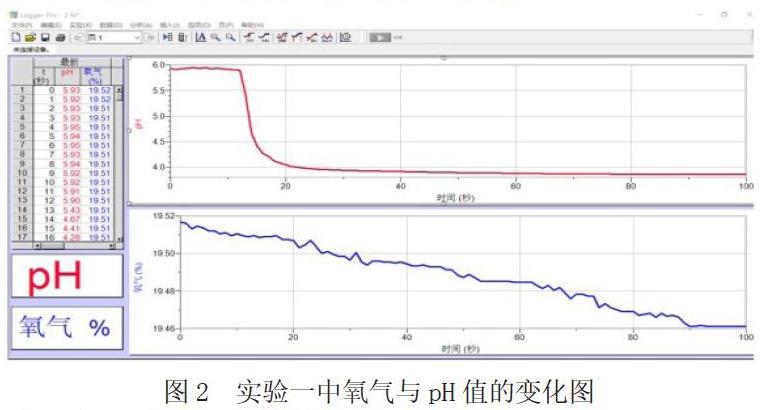
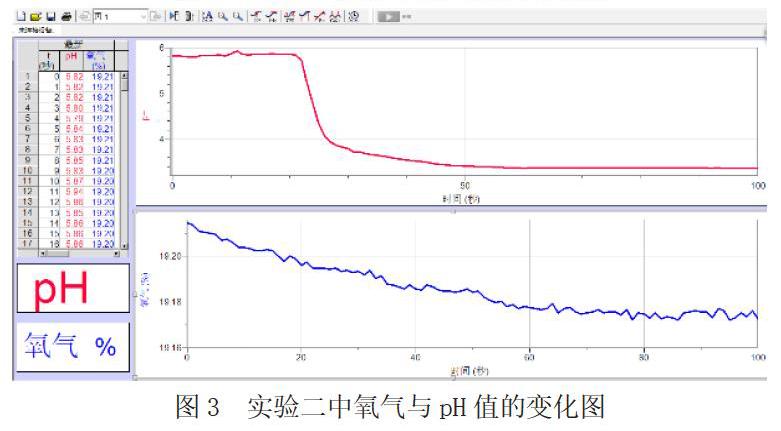
根据实验一、二的图像可以发现,硫酸亚铁溶液、Vc溶液在不断消耗四颈烧瓶中的氧气,pH在不断下降。且在实验一中,加入FeSO4·7H2O后,大约5s溶液逐渐开始淡黄色,随着时间的推移淡黄色逐渐加深。而根据实验三的图像发现,在加入FeSO4·7H2O后,根据斜率观察到氧气含量减少的速率稍有下降,同时溶液颜色和pH值没有任何变化。
根据以上的实验结果,可以得出:Vc与Fe2+共同存在时,会与氧气发生反应起到保护Fe2+,但与此同时,仍会有部分Fe2+被氧化为Fe3+,Vc也会将这部分被氧化的Fe2+还原。
四、实验结论与展望
Vc与补铁片同服利于吸收的原因是Vc用于和氧化剂反应并且同时用于还原三价铁,不单纯是其中任何一个原因。本实验原理较为简单,反应快速且操作便捷,利于高中生在学习相关内容时更加易于掌握知识和基本技能,同时激发学生的学习兴趣、培养学生的核心素养。
参考文献
[1] 张小丹,马婧,朱朝娟,孔玲.手持技术在高中化学探究实验中的应用——基于Fe2+——邻二氮菲显色法测定市售饮料中的Vc[J].西南师范大学学报(自然科学版),2018,43(05):171-175.
[2] 朱成东,马善恒,熊言林.运用手持技术探究氢氧化亚铁难以制备的原因[J].化学教育(中英文),2017,38(13):75-77.
[3] 后勇军.Fe(OH)2易被氧化的实验探究[J].中学化学教学参考,2015(13):60.

