浅谈高考工艺流程题的三点注意事项
■
高考化学试题中工艺流程题是主流试题,因其命题素材选择余地大,可设问的点很多,考查综合能力方便,试题显得很是变化多端,针对这种情况,我们在做此类试题时应注意以下三个方面的问题。
一、“磨刀不误砍柴工”,仔细审题
1.认真细致地发现信息:读题时应对题目提供的材料包括物质的成分、杂质的类型和流程中的分支信息等一些关键之处详加标注,不轻易放过细节。
2.准确全面地理解信息:仔细领会题目条件及考查的知识点,对于那些容易出错的关键词如“刚好”“恰好”等应特别注意。
3.反复深入地挖掘信息:题目既要深入推敲,综合全局,又需反复推敲,从题目的字里行间挖掘出一些隐含的信息。
二、“解剖麻雀”,各个击破
此类试题各个问题之间很少具有大的关联性,基本上是相互独立的。所以可根据每一个独立问题遵循由简单到繁杂或由熟悉到陌生的顺序,逐个突破。对于综合性问题,需要运用前后分析法和综合法。前后分析法就是从已经获得的答案出发,追寻待求问题与之关联的信息,直至找出答案。综合法是“解剖麻雀”的逆向思维方法,它是先将各个单独的问题前后关系明确后,再综合获解的策略。
三、选择技巧,快速解答
很多需要用文字做答的填空题,往往具有固定模板,此时可以套用模板回答,会省去很多时间。对于有些模糊的东西,可模糊回答。比如回答乙烯通入酸性高锰酸钾溶液中的现象,可以写成酸性高锰酸钾溶液褪色(一是回避了高锰酸钾的颜色;二是从原题中抄录一段文字,会看起来文字精练又不失文采)。
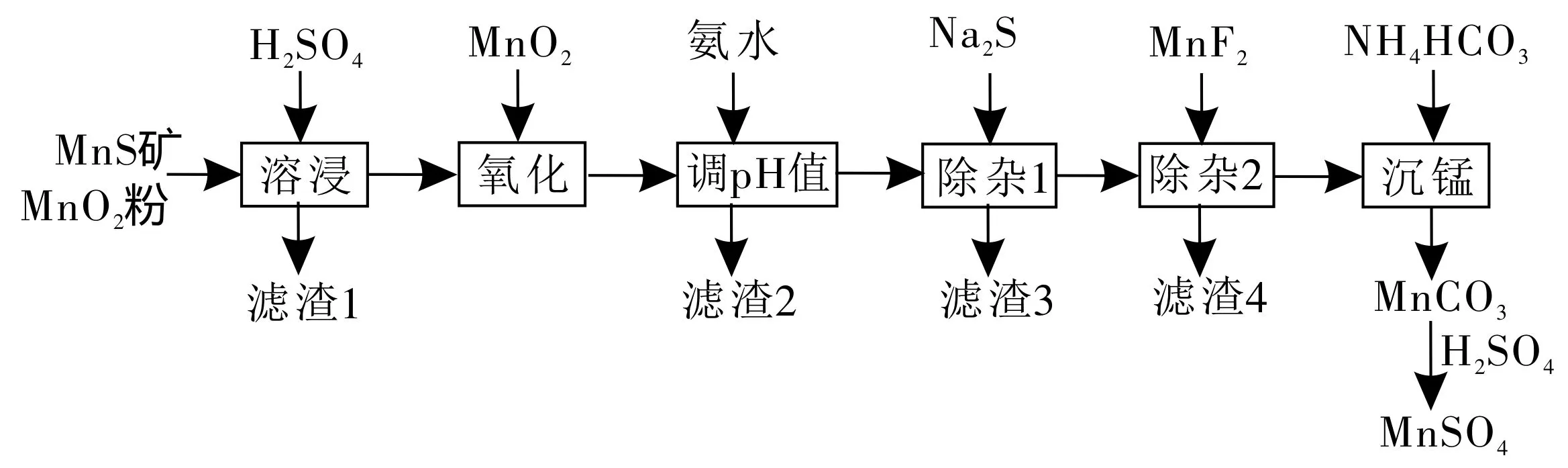
例题(2019年全国卷Ⅲ·节选)高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺流程如下。请回答下列问题:
相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH值范围如表1:
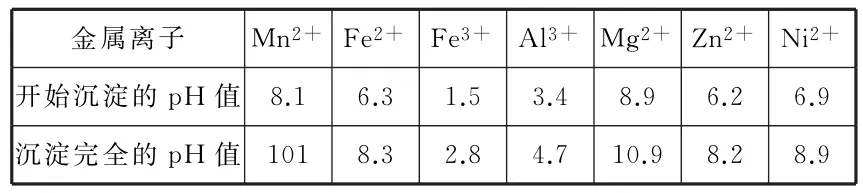
表1
(1)滤渣1含有S和___,写出溶浸中MnO2与MnS反应的化学方程式:___。
(2)调pH值除铁和铝,溶液的pH值范围应调节为___~6。
(3)除杂2的目的是生成MgF2沉淀以除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是___。
解:(1)仔细研读试题,可知溶浸后获得了滤渣1。那么,滤渣的来源有两种情况,一是与硫酸不反应的又不溶于水的物质,二是原有物质之间反应生成的新物质。题目中暗含“滤渣1含有S”,提醒我们单质S的来源。原物质是MnS矿,非单质S,既然如此,S则来自于MnS中的S。根据流程可知MnO2为氧化剂。所以化学方程式为MnO2+MnS+2H2SO4══2MnSO4+S+2H2O。
(2)本问是沉淀铁和铝,自然它们沉淀的pH值由信息来确定,与上述工艺流程没有多大关系,这个方法就是各个击破法。由表中数据知pH值在4.7时,Fe3+和Al3+沉淀完全,所以pH值应控制在4.7~6。
(3)“酸度高”“Mg2+沉淀不完全”,意味着平衡向着Mg(OH)2溶解的方向移动。平衡移动则有固定的回答套路:由于某某增大或过量,导致平衡向左或右移动,从而导致某某结果。因此,答案为由HFH++F-知,酸度过大,F-浓度减小,使得MgF2Mg2++2F-平衡向沉淀溶解的方向移动,Mg2+沉淀不完全。

