日本七鳃鳗毒素肽rLj-RGD3突变体rLj-115基因的克隆与表达
李姿其,衣龙达,米梓萌,于 卓,周沫含,王继红,肖 蓉
( 辽宁师范大学 生命科学学院,辽宁 大连 116081 )
RGD毒素肽是一类具有RGD(Arg-Gly-Asp三肽序列)特征性模体的活性肽,最初发现于蛇毒中,被称为去整合素。随着研究的深入,科研人员在一些吸血类生物诸如蜱、牛虻、水蛭等的唾液腺中也同样发现了这种以RGD模体为特征的毒素肽[1-5]。而rLj-RGD3是本课题组在国际上率先发现的来源于日本七鳃鳗(Lampetrajaponica)口腔腺的RGD肽,其一级结构包含3个RGD序列[6]。据文献报道,肿瘤细胞膜表面的整合素与正常细胞相比具有表达上调的特点,而这种高表达的整合素与肿瘤细胞细胞外基质蛋白的RGD序列结合,能够使肿瘤微环境中生长因子的信号从细胞外向细胞内传递,进而促进肿瘤细胞增殖及迁移等活动。当外源性RGD毒素肽进入到肿瘤组织细胞附近时,由于其序列上具有与细胞外基质蛋白相同的RGD模体,故其能竞争性地与肿瘤细胞表面整合素结合,从而对整合素介导的信号通路起到抑制作用,进而肿瘤细胞的增殖、迁移和侵袭也受到抑制,最终诱导肿瘤细胞发生凋亡。因此RGD毒素肽具有抑制血管新生、抑制肿瘤生长的功能[7-10]。本课题组的前期工作证实rLj-RGD3也同样具有上述功能[11-16]。
由于Lj-RGD3含有3个RGD模体,其结构上的这几个RGD是否都是其功能所必须,是否以协同效应累加其功能,还是以某个RGD为功能关键模体,这些问题引起了笔者的关注。为此,笔者进行了一系列的突变体构建,本研究所涉及的是Lj-RGD3的第Ⅰ及第Ⅱ位RGD同时缺失的突变体的分子克隆与诱导表达,并将获得突变体命名为rLj-115。rLj-115的获得将对后续关于Lj-RGD3的结构与功能的研究提供物质基础,并且也可为以rLj-RGD3为原型的抗血栓、抗肿瘤生物制药研究提供更多可供优化筛选的候选素材。
1 材料与方法
1.1 材料与试剂
1.1.1 试验材料
质粒pET23b、大肠杆菌(Eascherichiacoli)BL21为本实验室保存。
1.1.2 试剂
质粒提取试剂盒、DNA连接试剂盒、IPTG(宝生物大连公司);Amp氨苄青霉素(哈药集团);咪唑、Tricine、蛋白质marker、CaCl2(Amresco公司)。组氨酸亲和层析柱(His·Bind Column,Novagen公司)。
1.1.3 仪器
气浴恒温振荡器(Thermo);漩涡振荡器(Scientific Industries),低温高速离心机(Beckman Coulter);高温高压灭菌锅(博讯);分光光度计(Eppendorf)。
1.2 试验方法
1.2.1 突变基因全序列合成
由于Lj-RGD3含有大量重复序列,无法对其基因进行定点突变,故采用人工合成方法获得目的基因(宝生物大连公司完成)。PCR扩增时引入NdeⅠ和HindⅢ双酶切位点。
1.2.2 阳性重组质粒构建与鉴定
1.2.2.1 阳性重组质粒构建
利用双酶切法将合成后的rLj-115基因连接到pET23b质粒上,双酶切的酶切位点为NdeⅠ和HindⅢ。酶切反应体系见表1及表2。

表1 HindⅢ的酶切反应体系

表2 NdeⅠ的20 μL酶切反应体系
以3倍体积的无水乙醇沉淀回收双酶切后的DNA片段与pET23b载体,以T4 DNA连接酶进行16 ℃的过夜连接(表3)。

表3 20 μL连接酶反应体系
1.2.2.2 阳性重组质粒鉴定
采用CaCl2法将重组质粒转化入大肠杆菌BL21中:宿主菌大肠杆菌BL21接种于20 mL Amp-LB中培养过夜,次日将部分菌液移至50 mL LB培养液中于37 ℃下继续培养至600 nm吸光值达到0.2~0.3。培养物置于冰上10 min,5000 r/min,4 ℃离心10 min。弃上清液,倒置离心管1 min,加入5 mL冰预冷的0.1 mol/L CaCl2溶液致敏并悬浮细胞,冰上10 min。5000 r/min 4 ℃离心10 min回收细胞,弃上清液,每25 mL的原培养物再加入2 mL冰冷的0.1 mol/L CaCl2溶液,悬浮细胞并置于冰上3 h,每份200 μL分装细胞。加10 μL含40 ng的DNA溶液至200 μL感受态细胞中温和混匀,于42 ℃热休克90 s后迅速放回冰中,将细胞冷却1~2 min后,加入800 μL LB(Amp-)培养基,37 ℃ 225 r/min摇荡培养细菌45~90 min。取100 μL转化产物铺于90 mm的LB(Amp+)琼脂平板上,室温下放置20~30 min后,倒置平皿于37 ℃培养12~16 h,待LB(Amp+)琼脂平板上长出菌落后即可进行阳性转化子的筛选鉴定。
采用灭菌牙签挑取转化菌于10 μL双蒸水中并煮沸10 min作为PCR模板,运用通用T7引物PCR法进行鉴定。T7通用引物序列为:P1-XXaaattaatacgactcactata,P2-XXgctagttattgctcagcggtg。DNA测序由宝生物大连公司完成。
1.2.3 重组蛋白rLj-115的诱导表达与纯化
1.2.3.1 重组蛋白rLj-115的诱导表达
挑取阳性重组单菌落接种于含氨苄的LB培养基中,于37 ℃培养至600 nm吸光值为0.4~0.6时,达到对数生长期。加IPTG至终浓度1 mmol/L,分别进行3、4、5 h的37 ℃诱导表达与30 ℃的低温过夜诱导表达。取上述培养液5000 r/min离心5 min,于沉淀中加100 μL的上样缓冲液100 ℃加热3 min, 上样行Tricine-SDS电泳。
1.2.3.2 重组蛋白rLj-115的纯化
由于rLj-115含有组氨酸标签,故可采用组氨酸亲和层析柱进行纯化。组氨酸标签可与固相化于Ni-NTA His·Bind树脂上的Ni2+结合,杂蛋白被洗掉后,目标蛋白可通过浓度逐渐提高的咪唑洗脱而重新获得。采用Trincine SDS-PAGE法电泳,采用考马斯亮蓝标准曲线法进行浓度测定。
1.2.4 对ECV304增殖抑制作用的测定
将ECV304接种于96孔板,于M199培养液中培养至对数生长期。加入梯度浓度的 rLj-115继续培养24 h后加入MTT溶液继续培养4 h,吸去培养液并加入等体积的二甲基亚砜,摇床振荡使结晶充分溶解,使用酶标仪于490 nm下测定吸光度。计算细胞杀伤率:
R=(C-T)/C×100%
式中,R为细胞增殖抑制率,C为空白对照组的吸光度,T为加药组的吸光度。
用SPSS软件统计数据,n=3。
2 结 果
2.1 Lj-115突变方案及基因全序列合成
Lj-RGD3的一级结构由118个氨基酸组成,含有3个RGD模体且富含组氨酸。将Lj-RGD3前两个RGD模体缺失、保留第3个RGD的突变体命名为Lj-115(图1),其基因序列采用人工合成(宝生物公司完成)方法获得。

图1 源于Lj-RGD3的突变体Lj-115的基因序列及其氨基酸序列
2.2 阳性重组质粒鉴定
Lj-115的333 bp基因片段插入pET23b质粒后,T7通用引物的PCR扩增产物片段长度应该为526 bp,而pET23b空质粒因没有外源基因片段的插入,其T7通用引物PCR扩增产物仅有193 bp,故可依据T7通用引物的结果进行阳性重组子的判断。试验结果显示,重组菌为阳性克隆菌(图2)。
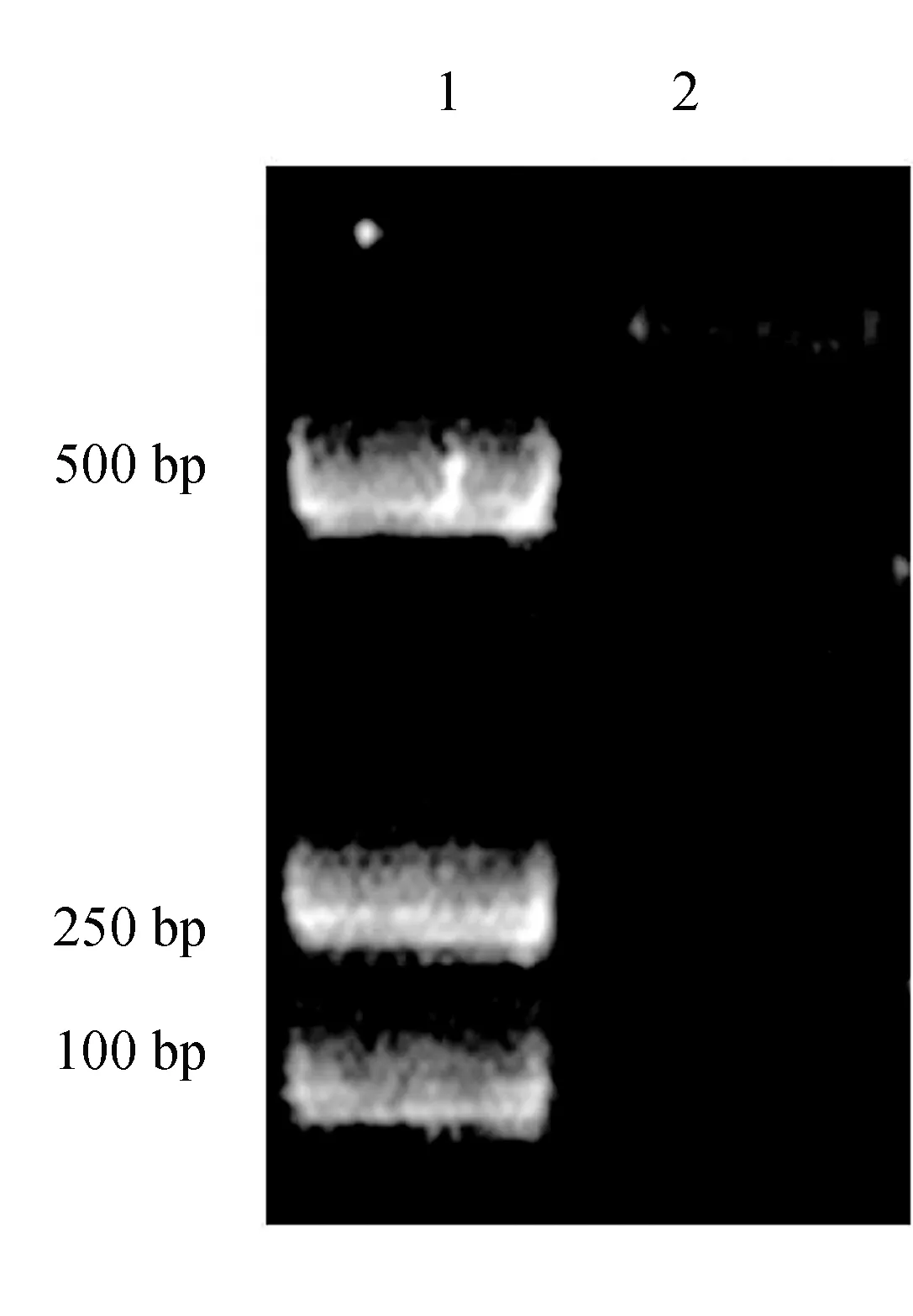
图2 利用T7通用引物对阳性重组子进行的PCR鉴定1.DL2000 DNA Marker(Takara); 2.阳性重组子.
2.3 阳性重组质粒测序鉴定
重组质粒测序结果见图3,表明构建序列完全正确,Lj-115基因克隆成功完成。
2.4 重组蛋白rLj-115的诱导表达和纯化
通过CaCl2转化法将pET23b-115转入BL21表达菌内,通过终浓度1 mmol/L的IPTG诱导,在37 ℃ 3~5 h诱导及30 ℃低温诱导表达过夜条件下都成功诱导表达了基因重组肽rLj-115。结果表明,37 ℃诱导表达4~5 h蛋白产生量最高,为最佳诱导条件(图4)。
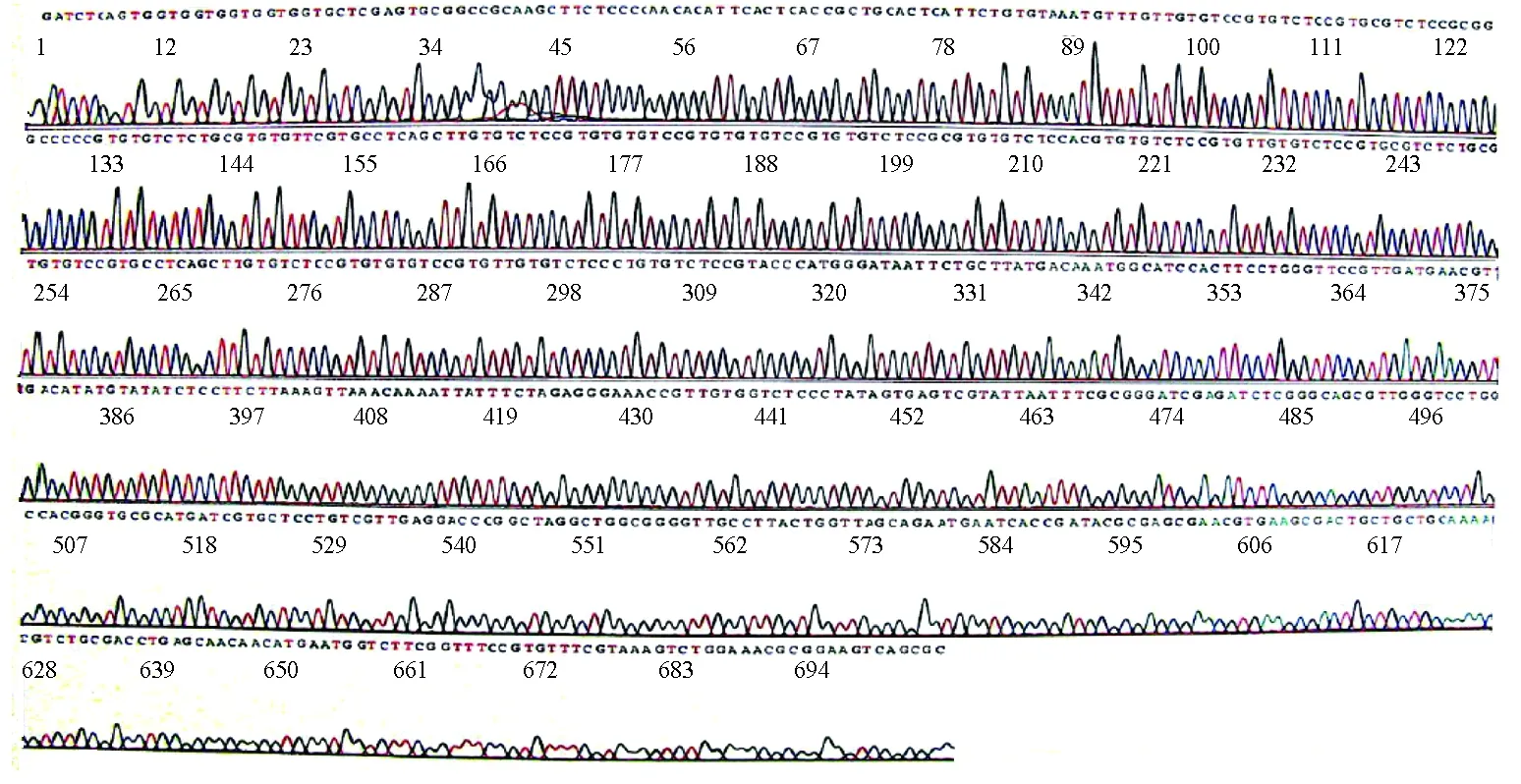
图3 pET23b-115重组质粒测序图
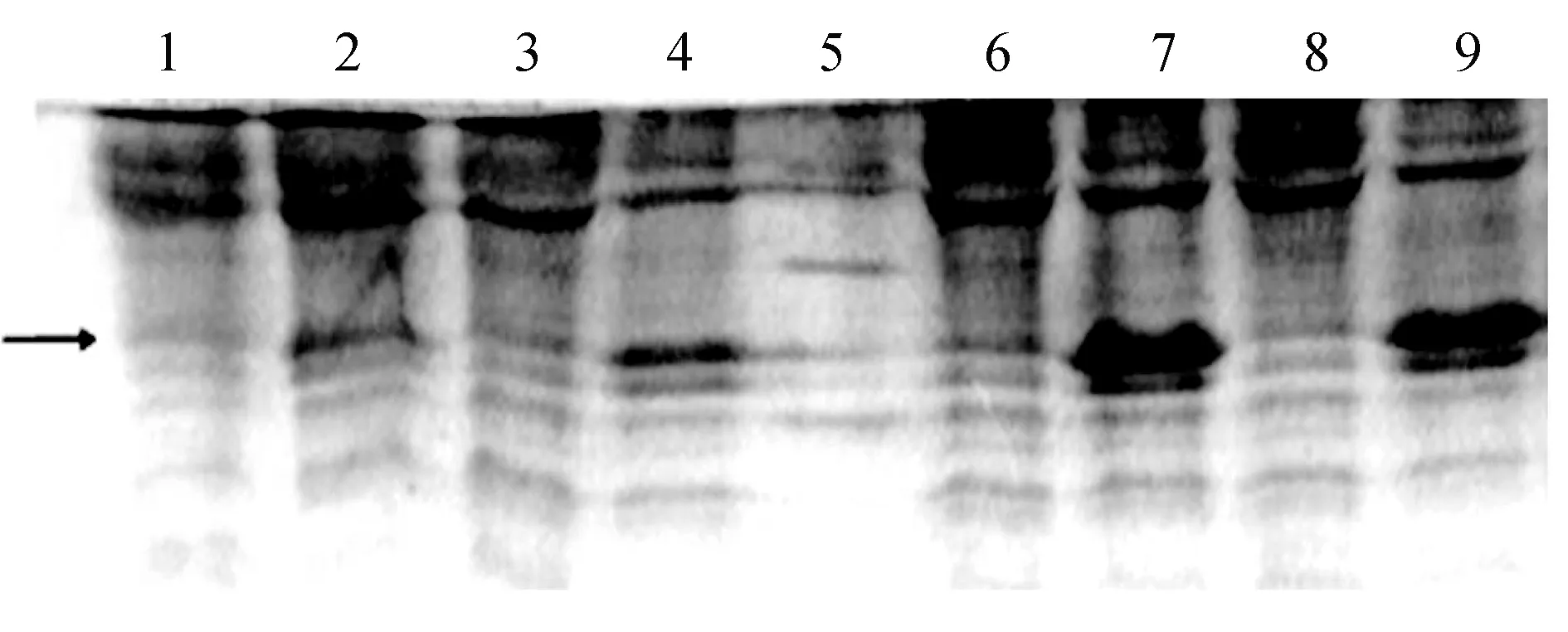
图4 突变体rLj-115 BL21/pET23b菌体的IPTG诱导的Tricine SDS-PAGE电泳图1.30 ℃过夜未诱导; 2.30 ℃过夜诱导; 3.37 ℃ 3 h未诱导; 4.37 ℃诱导3 h; 5.MAKER; 6.37 ℃未诱导培养4 h; 7.37 ℃诱导培养4 h; 8.37 ℃未诱导培养5 h; 9.37 ℃诱导培养5 h. 目的条带以箭头标示.
经过菌体收集、超声破碎和Ni2+亲和层析纯化等试验步骤,获得了纯化的基因重组肽rLj-115。Tricine-SDS-PAGE电泳检测结果显示,rLj-115的分子量为13.7 ku,电泳迁移率由于序列带有大量碱性氨基酸,所以比预期滞后。rLj-115纯度超过98%(图5)。通过Bradford法测定蛋白质量浓度为3 mg/mL。
2.5 rLj-115对ECV304细胞增殖的抑制作用
MTT能还原存在于活细胞线粒体中的琥珀酸脱氢酶从而形成甲瓒,其在呈蓝紫色沉淀于细胞中。死细胞由于酶的失活而无此现象。所以形成的蓝紫色甲瓒结晶的量与活细胞的数目成正比。rLj-115作用于ECV304细胞的结果显示,其可以剂量依赖方式抑制ECV304细胞的增殖(图6),其抑制细胞增殖的半数抑制浓度为0.15 μmol/L,说明重组表达的蛋白具有抑制血管新生的活性,为后续试验奠定了物质基础。
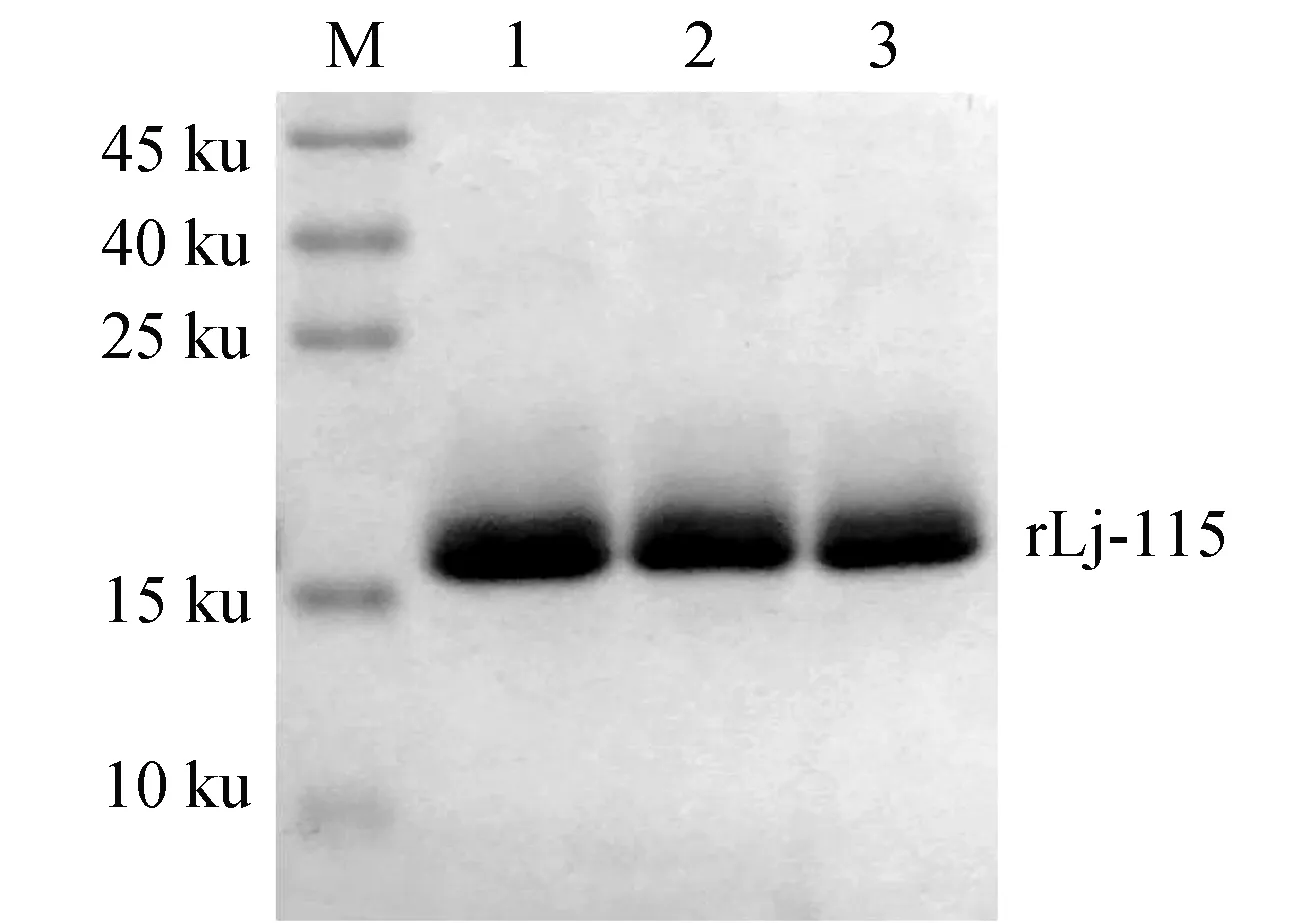
图5 镍离子亲和层析纯化得到rLj-115肽的Tricine-SDS-PAGE电泳1.Marker; 2~4.rLj-115纯化蛋白.
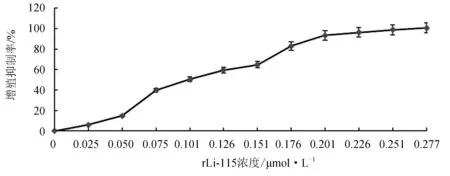
图6 rLj-115对人脐静脉内皮细胞ECV304增殖的抑制作用
3 讨 论
3.1 rLj-RGD突变体设计
RGD(Arg-Gly-Asp三肽序列)毒素肽是一类具有RGD特征性模体的活性肽,最初发现于蛇类唾液腺分泌物中。蛇类体内发现的RGD肽称为去整合素。此外在水蛭、牛虻、虱等吸血类生物唾液腺中液也发现这种特征蛋白。rLj-RGD3是本实验室在七鳃鳗口腔腺cDNA文库中发现,并成功进行原核表达的可溶性RGD活性肽,结构中包含3个RGD模体。在之前的研究中,rLj-RGD3显示出具有抑制血小板聚集、体内外抑制多种肿瘤(乳腺癌、卵巢癌、胰腺癌、喉癌)、体外抑制内皮细胞和体内抑制血管新生的功能[6,11-16]。由于rLj-RGD3具有3个RGD模体,因此其结构与功能的关系引起了研究者的关注。课题组设计了一系列的结构突变体,如保留第1个RGD模体的和保留第2个RGD模体的突变体,而本研究的rLj-115是保留第3个RGD模体的突变体。这几个突变体获得后,本课题组将对其进行全面的功能比较,所以突变体纯化蛋白的获得成为关键。
3.2 突变体基因的人工合成
在进行重组蛋白基因克隆与表达时,在未知其蛋白mRNA全长序列的情况下,通常采用5′-Race及3′-Race的方法钓取mRNA,然后采用RT-PCR方法获得蛋白的双链DNA基因并进行质粒构建,而相关突变体的构建往往是直接通过点突变完成[17-18]。本课题的Lj-RGD3野生型基因就是通过mRNA的RT-PCR方法获得[6]。然而,在设计突变体克隆方案时发现,由于Lj-RGD3基因具有大量重复序列,无法采用定点突变完成。但前期本课题组已知Lj-RGD3的基因序列,故可在基因突变方案形成后采用全突变基因序列合成获得目的基因。由试验结果来看,合成基因构建成功,所表达的蛋白具有活性。这说明完全可以通过基因合成的方式进行重组蛋白的质粒构建。
3.2 突变体rLj-115的电泳迁移率及活性
突变体rLj-115含有大量碱性氨基酸,其等电点为10,故电泳迁移位置比预期滞后,这种现象在其野生型rLj-RGD3也同样存在。MTT试验结果表明,rLj-115抑制脐静脉内皮细胞增殖的半数抑制浓度为0.15 μmol/L,而野生型rLj-RGD3作用于ECV304的半数抑制浓度为0.889 μmol/L[6],rLj-115的活性是rLj-RGD3的6倍,这表明rLj-RGD3并未因3个RGD模体的同时存在而活性更强,这为后续进一步关于rLj-RGD3结构与功能的研究提供了试验基础。
4 结 论
本试验成功地对rLj-RGD3的第Ⅰ、Ⅱ位RGD模体进行了缺失突变,获得了仅含有第Ⅲ位RGD模体的rLj-115纯化蛋白,并且rLj-115具有高于野生型6倍的生物活性,这为进一步的rLj-RGD3构效关系测定奠定了物质基础,也为以rLj-RGD3为原型的抗肿瘤药物优化筛选提供了候选素材。
——一道江苏高考题的奥秘解读和拓展

