白囊耙齿菌多糖结构及抗肾小球系膜细胞的增殖活性研究
高苗苗, 李士伟, 祝洪艳*,徐多多*
1吉林农业大学 中药材学院,长春130118;2长春中医药大学 吉林省人参研究院,长春130117
多糖具有抗肿瘤、抗病毒、抗凝血、降血糖、免疫调节等活性[1-4],且作为药物毒副作用低,不良反应少,已成为天然药物及保健品研发中的重要组成部分。白囊耙齿菌 (以下简称耙齿菌) 是一种重要的药用真菌,属于担子纲非褶菌目多孔菌科耙齿菌属,又被叫做白囊孔、耙齿菌。在我国白囊耙齿菌主要分布于吉林省的长白山、黑龙江、河北等省区。耙齿菌发酵物的活性成分为多糖类物质。近年来研究表明,耙齿菌多糖具有抗肿瘤、抗炎等活性[5]。但是,国内外对耙齿菌的研究很少,且多糖类物质的分子量较大,结构非常复杂,因此对耙齿菌多糖的研究相对滞后。本实验通过分离制备耙齿菌发酵物中不同的多糖片段,得到两种均一多糖,表征其结构。为耙齿菌多糖结构的系统研究和明确其结构与功能之间的联系提供了科学依据。耙齿菌多糖粗提取物是吉林省多个药品生产企业生产的品种--益肾康胶囊的原料,主要用于治疗肾小球肾炎引起腰痛、浮肿、尿少、血压升高等症。在民间,耙齿菌多糖治疗肾炎的应用非常的广泛。虽然在临床上治疗慢性肾小球肾炎具有良好的应用基础,但治疗肾炎的活性成分及机制却尚不清楚,相关的国内外对此方面的研究报道也很少,因此,耙齿菌治疗肾炎缺乏相应的理论支撑,这一现状,将会严重的限制耙齿菌的在临床的合理使用,益肾康胶囊也难以确定合理的工艺,无法建立有效的质量控制方法,难以保证其安全性及有效性。为了明确耙齿菌治疗慢性肾小球肾炎的有效成分,我们以在肾炎疾病中的发生发展中起到关键作用的肾小球系膜细胞(GMC)作为筛选模型,观察耙齿菌多糖对GMC的异常增殖及FN,LN等相关因子释放的影响,筛选出活性多糖,为多糖治疗慢性肾炎的构效关系这一科学问题,提供有益的借鉴和依据。
1 材料及仪器
耙齿菌固体发酵物,由通化吉通药业股份有限公司提供。肾小球系膜细胞(ATCC);PRMI1640培养基(美国 hyclone 公司);717型阴离子交换树脂、732型阳离子交换树脂(上海绿宝树脂厂);脂多糖(美国sigma公司);葡萄糖等单糖标品(美国Sigma公司);噻唑蓝(MTT)(上海碧云天生物试剂有限公司);胎牛血清FBS(Gibco);苯酚、浓硫酸、二甲基亚砜、氢氧化钠,等均为国产分析纯。
酶标仪 MK3(Thermo(上海)仪器有限公司);N1000旋转蒸发仪(日本东京理化仪器有限公司);6890N-5973MSD气-质联用仪、1100-6320 MS液-质联用仪(美国Agilent公司);TDL-5-A离心机(上海安亭科学仪器厂)。
2 方法
2.1 耙齿菌粗多糖的提取
采用多糖传统的提取方法--水提醇沉法。耙齿菌发酵物,加水加热使溶解,滤除不溶物,浓缩至一定体积,加入无水乙醇,不断搅拌,至乙醇浓度为80%,离心,沉淀挥干乙醇后加水溶解。采用Sevage法除去蛋白,离心除去沉淀,上清回收,冻干,即得耙齿菌粗多糖(PC)。
2.2 PC的分离纯化
称取粗多糖30 g,用150 mL水溶解,通过717+732混合床离子交换树脂纯化,收集8个柱体积水洗脱液,浓缩至小体积,干燥,得到PCP。通过 SePhadex G-50凝胶柱分离PCP,分别称取葡萄糖和蓝色葡聚糖对照品10 mg,混合加5 mL蒸馏水溶解,经过上述中压柱,流速为1 mL/min,每管收集10 mL,隔管以苯酚-硫酸法监测中性糖,以收集的洗脱液的管数为横坐标,对应的吸光度值作为纵坐标绘制洗脱图,测定内水(Ve)和外水体积(VO)。称取PCP20 mg,用5 mL水溶解,经过上述中压柱,流动相为水,每管收集10 mL。隔管以苯酚-硫酸法监测中性糖,以收集的洗脱液的管数为横坐标,对应的吸光度值作为纵坐标绘制洗脱图。按照洗脱图合并组分,分别得到PCP-1和PCP-2。
2.3 PCP-1、PCP-2理化性质的测定
采用苯酚—硫酸法[6]测定总糖含量,间羟基联苯法[7]测定酸性糖含量,BCA法[8]测定蛋白含量。
PMP柱前衍生化HPLC法[9]分析组成糖。色谱条件: C18色谱柱(5 μm,250 × 4.6 mm);柱温40 ℃;检测波长250 nm;流速0.8 mL/min;流动相A为0.025 mol/L磷酸盐缓冲溶液(KH2PO4-NaOH,PH6.8)-乙腈(85∶15),流动相B为0.025 mol/L磷酸盐缓冲溶(KH2PO4-NaOH,PH6.8)-乙腈(60∶40)。
2.4 PCP-1、PCP-2分子量测定
采用高效凝胶分子排阻色谱法[10]测定PCP-1、PCP-2分子量。
色谱条件:色谱柱为Shodex OhPak SB-802.5 HQ(8 mm×300 mm)凝胶柱,流动相为0.7%硫酸钠溶液,柱温35 ℃,流速为0.5 mL/min,进样量20 μL,示差折光检测器。
2.5 耙齿菌多糖PCP-1和PCP-2的化学结构的研究
2.5.1 PCP-1、PCP-2的IR分析
IR是多糖结构分析的一种辅助手段,主要用于确定苷键的构型,观察特征的官能团。PCP-1、PCP-2经KBr压片,在4 000~400 cm-1范围内进行红外光谱扫描,得IR 光谱图。
2.5.2 甲基化
甲基化是多糖结构研究中非常重要的一种手段。它可以提供多种信息,如糖残基的种类及各糖残基的数目。本实验采用改良的Hakomori法,该方法以DMSO 为溶剂,用DMSO 与NaOH的反应产物甲基亚磺酰负离子 CH3SOCH2-为强碱,因CH3SOCH2-易与氧、水或二氧化碳反应而降解,所以整个过程应在氮气保护和无水条件下进行。将样品PCP-1和PCP-2进行甲基化[11]。经甲基化,水解还原乙酰化,得到部分甲基化的糖醇乙酸酯衍生物,进行GC-MS分析。
分析条件:DB-1 MS石英毛细管柱(30 m×0.32 mm),进样口温度为200 ℃,离子源温度为250 ℃。升温程序:140 ℃保持7.5 min,以2 ℃/min程序升温至250 ℃,保持20 min。流速为1 mL/min,进样量1 μL,分流比为50∶1。
2.6 耙齿菌多糖抗GMC增殖活性
2.6.1 建立LPS诱导GMC细胞增殖的模型
取GMC细胞种于96孔培养板中,调细胞浓度为1×105个/mL,接种24 h后,细胞贴壁,此时将培养液吸出,用无血清的培养基继续培养24 h,使细胞同步于G0期。采用不同浓度的LPS培养不同的时间考察细胞的增殖。按照以下方式分组:空白组; LPS(10、20、30 μg/mL)分别培养12和24 h;采用噻唑蓝(methyl thiazolyl tetrazolium,MTT)比色法检测细胞增殖情况,在酶标仪上测定 490 nm 处的吸收度值 A。
2.6.2 PCP-1、PCP-2对LPS诱导的GMC细胞增殖的影响
取对数生长期细胞,以1.0×104个/mL的浓度,分别接种于96孔板,培养12 h后弃去培养基,各孔加入无血清培养基同步培养24 h。培养基弃去,将细胞分为空白组、模型组、PCP-1组、PCP-2组。10 μg/mL LPS、10 μg/mL LPS+PCP-1(10、50、100 μg/mL)组、10 μg/mL LPS+PCP-2(10、50、100 μg/mL)组 (均以无血清的RAMI-1640配制)。培养24 h后进行MTT法测定。
2.6.3 活性多糖对GMC增殖相关因子的影响
ELISA 法测定各组细胞上清液中 LN、 FN蛋白,将GMC细胞传代于5瓶25T透气培养瓶后用含10%血清培养液5 mL培养24 h,弃去培养液用不含血清培养基培养24 h。将培养瓶分为5组,分别为空白组,模型组,PCP-1给药组。将5瓶中分别加入培养基,10 μg/mL LPS,LPS+PCP-1(10、50、100 μg/mL),培养24 h后,细胞备用。细胞培养液按试剂盒要求的步骤进行操作,测定各组细胞上清液中 LN、 FN的含量。
3 结果
3.1 PCP经SePhadex G-50凝胶柱洗脱结果
耙齿菌经水提醇沉,除蛋白后得到粗多糖(PC),收率为30.24%。PC经离子交换树脂纯化后得PCP,颜色由原来的浅褐色变成灰白色,除去了大量的杂质,总糖含量明显提高,蛋白质含量明显降低,收率可到达70.36%。PCP经SePhadex G-50凝胶柱洗脱,绘制洗脱图,见图1。如图1可知,PCP经过凝胶色谱的分离,得到两个部分,分别收集,命名为PCP-1和PCP-2。
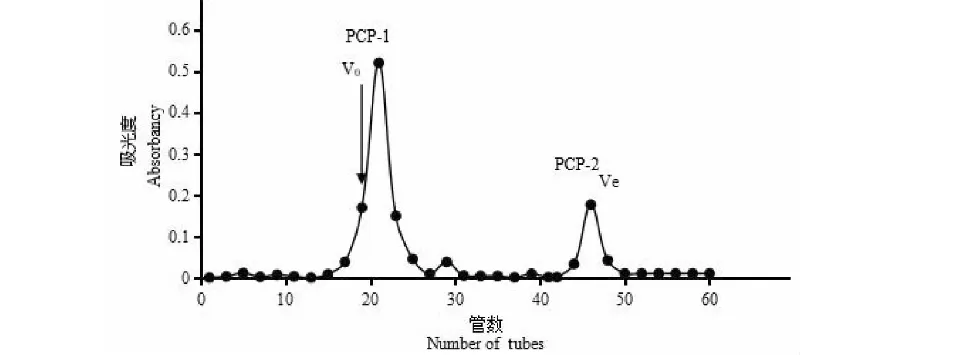
图1 PCP经SePhadex G-50洗脱图Fig.1 PCP eluted by SePhadex G-50 注:Ve为内水体积,VO为外水体积。Note:Ve is the volume of internal water,VOis the volume of external water.
3.2 PCP-1、PCP-2理化性质的测定
理化性质结果见表1。结果显示,PCP经过凝胶柱分离后,得到的PCP-1、PCP-2总糖含量分别为98.05%、96.92%,酸性糖、蛋白质几乎没有。PCP-1含有Man、Glc和Gal,且Gal的含量最高,摩尔比例为2.3∶1.2∶3.3;而PCP-2只含有Glc。

表1 PCP-1、PCP-2中性糖、酸性糖、蛋白质含量和组成糖的测定结果Table 1 Determination of PCP-1,PCP-2 neutral sugar,acid sugar,protein content and composition sugar
3.3 PCP-1、PCP-2分子量测定
样品按2.3中色谱条件进样,得到色谱图如图2所示。根据供试品的保留时间计算样品各组分的重均分子量,PCP-1、PCP-2分子量分别为30 000和8 000 Da。
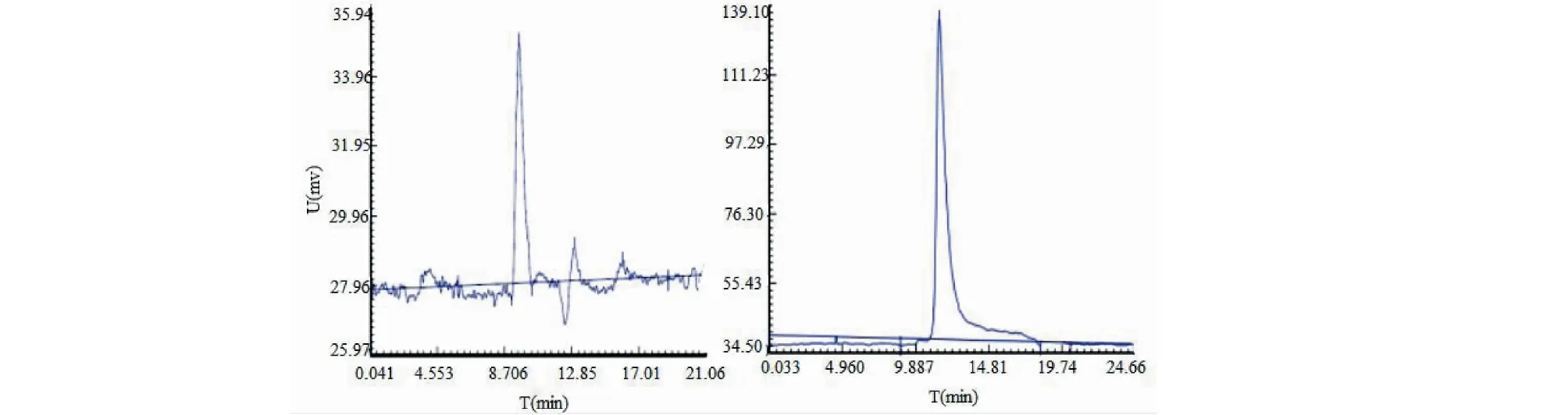
图2 PCP-1 、PCP-2 GPC色谱图Fig.2 PCP-1,PCP-2 GPC chromatogram 注:左:PCP-2;右:PCP-1;Note:left:PCP-2;Right:PCP-1
3.4 PCP-1、PCP-2化学结构
3.4.1 IR分析结果
由图3,PCP-1光谱图可知,宽峰3 330 cm-1是O-H的伸缩振动,是多糖类化合物的特征吸收;2 930 cm-1为C-H的伸缩振动峰;1 610 cm-1为C-O的伸缩振动峰;1 408 cm-1处的吸收峰是C-H的变角振动;1 025 cm-1处的吸收峰表明PCP-1包含吡喃糖类型的结构;另外,是多糖中的C-O、C-O-C的伸缩振动和C-OH的弯曲振动特征峰;852和744 cm-1处于950~700 cm-1之间,说明具备α-和β-两种构型。
由图3,PCP-2光谱图可知,在3 350和2 930 cm-1的吸收峰分别为O-H、C-H2的伸缩振动峰;1 610 cm-1为糖的水化物的吸收峰;1 408 cm-1处的吸收峰是C-h的变角振动;1 020、1 080、1 150、851 cm-1处的吸收峰是多糖中α-吡喃环伸缩振动特征峰。由此可知,PCP-2为α-构型吡喃聚糖。
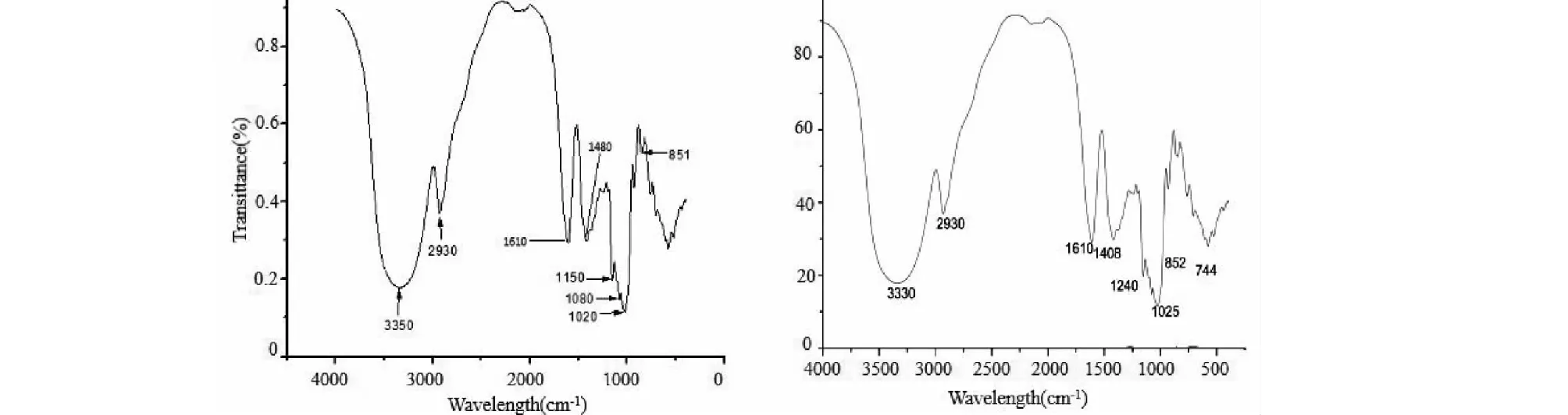
图3 PCP-1、PCP-2 FT-IR光谱图Fig.3 PCP-1,PCP-2 FT-IR sPectrum 注:左:PCP-2;右:PCP-1;Note:left:PCP-2;Right:PCP-1
3.4.2 甲基化 GC-MS分析
通过与参考文献对照[12],得甲基化分析结果,列于表 2。结果显示,PCP-1主要包含7种糖残基,其中有1个末端,2个分支点,末端和分支点之和的数量相等且糖残基中Man、Gal、Glc的比例也和上述组成糖的结果一致,以上分析说明甲基化的结果是合理的。PCP-2没有分支,为直链结构,且为1、6连接。

表2 PCP-1和PCP-2甲基化结果Table 2 PCP-1 and PCP-2 methylation results
续表2

保留时间tR(min)糖残基Sugar residues摩尔比例Molar ratio连接方式Attended mode22.281 2,3,4- Me3- Man1.0→6)- ManP-(1→23.9202,3,4- Me3- Gal10.0→6)- GalP-(1→26.536 2,4- Me3- Man2.5→3,6)- ManP-(1→27.8553,4-Me2- Gal5.0→2,6)- GalP-(1→PCP-216.7202,3,4,6-Me4-Glc1.0→1)- GlcP18.5382,3,4- Me3-Glc19.00→1,6)- GlcP
3.5 耙齿菌多糖抗GMC增殖活性
3.5.1 LPS诱导的GMC增殖模型
GMS细胞在接种后12小时到72小时内处于对数增长期。可用于细胞模型建立。由表3可知,LPS作用于GMC细胞,可剂量依赖性地刺激系膜细胞增殖。当采用10 μg/mL的LPS诱导24 h时细胞抑制率为50%(P<0.01),以此作用时间建立氧化应激细胞模型。
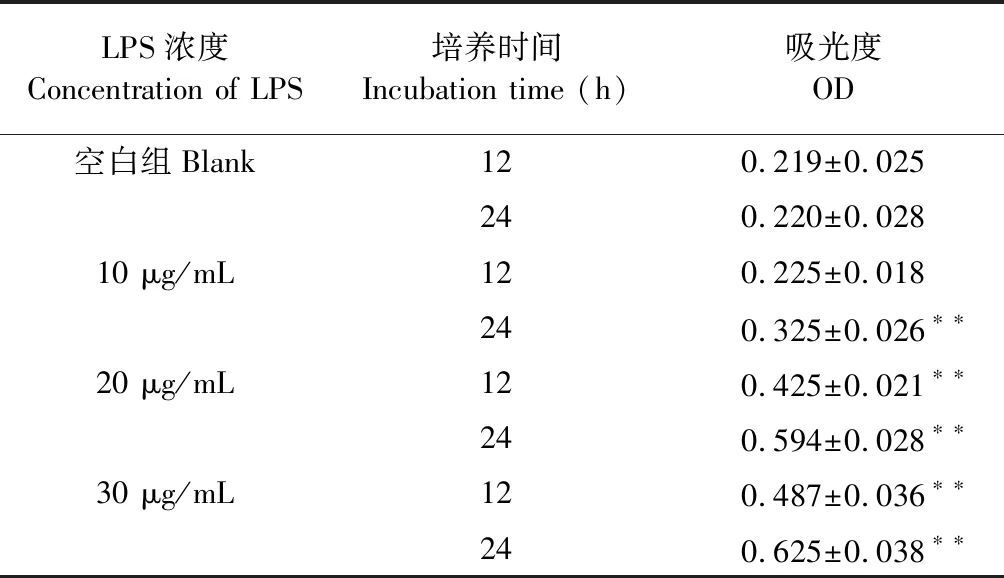
表3 LPS诱导细胞增殖情况Table 3 LPS induced cell proliferation
注:与空白对照组比较,*P<0.05;**P<0.01。
Note:Compared with control,*P< 0.05;**P< 0.01.
3.5.2 PCP-1、PCP-2对LPS诱导的GMC增殖的影响
由图4可知,模型组与空白组相比有显著性差异,说明LPS造模成功。PCP-1对LPS细胞增殖具有明显的保护作用,当剂量增大,呈现显著性差异,呈现明显且呈现一定的量效关系,而PCP-2无此作用。
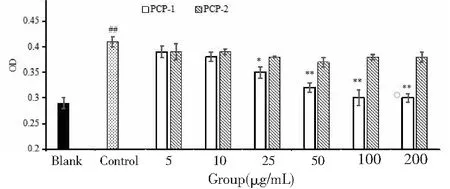
图4 PCP-1和PCP-2对GMC细胞活力的影响Fig.4 Effects of PCP-1 and PCP-2 on the activity of GMC 注:空白组相比,#P<0.05;##P<0.01,与模型组相比,*P<0.05;**P<0.01。Note:Compared with blank,#P<0.05;##P< 0.01,Compared with control,* P < 0.05;** P < 0.01.
3.6 PCP-1对FN、LN含量的影响
FN,LN等蛋白围绕在GMC周围,构成GMC生存的微环境。它不仅是细胞的支架组织,还直接影响细胞的黏附、营养、代谢、增殖、分化和迁移,许多细胞因子通过 ECM 对细胞的生长、增殖和分化起调控作用。采用ELISA法测定FN、LN的含量。如图5所示,PCP-1能够减少LPS诱导的GMC细胞中FN和LN蛋白的释放,并呈现量效关系。
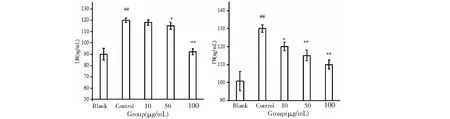
图5 PCP-1对LPS诱导的GMC细胞中FN和LN含量的影响Fig.5 Effect of PCP-1 on the content of FNand LNin GMC cells induced by LPS 注:空白组相比,#P<0.05;##P<0.01,与模型组相比,*P<0.05;**P<0.01。Note:Compared with blank,#P<0.05;##P<0.01,Compared with control,* P < 0.05;** P < 0.01.
4 讨论
肾小球肾炎是我国临床上的常见的肾脏疾病,其病程长,危害大。肾小球系膜细胞(GMC)增殖和细胞外基质(ECM)增多是主要的病理改变。ECM增多是指ECM合成增多或降解减少导致的ECM蛋白组分过度积聚。ECM主要蛋白组分包括Ⅳ型胶原、纤维连接蛋白(FN)、层粘连蛋白 (LN)和蛋白聚糖等。GMC是肾小球三种固有细胞成分(GMC、内皮细胞、脏层上皮细胞)中功能最活跃的细胞,GMC受到外界因素刺激后,会产生各种细胞因子,这些细胞因子相互作用,最终导致肾炎的发生及发展。GMC产生ECM的作用最强,是ECM的主要产生细胞或称效应细胞。所以,若能有效保护GMC,抑制GMC增殖,则可延缓肾小球硬化,防止肾衰的发生。耙齿菌多糖在临床上治疗肾小球肾炎有良好的应用基础,但是,国内外对白囊耙齿菌的研究很少,耙齿菌多糖的活性成分尚不清楚。本实验分离纯化得到的耙齿菌均一多糖PCP-1能有效抑制GMC的异常增殖,减少LN,FN等相关因子的释放,为耙齿菌多糖的活性成分。本研究为进一步研究耙齿菌均一多糖的结构和活性提供实验基础。为益肾康胶囊确定合理的工艺,建立有效的质量控制方法,为多糖治疗慢性肾炎的构效关系这一科学问题,提供有益的借鉴和数据。

