内蒙古碱湖一株菱形藻的分离鉴定及其应用潜力评价
王旭静 靳桂勇 王秀粉 马雪彬 刘秋珂

摘要:从内蒙古哈马太湖中分离得到一株淡水硅藻NW129,经形态学和分子生物学鉴定,该藻株与菱形藻属的普通菱形藻亲缘关系最近。该藻在温度28 ℃、光照100 μmol/(m2·s)、光暗周期12 h∶12 h,摇床转速为160 rpm的条件下培养。在Zarrouk培养基中,连续培养25 d。培养12 d,干重达到1.06 g/L,每天平均生长率为0.10 g/(L·d),培养至25 d,干重达到1.95 g/L,后13 d的平均生长率仅为0.08 g/(L·d)。整个生长过程中,培养液pH从初始的9.20增至12.30。培养25 d后,采收藻细胞总脂含量为24.00%,可溶性蛋白为12.00%,多糖比例为3.35%,岩藻黄素含量达13.06 mg/g。结果表明,该藻株速生性状突出,对高 pH耐受能力强,岩藻黄素含量高,是一株具有开发应用潜力的藻株。
关键词:菱形藻;分离鑒定;生长特性;理化成分
优良藻种是进行微藻规模化生产的基础,作为可规模化生产的微藻须要富含生物活性成分,具有突出的经济价值,生长快速,对温度及光照变化适应能力强,能够抵抗轮虫以及杂藻的污染等[1]。目前国内外已实现规模化培养藻种有螺旋藻、盐藻、小球藻。其中螺旋藻耐受高碱、盐藻耐受高盐、小球藻生长快速,这些微藻富含蛋白或者生物活性成分,常用于生产保健品、食品添加剂等[2-3]。
内蒙古哈马太湖(108°02′E,39°06′N)位于鄂尔多斯高原鄂托克旗,常年水深1.5 m,四季温度12.5~26 ℃,pH8.5以上,最高达16.3。近20年来,在碱湖附近有400 hm2的螺旋藻养殖工厂,每年约有80万吨养殖废水排入哈马太湖,这些养殖废水盐度高、碱度高、pH高[4],形成了湖水盐碱度高的环境。本研究在碱湖中分离到一株梭形的藻株,在对该株微藻分离纯化的基础上,进行了培养,并对该藻株的可溶性蛋白、多糖、总脂及色素等理化成分进行了分析,以期为该分离微藻的应用提供依据。
1材料与方法
1.1藻种分离鉴定
1.1.1藻株分离程序将哈马太湖中采集的水样镜检,发现除螺旋藻外还有一株硅藻,呈梭形。采用微吸管法定向分离该藻株。在Zarrouk培养基中富集培养7 d,倒置显微镜下吸取单细胞至24孔板中培养7~14 d,镜检选取目的藻株纯度较高的孔进一步在48孔板中进行梯度稀释纯化,培养28 d,取稀释浓度最低孔板里的藻液,即为目的藻株纯化株。随后,将纯化藻株接种在灭菌的固体Zarrouk培养基(固体Zarrouk培养基是在液体Zarrouk培养基中加入1%的琼脂高压灭菌)中,进行纯化。在光照强度100 μmol/(m2·s)、温度28 ℃、光暗比12 h∶12 h的培养箱中培养。2~3周后固体培养基上开始出现藻落,挑取单藻落在Zarrouk液体培养基中培养,获得单克隆纯化藻株。根据本实验室对分离藻株的编号序列,暂定代号为NW129。
1.1.2分离藻株的鉴定在光学显微镜下观察藻细胞形态并测量其大小,进行藻种的初步鉴定。在形态学鉴定基础上,进行藻株的分子生物学鉴定。取生长对数期微藻,CTAB法提取微藻基因组DNA[5]。18SrDNA扩增使用硅藻通用引物(正向序列467F:5-TGGTGGAGTGATTTGTCTGG-3;反向序列467R:5-CATTCAGGTAGGTGC-3)[6],预计扩增片段长度400 bp。PCR反应总体系为25 μL,模版1 μL,上下游引物各0.5 μL,TaqDNA聚合酶12.5 μL,无菌水10.5 μL。反应条件:94 ℃预变性5 min;94 ℃变性30 s,49 ℃退火30 s,72 ℃延伸30 s,30个循环;72 ℃延伸5 min。PCR产物经1%琼脂糖凝胶电泳检测,获得预期扩增序列。回收纯化PCR产物送交上海生工生物工程有限公司进行测序。获得的18S rDNA序列经与GenBank中相关序列信息进行BLAST相似性搜索,选取相似性大于97%的序列在BioEdit中进行多序列对齐,用MEGA5.1邻接法(Neighbor-joining)建立系统进化树,重复1 000次计算bootstrap值。
1.2生长特性分析
1.2.1分离藻株培养将微藻培养至指数生长末期,离心去上清,以生物量为0.2 g/L的初始接种密度接种至Zarrouk培养基中,连续培养25 d。基于哈马太湖的生境条件以及藻种的采集时间(高温干旱的7月份),本研究设置该藻的初始培养条件为:温度28 ℃,光照强度100 μmol/m2/s,光暗周期:12 h∶12 h,摇床转速160 rpm。
1.2.2分离藻株生物量、pH和比生长速率测定微藻生长过程中,每天定时取样测藻液的生物量和pH,绘制生物量和pH日变化曲线。真空抽滤5 mL的藻液至预先测重的GF/CTM(WhatmanTM公司)玻璃纤维素滤膜上(预先烘至恒重),放置60 ℃烘箱烘至恒重,冷却至室温称重,根据重量差计算出单位藻液生物量(g/L)。
基于测量的生物量值,计算比生长速率。比生长速率根据公式μ=ln(N2/N1)/(T2-T1)计算;其中,T2和T1分别代表培养时间,T2>T1,N2和N1分别为时间T2和T1时的微藻生物量。
1.3理化成分分析
1.3.1总脂含量总脂含量基于Bligh and Dyer的重量法测定[7]。取冷冻干燥的藻粉40 mg(m0)于EP管中,加入2 mL氯仿和1 mL甲醇,混匀后超声破碎20 min(2 s超声处理+2 s间隔时间,功率为30%),破碎后的样品8 000 rpm离心10 min,收集上清到新EP管中,重复三次;合并所有上清液,加入1.2 mL0.9%的NaCl溶液,涡旋震荡5 min,静置分层;用1 mL注射器吸取下层氯仿层,转移至事先称重过的玻璃管(m1)中;将玻璃管置于50 ℃水浴锅中24 h,待液体挥发完全后,将玻璃管转移至60 ℃烘箱中烘干,冷却至室温记录重量为m2。总脂含量公式:LW(%)=((m2-m1)/m0)×100%。
1.3.2可溶性蛋白含量采用BCA法测定。BCA试剂与Cu试剂按照50∶1的比例配制成BCA工作液,混匀。称量30 mg冷冻干燥的藻粉于EP管中,加入1 mL裂解液,加入蛋白酶抑制剂,超声破碎20 min(2 s超声处理+2 s间隔时间,功率为30%)。离心,取上清20 μL加入到96孔板的样品孔中,加入200 μL BCA工作液,37 ℃孵育30 min,酶标仪测量562 nm的吸光度值,根据标准曲线计算可溶性蛋白含量。
1.3.3多糖含量采用蒽酮比色法(Chaplin and Kennedy ,1986)[8]。称取10 mg冷冻干燥的藻粉,加入3 mL PBS,混匀,超声破碎20 min,细胞破碎完全后,充分震荡,沸水浴30 min,吸取2 mL溶液,加入0.1 mL硫酸锌溶液,沸水浴5 min,加入0.2 mL亚铁氰化钾,充分混匀,3 000 g离心10 min,吸取1 mL上清液于干凈的玻璃管中,加入硫酸蒽酮溶液4 mL,沸水浴10 min,冷水迅速冷却,室温平衡15 min,以1 mL PBS与4 mL蒽酮溶液做参比,测量620 nm处的吸光度值,根据标准曲线计算出葡萄糖含量。
1.3.4岩藻黄素含量参照Kim(2012)[9]。取10 mg冷冻干燥的藻粉,均质机破碎2 min,加入1 mL乙醇(HPLC级),摇床200 rpm 0 ℃暗处理1 h,6 000 rpm离心5 min,收集上清至新EP管中;重复两次。合并上清,0.22 μm过滤器过滤,整个处理过程均在低温避光条件下进行。
提取物中的岩藻黄素含量采用RP-HPLC分析测定。HPLC分析采用岛津高效液相色谱系统(二元泵单元、自动进样器、PAD检测器),YMC C30柱(4.6 mm×250 mm,5 μm)。流动相由A液(乙腈:水,体积比为9∶1)和B液(乙酸乙酯)组成。梯度洗脱[10]:从100%A线性变化到100%B,20~22 min;从100%B线性变化到100%A,22~23 min;100%A,23~35 min。柱温:40 ℃。流速为1.0 mL/ min。进样量为10 μL。基于标准品制作“浓度——色谱峰面积”标准曲线,在445 nm处检测岩藻黄素的含量。
1.4数据处理
所有实验都设置三个平行,实验中的数据采用软件SPSS20.0进行单因素方差分析(ANOVA),并进行多重比较(S-N-K),数据表示为Mean±SD,显著水平P<0.05,采用Microsoft office 2016绘图。
2结果与讨论
2.1藻种鉴定
2.1.1形态学观察光镜下分离藻株NW129细胞(见图1)呈褐棕色,单个呈梭形,中部膨大,细胞核位于两个黄褐色盘状色素体中间,两端呈钝圆形,长约18~20 μm,最宽处约6 μm。与菱形藻属微藻形态相近。目前报道的菱形藻属微藻长15~150 μm不等,宽约1~6 μm[11]。Suh Nih Tan[12]等人从马来西亚红树林中分离得到的Nitzschia navis-varingica长88.5 μm,宽5.7 μm,细胞有两个黄褐色盘状叶绿体,细胞核位于两个色素体中间。
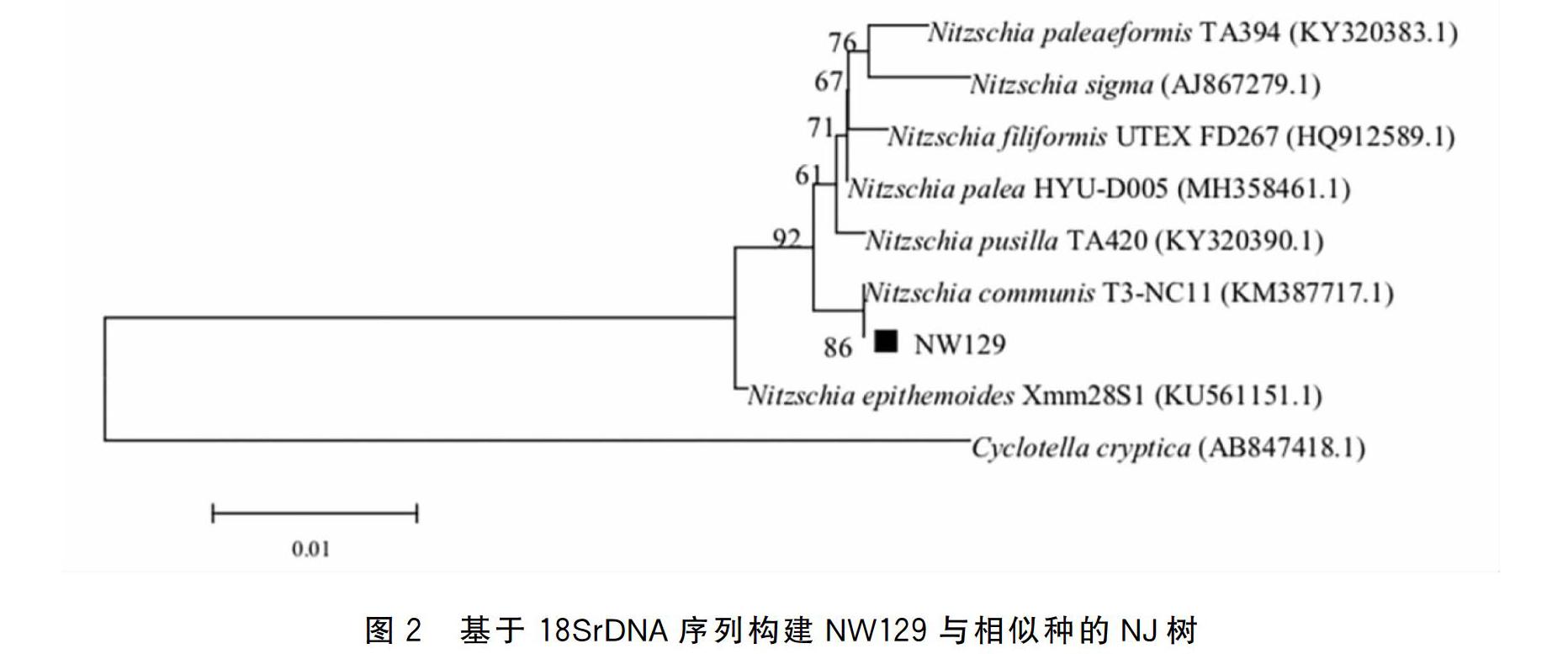
2.1.2分子生物学鉴定本实验将扩增得到的分离藻株18SrDNA序列测序,经BLAST比对进行相似性搜索,选取GenBank中与NW129相似性大于97%且序列信息均为菱形藻属的微藻,以小环藻(Cyclotella cryptica)相应序列为外类群,采用Mega5.1软件的邻接法(Neighbor-joining)建立系统进化树(见图2)。结果显示该分离藻株的18S rDNA与菱形藻属的普通菱形藻(Nitzschia communis T3-NC11(KM3877171))序列相似度最高,在NJ树上聚为一支,但相似距离仅为86%。菱形藻属是硅藻中比较大的类群之一,但该属物种鉴定存在很多争议,形态学和系统发育学角度都认为,菱形藻不是自然的分类群体,该属是多系发生的[13-14],并且分类体系尚未确定,在鉴定方面还存在着很多困难,本研究只能将该藻株定为菱形藻属的微藻。
2.2生长特性分析
目前已知菱形藻属微藻生境极为广泛,淡水、海水、河口区都可以生长[15],包括底栖物种和浮游物种。在实验室条件下,海洋菱形藻一般培养在f/2培养基中[16],淡水菱形藻在BG11、BBM、CHU10、D1培养基中均可能生长[17-21],菱形藻适宜的pH范围为6.4~8.2。 Mustafa Suha Sahin[17]将Nitzschia sp. (EGEMACC 49) 在100 μmol/(m2·s)、28 ℃、f/2培养基中培养14 d,终生物量为0.638 g/L。Mariana Machado[19]等人在BG11培养基、100 μLmol/(m2·s)、24 ℃条件下培养了两株Nitzschia palea各6 d,BR006和BR022的比生长速率分别为0.82 d-1、0.56 d-1;但未见菱形藻在Zarrouk培养基生长的报道,而本实验分离得到的淡水菱形藻NW129可以在Zarrouk培养基中快速生长。
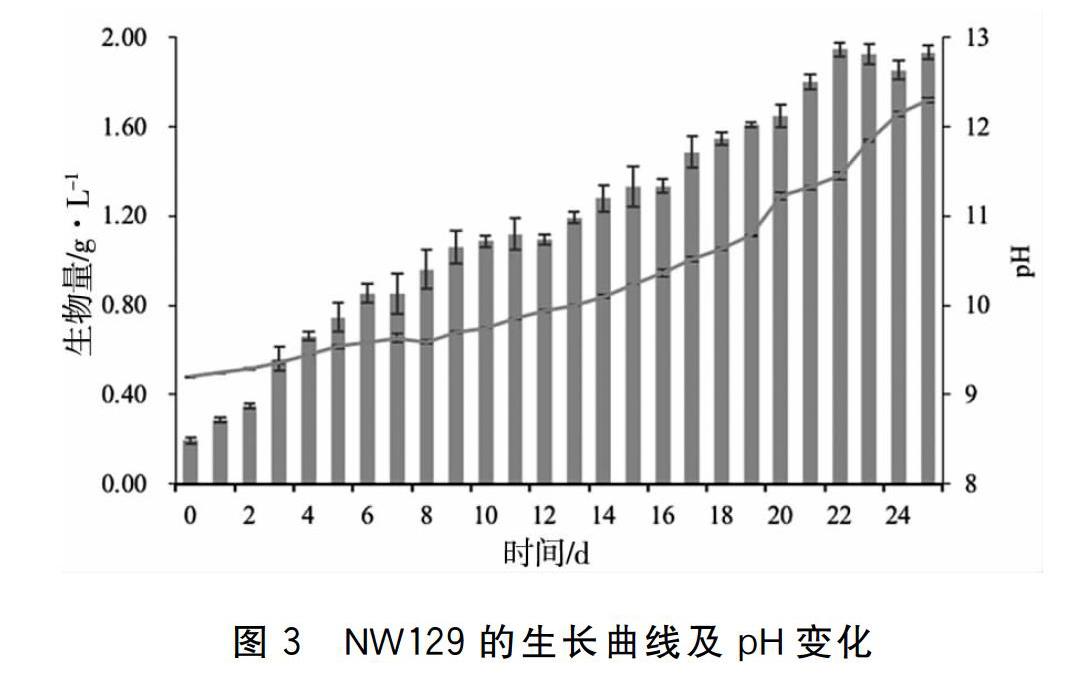
本实验分离藻株来自内蒙古哈马太湖,湖水pH较高,本实验使用的Zarrouk培养基初始pH为9.2,采用了与哈马太湖相似碱环境。在Zarrouk培养基中,NW129在接种的第二天即进入指数生长阶段,生物量从初始接种0.2 g/L增加至0.29 g/L,至培养的第9天生物量达1.06 g/L,随后进入缓慢的增长阶段,第12天生物量为1.09 g/L。伴随藻细胞的增殖,藻液的pH也从最初的9.2逐渐升高至9.94。该阶段的比生长速率为0.10 g/L/d。从培养的第13天,NW129又表现出快速增长的趋势,第22天生物量达到最大1.95 g/L,pH增加至11.45,第25天该藻的干重达到1.93 g/L, pH达12.30。该阶段的比生长速率为0.08 g/L/d。该藻在整个生长过程中,生物量不断增加, pH也随之呈现上升趋势,表现出了持续的增长趋势和较高的生物量,突出的pH耐受特性。其中对高pH的耐受性,户外培养过程中,有利于抵抗杂藻、轮虫等敌害生物对微藻培养的危害。
[11] SMIDA D B, LUNDHOLM N, KOOISTRA W H C F,et al. Morphology and molecular phylogeny of Nitzschia bizertensis sp. nov.—A new domoic acid-producer[J].Harmful Algae,2014,32:49-63.
[12] TAN S N, TENG S T, LIM H C,et al. Diatom Nitzschia navis-varingica (Bacillariophyceae) and its domoic acid production from the mangrove environments of Malaysia [J]. Harmful Algae, 2016, 60:139-149.
[13] RIMET F, KERMARREC L, BOUCHEZ A,et al. Molecular phylogeny of the family Bacillariaceae based on 18S rDNA sequences: focus on freshwater Nitzschia of the section Lanceolatae[J]. Diatom Research, 2011,26(3):273-291.
[14] TROBAJO R, ROVIRAL L, ECTOR L,et al. Morphology and identity of some ecologically important small Nitzschia species [J]. Diatom Research, 2013,28(1):37-59.
[15] CHEPURNOV V A, MANN D G,VYVERMAN W,et al.Sexual reproductioon, mating system, and protoplast dynamics of seminavis[J].Journal of Phycology,2002,38(5):1004-1019.
[16] SAHIN M S, KHAZI M I, DEMIREL Z,et al.Variation in growth, fucoxanthin, fatty acids profile and lipid content of marine diatoms Nitzschia sp. and Nanofrustulum shiloi in response to nitrogen and iron[J]. Biocatalysis and Agricultural Biotechnology,2019, 17:390-398.
[17] GU X, LI K, PANG K,et al. Effects of pH on the growth and NH4-N uptake of Skeletonema costatum and Nitzschia closterium [J].Marine Pollution Bulletin,2017,124:946-952.
[18] HAN L, XU B, QI F, et al. Effect of nitrogen/phosphorus concentration on algal organic matter generation of the diatom Nitzschia palea: Total indicators and spectroscopic characterization[J].Journal of Environmental Sciences,2016,47:130-142.
[19] MACHADO M, BROMKE M, et al. Comprehensive metabolic reprogra ming in freshwater Nitzschia palea strains undergoing nitrogen starvation is likely associated with its ecological origin[J]. Algal Research,2016,18:116-126.
[20] ABOU-SHANAB R A I, HWANG J-H, CHO Y, et al. Characterization of microalgal species isolated from fresh water bodies as a potential source for biodiesel production[J]. Applied Energy,2011,88:3300-3306.
[21] VERNEUIL L, SILVESTRE J, RANDRIANJATOVO I,et al. Double walled carbon nanotubes promote the overproduction of extracellular protein-like polymers in Nitzschia palea: An adhesive response for an adaptive issue[J].Carbon,2015,88:113-125.
[22] TAKAICHI S. Carotenoids in algae: distribution, biosyntheses and functions[J]. Marine Drugs,2011,9:1101-1118.
[23] PENG J, YUAN J-P, WU C-F,et al. Fucoxanthin, a marine carotenoid present in brown seaweeds and diatoms: metabolism and bioactivities relevant to human health[J].Marine Drugs, 2011,9(10):1806-1828.
[24] XIA S, WANG K, WANG L,et al. Production, characterization, and antioxidant activity of fucoxanthin from the marine diatom Odontella aurita[J].Marine Drugs,2013, 11: 2667-2681.
[25] GUO B, LIU B, YANG B,et al. Screening of diatom strains and characterization of Cyclotella cryptica as a potential fucoxanthin producer[J].Marine Drugs,2016,14(7): 125-139.
Separation, identification and assessing of potential application of a strain of Nitzschia sp. in Hamatai Lake
WANG Xujing1, JIN Guiyong1, WANG Xiufen1, MA Xuebin1, LIU Qiuke1
(1. Key Laboratory of Mariculture, ministry of Education, Ocean University of China Qingdao, 266003,China;)
Abstract:A freshwater diatom of Nitzschia sp. named NW129 was isolated from the Hamatai Lake in Inner Mongolia and identified by morphology and molecular biology, which was similar to the common Nitzschia. The optimum conditions were: Zarrouke medium, temperature of the shaking table 28 °C, a photon flux density of 100 μmol/m2/s, a 12 h∶12 h light:dark cycle, and rotating speed 160 rpm. In Zarrouke medium, NW129 was cultured for 25 days. In the first 12 days, the biomass and average growth rate were respectively 1.06 g/L and 0.10 g/L/d. In the last 13 days, its biomass was up to 195 g/L, while its growth rate was 0.080 g/L/d. During the period of 25 days, pH of the medium was from 9.20 to 12.30. After 25 days of culture period, the total lipid, soluble protein, polysaccharides of the strain were 24.00%, 12.00%, 3.35%, respectively. And the content of fucoxanthin was 13.06 mg/g. The results show that there is a strain with tremendous potential application which has outstanding characters of faster growth, stranger tolerance of high pH, as well as higher content fucoxanthin.
Key words:Nitzschia sp.; separation identification; growth characteristics; physical and chemical composition

