49份白三叶种质资源遗传多样性的SSR分析
张鹤山, 陈志宏2, 田 宏, 熊军波, 刘 洋
(1.湖北农业科学院畜牧兽医研究所/动物胚胎工程及分子育种湖北省重点实验室, 武汉 430064; 2.全国畜牧总站, 北京 100125)
白三叶(TrifoliumrepensL.)为豆科车轴草属多年生草本植物,起源于地中海地区[1],广泛分布于世界各地[2]。白三叶作为优质蛋白饲料喂养家畜已有几个世纪[3]。其生态防护、土壤固氮等方面的作用亦为人们所认识,在农牧渔业生产中具有十分重要的地位。随着我国南方草地畜牧业的发展,白三叶栽培种植区域不断扩大,已在云、贵、川、鄂、湘、苏、皖等省人工草地建设中得到广泛应用。资料表明,在云南20万hm2人工草地上有近一半草地混播了白三叶[4],湖北省也有近4万hm2人工草地种植了白三叶[5],成为当地当家草种之一。
我国白三叶育种进程相对落后,到目前为止通过全国草品种审定委员会登记的白三叶品种仅6个。因此,引进国外品种进行栽培成为提升我国草牧业发展水平的重要措施,但由于育种目标和地域的异同,栽培材料在国内表现出显著的差异性,这些差异不仅表现在表型特征,也有内在的遗传背景差异。研究这些差异特性是进一步利用这些资源的基础,也为白三叶新品种的培育提供技术支撑。
分子标记技术已经用于基因鉴定、性状遗传、基因定位、种谱分析以及辅助育种等方面[6]。在可获得的DNA标记辅助系统中,简单重复序列(Simple sequence repeats,SSR)标记(又名微卫星DNA)被认为是植物染色体组分析的理想技术[7],它是基于PCR的共显性标记[8],通常与非重复的DNA区域结合[9],并且在同一物种的不同群体间高度表达[10-13]。在白三叶中,基于SSR标记的白三叶遗传多样性研究已经开展。Jones et al.用78个SSR引物对和57个AFPL(扩增片段长度多态性)引物对标记了135个位点[14]。Barrett 等[15]利用365个SSR引物标记了493个位点。在国内,李莉等[16-17]基于SSR标记研究了贵州野生白三叶的遗传多样性,Zhang 等[18]利用343个SSR引物对标记了415个位点。因此,SSR分子标记技术可以用于白三叶种质资源遗传多样性的研究,并从本质上反映研究材料的差别,为白三叶标记辅助育种提供技术支持。
本研究拟利用SSR分子标记技术,从DNA水平分析国内外49份白三叶种质资源的亲缘关系和遗传多样性,旨在为白三叶资源评价和利用提供科学依据。
1 材料与方法
1.1 试验材料
试验材料共49份,均为来自国内外的白三叶栽培或野生材料(表1)。每份材料种植4 m2(2 m×2 m),于分枝期取样。
DNA提取、引物合成由武汉天一辉远生物科技有限公司完成。
1.2 试验方法
1.2.1DNA提取与检测
取白三叶健康嫩叶,采用改良CTAB法提取基因组DNA,并用核酸检测仪NanoDrop ONE检测DNA浓度与纯度,将合格DNA样品置于-20 ℃条件下保存备用。
1.2.2SSR引物设计
基于白三叶转录组测序数据,利用软件MicroSatellite(MISA)进行EST-SSR位点扫描,然后通过Primer 5.0软件对这些位点进行引物设计,参数设定为:引物长度18~25 nt,最适长度为21 nt;引物退火温度为55~65 ℃,最优退火温度为60 ℃;PCR产物长度范围为80~500 bp;GC含量在40%~60%之间,最优GC含量为50%。按碱基重复发明初步使用109对EST-SSR引物,利用8个不同地区的样本研究引物的扩增效率及多态性,筛选明显多态性条带的引物48对。
为更清晰的读取谱带数据,将每个引物的正向引物(F引物)加上通用M 13接头序列“TGTAAAACGACGGCCAGT”,得到M 13接头引物,另外再合成加HEX荧光基团的M 13荧光接头引物。
1.2.3SSR-PCR扩增体系与电泳检测
以待测样品DNA为模板,以反向引物、M 13接头引物和荧光基团的M 13荧光接头引物使用三引物PCR法进行扩增,PCR反应优化体系总体积为10μL,其中包括1μL模板DNA,5μL的2×Taq PCR Master Mix,0.1μL浓度为10 pmol·μL-1的正向引物,0.4μL浓度为10 pmol·μL-1的反向引物,0.4μL浓度为10 pmol·μL-1的带荧光M 13引物,灭菌水补足10μL。
SSR-PCR扩增程序为:95 ℃预变性5 min;然后95 ℃变性30 s,57.5~60 ℃退火30 s,72 ℃延伸30 s,共30个循环;接着95 ℃变性30 s,52 ℃退火30 s,72 ℃延伸30 s,共8个循环;最后72 ℃末端延伸10 min,于4 ℃保存。
将获得的荧光PCR扩增产物进行毛细管荧光电泳检测,读取毛细管电泳数据,统计条带检测结果。
1.2.4数据分析
将步骤D得到的条带检测结果进行人工比对、校正,根据条带的有无,赋以“1”或“0”,缺失数据记为“-9”,建立“0,1”分子数据矩阵;根据分子数据矩阵,统计EST-SSR标记扩增产物的条带总数和多态性条带数;利用POPGEN v 1.32软件计算各引物对的Shannon信息多样性指数(I)、Nei’s遗传多样性指数(He);利用NTSYS-PC 2.10软件计算遗传相似系数并基于UPGMA方法对白三叶样品个体进行聚类分析,构建得到UPGMA聚类树。
2 结果与分析
2.1 SSR引物筛选及扩增产物多态性分析
利用8个白三叶材料筛选出48对具有多态性引物,并以这48对引物对49份白三叶材料进行SSR-PCR扩增,引物扩增结果见表2。48对引物共扩增出441谱带,其中多态性谱带439条,各引物多态性条带比率范围为75%~100%,平均多态性条带比率为99.5%,仅2个引物多态性比率低于100%,其中引物TR 03多态性比率为75%,引物TR 22多态性比率为90%;从扩增谱带数量看,引物扩增多态性谱带数最低为3条(引物TR 03、TR 05、TR 14和TR 48),最高为20条(引物TR 26),平均每个引物扩增出9.15条多态性谱带;Nei’s基因多样性指数范围在0.105~0.429之间,平均值为0.254;Shannon信息指数范围在0.206~0.618之间,平均值为0.399,表明白三叶材料遗传多样性十分丰富,SSR-PCR分子标记能够很好地检测白三叶遗传位点,可以用于白三叶遗传多样性分析及种质系谱分析。
表1 白三叶材料基本信息
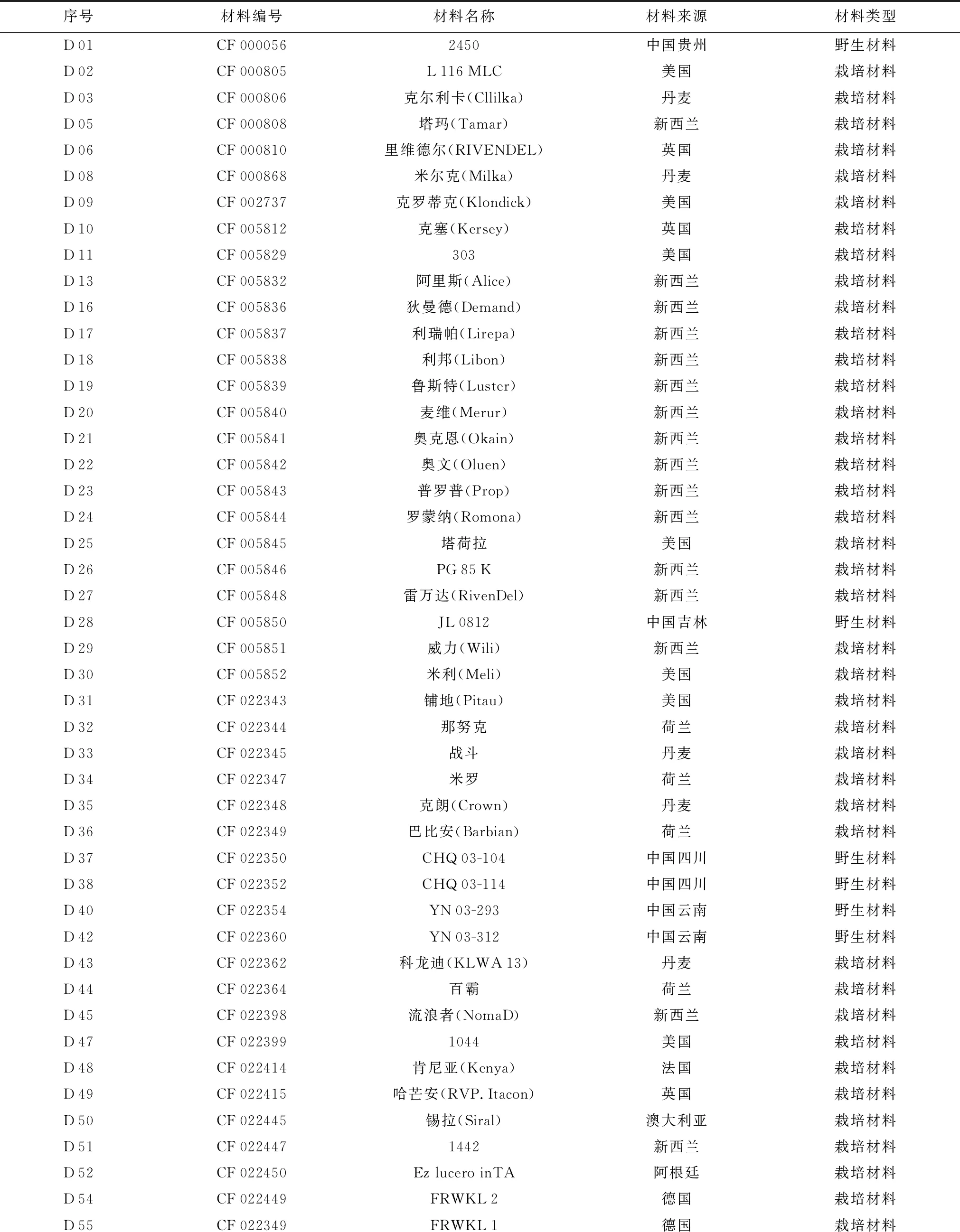
序号材料编号材料名称材料来源材料类型D01CF0000562450中国贵州野生材料D02CF000805L116MLC美国栽培材料D03CF000806克尔利卡(Cllilka)丹麦栽培材料D05CF000808塔玛(Tamar)新西兰栽培材料D06CF000810里维德尔(RIVENDEL)英国栽培材料D08CF000868米尔克(Milka)丹麦栽培材料D09CF002737克罗蒂克(Klondick)美国栽培材料D10CF005812克塞(Kersey)英国栽培材料D11CF005829303美国栽培材料D13CF005832阿里斯(Alice)新西兰栽培材料D16CF005836狄曼德(Demand)新西兰栽培材料D17CF005837利瑞帕(Lirepa)新西兰栽培材料D18CF005838利邦(Libon)新西兰栽培材料D19CF005839鲁斯特(Luster)新西兰栽培材料D20CF005840麦维(Merur)新西兰栽培材料D21CF005841奥克恩(Okain)新西兰栽培材料D22CF005842奥文(Oluen)新西兰栽培材料D23CF005843普罗普(Prop)新西兰栽培材料D24CF005844罗蒙纳(Romona)新西兰栽培材料D25CF005845塔荷拉美国栽培材料D26CF005846PG85K新西兰栽培材料D27CF005848雷万达(RivenDel)新西兰栽培材料D28CF005850JL0812中国吉林野生材料D29CF005851威力(Wili)新西兰栽培材料D30CF005852米利(Meli)美国栽培材料D31CF022343铺地(Pitau)美国栽培材料D32CF022344那努克荷兰栽培材料D33CF022345战斗丹麦栽培材料D34CF022347米罗荷兰栽培材料D35CF022348克朗(Crown)丹麦栽培材料D36CF022349巴比安(Barbian)荷兰栽培材料D37CF022350CHQ03-104中国四川野生材料D38CF022352CHQ03-114中国四川野生材料D40CF022354YN03-293中国云南野生材料D42CF022360YN03-312中国云南野生材料D43CF022362科龙迪(KLWA13)丹麦栽培材料D44CF022364百霸荷兰栽培材料D45CF022398流浪者(NomaD)新西兰栽培材料D47CF0223991044美国栽培材料D48CF022414肯尼亚(Kenya)法国栽培材料D49CF022415哈芒安(RVP.Itacon)英国栽培材料D50CF022445锡拉(Siral)澳大利亚栽培材料D51CF0224471442新西兰栽培材料D52CF022450Ez lucero inTA阿根廷栽培材料D54CF022449FRWKL2德国栽培材料D55CF022349FRWKL1德国栽培材料
表2 SSR引物扩增信息
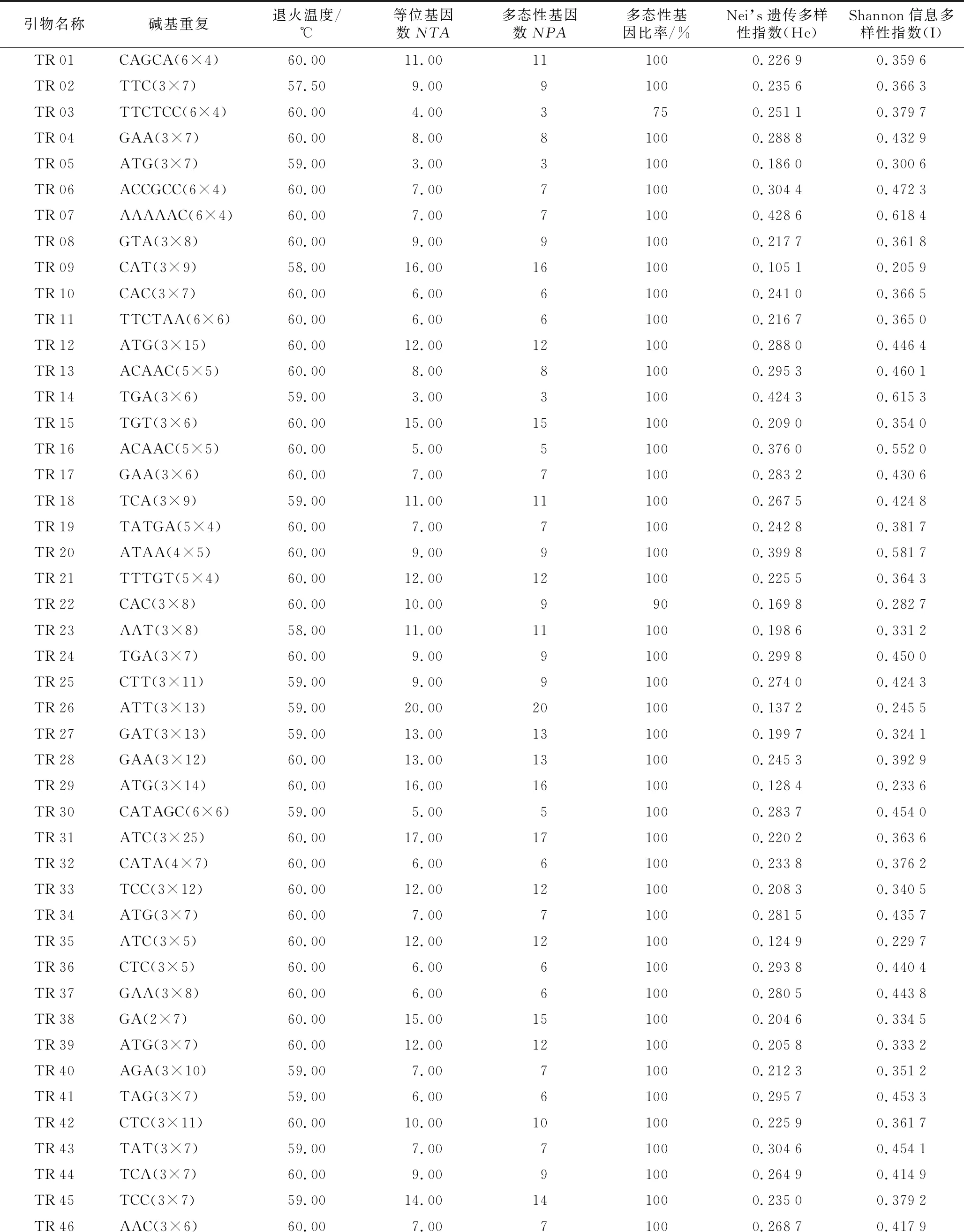
引物名称碱基重复退火温度/℃等位基因数NTA多态性基因数NPA多态性基因比率/%Nei’s遗传多样性指数(He)Shannon信息多样性指数(I)TR01CAGCA(6×4)60.0011.00111000.22690.3596TR02TTC(3×7)57.509.0091000.23560.3663TR03TTCTCC(6×4)60.004.003750.25110.3797TR04GAA(3×7)60.008.0081000.28880.4329TR05ATG(3×7)59.003.0031000.18600.3006TR06ACCGCC(6×4)60.007.0071000.30440.4723TR07AAAAAC(6×4)60.007.0071000.42860.6184TR08GTA(3×8)60.009.0091000.21770.3618TR09CAT(3×9)58.0016.00161000.10510.2059TR10CAC(3×7)60.006.0061000.24100.3665TR11TTCTAA(6×6)60.006.0061000.21670.3650TR12ATG(3×15)60.0012.00121000.28800.4464TR13ACAAC(5×5)60.008.0081000.29530.4601TR14TGA(3×6)59.003.0031000.42430.6153TR15TGT(3×6)60.0015.00151000.20900.3540TR16ACAAC(5×5)60.005.0051000.37600.5520TR17GAA(3×6)60.007.0071000.28320.4306TR18TCA(3×9)59.0011.00111000.26750.4248TR19TATGA(5×4)60.007.0071000.24280.3817TR20ATAA(4×5)60.009.0091000.39980.5817TR21TTTGT(5×4)60.0012.00121000.22550.3643TR22CAC(3×8)60.0010.009900.16980.2827TR23AAT(3×8)58.0011.00111000.19860.3312TR24TGA(3×7)60.009.0091000.29980.4500TR25CTT(3×11)59.009.0091000.27400.4243TR26ATT(3×13)59.0020.00201000.13720.2455TR27GAT(3×13)59.0013.00131000.19970.3241TR28GAA(3×12)60.0013.00131000.24530.3929TR29ATG(3×14)60.0016.00161000.12840.2336TR30CATAGC(6×6)59.005.0051000.28370.4540TR31ATC(3×25)60.0017.00171000.22020.3636TR32CATA(4×7)60.006.0061000.23380.3762TR33TCC(3×12)60.0012.00121000.20830.3405TR34ATG(3×7)60.007.0071000.28150.4357TR35ATC(3×5)60.0012.00121000.12490.2297TR36CTC(3×5)60.006.0061000.29380.4404TR37GAA(3×8)60.006.0061000.28050.4438TR38GA(2×7)60.0015.00151000.20460.3345TR39ATG(3×7)60.0012.00121000.20580.3332TR40AGA(3×10)59.007.0071000.21230.3512TR41TAG(3×7)59.006.0061000.29570.4533TR42CTC(3×11)60.0010.00101000.22590.3617TR43TAT(3×7)59.007.0071000.30460.4541TR44TCA(3×7)60.009.0091000.26490.4149TR45TCC(3×7)59.0014.00141000.23500.3792TR46AAC(3×6)60.007.0071000.26870.4179
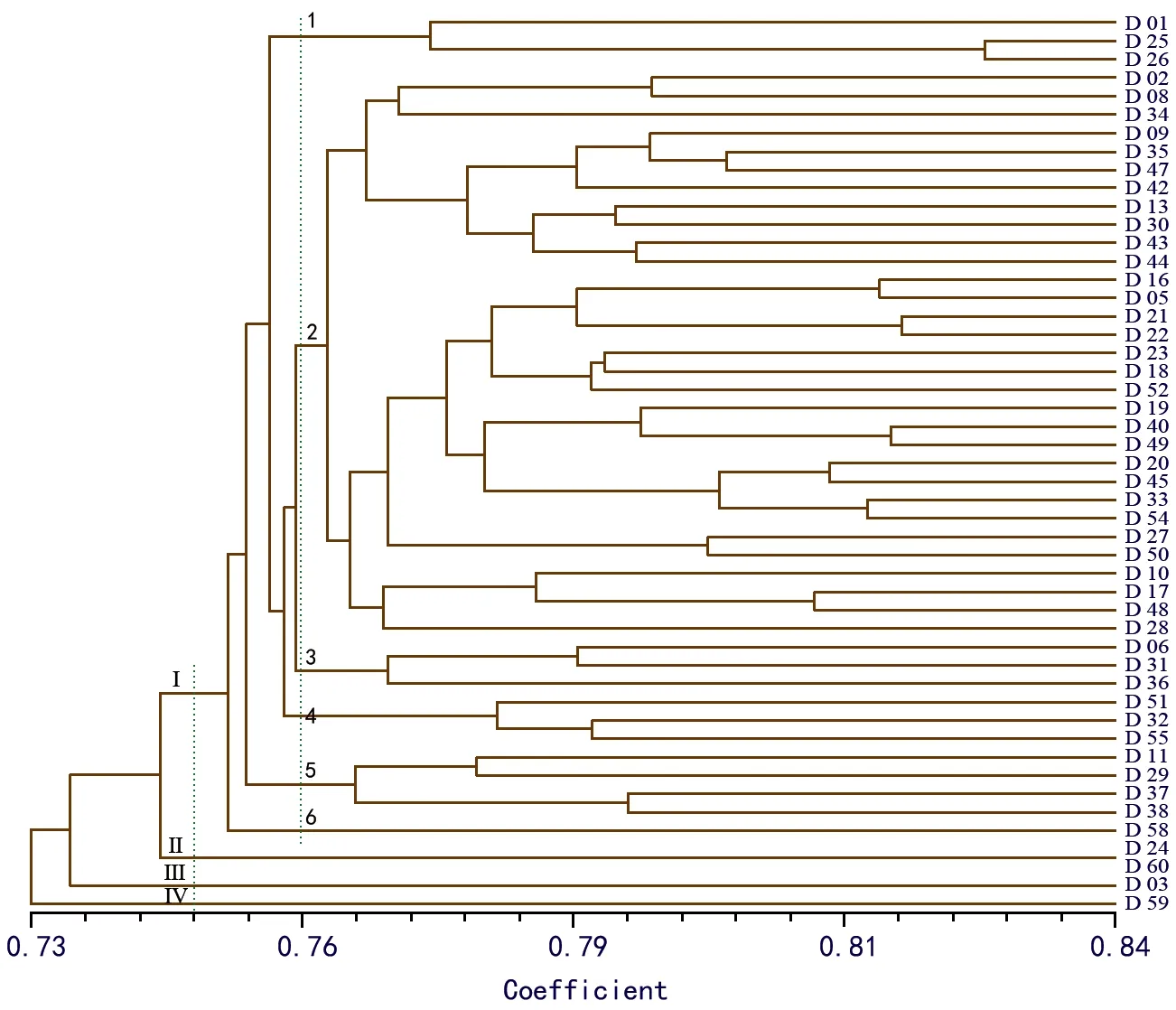
图1 49份白三叶材料的UPGMA聚类图
2.2 多态性聚类分析
以441个位点的谱带数据建立“0,1”矩阵,利用NTSYS-PC 2.10软件基于UPGMA法对49个白三叶材料进行聚类分析,得到UPGMA聚类图(见图1)。结果表明,材料间的遗传相似系数最大的为0.842(D 24和D 60),最小的为0.693(D 03和D 59)。基于遗传相似系数的聚类分析表明,在遗传相似系数为0.748处可将所有白三叶材料分为四大类。第Ⅰ大类包括45份材料,涵盖了所有来源国的材料;第Ⅱ大类包括2份,来自新西兰(D 24)和中国(D 60);第Ⅲ大类包括1份材料,来自丹麦(D 03);第Ⅳ大也包括1份材料,来自中国(D 59)。在遗传相似系数为0.76处,第Ⅰ大类可分为6个小组,第1小组包括3份材料,来自中国、美国和新西兰;第2小组包括28份材料,来自美国、新西兰、澳大利亚、丹麦等国;第3小组包括3份材料,来自美国、英国和荷兰;第4小组包括3份材料,来自新西兰、德国和荷兰;第5小组也包括3份材料,来自中国、美国和新西兰;第6小组包括1份材料,来自新西兰。
3 讨论与结论
3.1 白三叶不同种质间存在丰富的多样性
群体的遗传多样性与SSR标记位点变异程度有关,群体多样性越丰富,其位点变异程度越大,Shannon信息多样性指数越高。本研究中,49份白三叶品种SSR位点Shanon信息多样性指数平均值为0.399,略低于李莉对贵州野生白三叶SSR标记位点的平均值0.475,高于张婧源对70份白三叶材料的SSR标记位点的平均值0.334[21],说明不同白三叶种质间差异较大,其遗传多样性较为丰富。从遗传相似系数看,49份白三叶材料的遗传相似系数分布在0.693~0.842之间,平均值为0.760,反映了种质材料多样的遗传关系。本研究中,白三叶材料多为栽培品种,尽管其来自世界各地,并且具有不同的经济性状或内在差异特性,但经过多年栽培驯化其种群内的多样性丰富程度较野生型有所差异。
3.2 栽培驯化过程可影响白三叶种质的遗传信息
种质材料来源地或地理位置是影响种质材料遗传关系的重要因素,通常来说来自同一地区或地理生态区的种质材料具有相近的遗传信息,在聚类分析中就具有更近的遗传相似系数,这已经被前人所证实[21-23]。但本研究中来自同一国家(地区)的材料并没有聚类在一类,可能是由于本研究中白三叶材料多为育成品种,其育种材料的原始来源地所属国不一定是培育国,不同国家育成的不同品种可能其原始亲本采集地相近。比如序号D 50材料Siral,其培育国是澳大利亚,但其原始植株采集地来自非洲的阿尔及利亚[4]。实际上,中国大部分白三叶品种都由国外引进,比如云南地区仅在20世纪80年代就引进三叶草品种近200个,在长期驯化过程中出现了丰富的性状变异。但是,对于一些野生材料,基本来源地相同的材料能够聚为同一类,比如来自中国云南的野生材料D 37和D 38被聚为一类,其遗传相似系数为0.794。
3.3 基于转录组序列开发白三叶多态性引物是可行的
SSR分子标记技术已经广泛应用于遗传多样性、分子标记辅助育种以及生物进化的研究[24-25],其引物筛选是开展分子标记的关键环节。随着高通量测序技术的发展,基于测序数据开发SSR标记成为一种可能。本研究利用白三叶转录组序列开发出的48对SSR引物标记对白三叶进行遗传多样性分析,其扩增谱带多态性比率达99.5%,高于白三叶同类指标结果[16,19,20],表明基于转录组序列开发白三叶多态性引物是可行的、有效的。

