E-选择素肽配体及其与羟基喜树碱的偶联物合成与抗肿瘤活性评价
张 震,赵 龙,付 颖,冯玉莲,尤 兴,郭 娜
(天津科技大学生物工程学院,天津 300457)
E-选择素属于细胞黏附分子,在炎症等因子刺激的内皮细胞中过表达[1].E-选择素已经被证明在多种癌细胞与内皮细胞的黏附过程中起重要作用,并介导后续的肿瘤转移[2].肿瘤细胞表面的某些特定结构会识别肿瘤血管内皮细胞表面过表达的E-选择素并使肿瘤细胞黏附于血管内皮细胞表面,这是启动肿瘤细胞随血液迁移的第一步,因此E-选择素可以作为靶标,其配体[3-6]则可以发挥靶向炎症或靶向肿瘤的作用,同时有可能阻断肿瘤转移.唾液酸化的路易斯x(SLex)是目前公认的E-选择素的天然配体结构,但该寡聚四糖结构与E-选择素的结合能力较低,而合成难度却相当大.因此,设计合成新型的高效E-选择素配体十分必要.
除了寡糖结构,文献中另一类E-选择素配体为多肽分子,如已报道的七肽IELLQAR[7]和十二肽DITWDQLWDLMK[8]作为E-选择素的配体,与糖类配体相比具有结合力强、合成成本低、易于合成等优点.本文以结构简单的已报道的E-选择素肽配体IELLQAR 为出发点,通过反转氨基酸序列、在多肽的氨基端或羧基端上载一个半胱氨酸作为连接桥、D型非天然氨基酸代替这3 种方式来设计多肽序列,并分别测试其抑制HL60 细胞与HUVEC 细胞的黏附活性,以考察不同结构对多肽活性的影响并寻找更优良的多肽分子.同时,拟将该类配体与抗肿瘤药物偶联,考察其应用于药物的肿瘤靶向和抗肿瘤转移的效果.
1 材料与方法
1.1 试剂与仪器
羟基喜树碱,化学纯,上海龙翔医药科技有限公司;对硝基氯甲酸苯酯,化学纯,国药化学试剂有限公司;9-芴甲氧羰基(Fmoc)保护的各种所需氨基酸原料,如Fmoc-异亮氨酸、Fmoc-亮氨酸等,分析纯,吉尔生化(上海)有限公司;1,2-乙二硫醇、甲基苯基硫醚、N,N-二异丙基乙胺(DIEA),分析纯,萨恩化学技术(上海)有限公司;N,N-二甲基甲酰胺(DMF)、二氯甲烷(DCM),分析纯,国药集团化学试剂有限公司;氘代氯仿,分析纯,北京百灵威化学试剂有限公司;无水甲醇(MeOH),分析纯,天津市盛迪达贸易有限公司;多聚赖氨酸(MW4000),分析纯,湖北康宝泰精细化工有限公司;2-氯三苯基甲基氯树脂,天津南开和成科技有限公司.
MALDI-Tof 型核磁共振仪,美国布鲁克公司;三用紫外分析仪,上海嘉鹏科技有限公司;冷冻干燥机,北京博医康仪器有限公司;循环水式真空泵、旋转蒸发仪,上海亚荣生化仪器厂;高效液相色谱仪,美国安捷伦科技公司.
1.2 多肽的合成
多肽的合成采用经典的Fmoc 固相合成策略,合成路线如图1 所示.
具体操作步骤如下:
上载第1 个氨基酸:称取1 g(0.35 mmol)2-氯三苯基甲基氯树脂至于25 mL 反应瓶,真空干燥3 h,加入10 mL 无水DCM,32 ℃搅拌0.5 h,抽滤,将1.4 mmol 的Fmoc-氨基酸和树脂溶于10 mL 无水DCM 中,滴加3.15 mmol(520 μL)的DIEA,32 ℃搅拌3 h,滴加0.14 mL 甲醇继续搅拌0.5 h,抽滤,10 mL DCM、DMF、MeOH 依次洗涤树脂各5 min,抽滤,真空干燥.
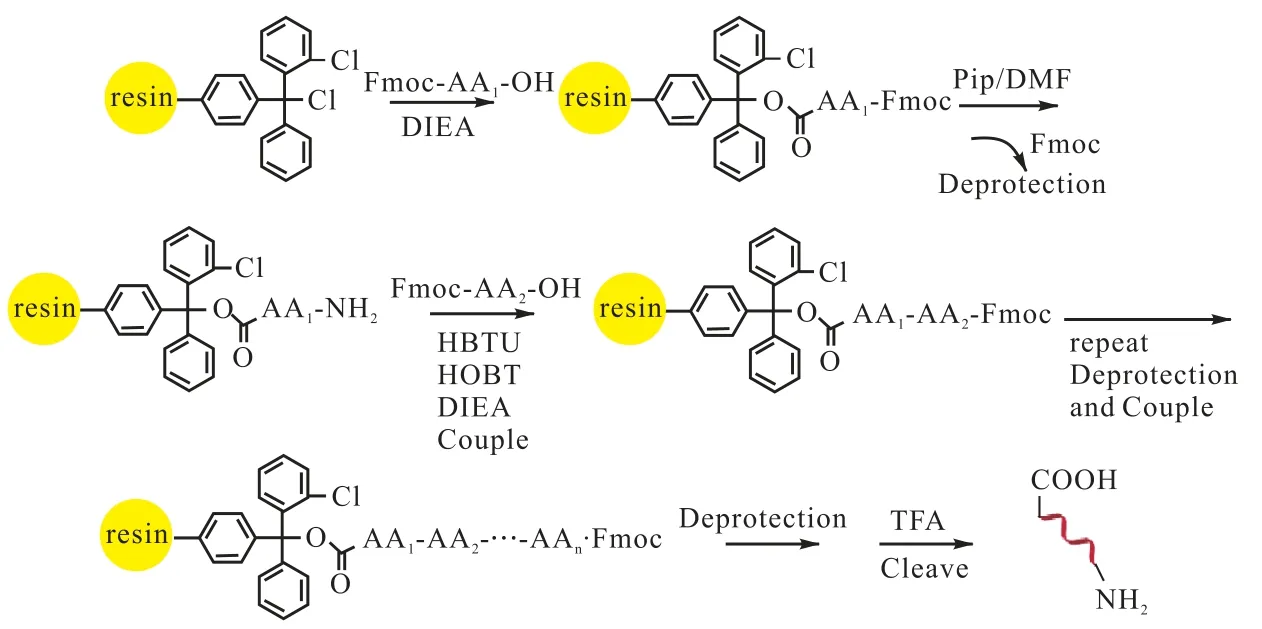
图1 多肽的合成路线 Fig. 1 Synthesis of peptides
顺序上载剩余氨基酸:上述树脂用10 mL 30%哌啶的DMF 溶液32 ℃搅拌0.5 h,脱除Fmoc,茚三酮法监测反应进程,待反应完成后抽滤,用 10 mL DMF、异丙醇、DMF 依次洗涤树脂各5 min,抽滤,10 mL DMF 加入树脂中,加入1.05 mmol 的Fmoc-氨基酸、142 mg 1-羟基苯并三唑(HOBT)、398 mg O-苯并三氮唑-四甲基脲六氟磷酸酯(HBTU),滴加2.1 mmol(347 μL)的DIEA,32 ℃摇床反应2.5 h.茚三酮法监测反应过程,反应完成后抽滤,用10mL DMF、异丙醇、DMF 依次洗涤树脂各5 min,抽干,重复以上过程,上载不同氨基酸,直至合成目标多肽序列.
裂解:配制10 mL 裂解液(苯酚、乙二硫醇、苯甲硫醚、水、三氟乙酸的体积比为 5﹕5﹕2.5﹕5﹕82.5),将树脂和裂解液至于反应瓶,34 ℃搅拌3 h,将反应液滤入100 mL 冷乙醚中,4 000 r/min 离心5 min,收集沉淀物,乙醚洗涤3 次,离心收集沉淀物,氩气吹干,HPLC 检测纯度,MALDI-Tof 确定相对分子质量.
1.3 体外抗黏附实验
多聚赖氨酸(20 μg/mL)包被黑色96 孔细胞培养板,37 ℃孵育12 h.内皮细胞HUVEC 以1×105个/孔接种于黑色96 孔板,37 ℃孵育36 h 后移去培养基.实验组加入含有20 ng/mL TNF-α的F-12 培养基,阴性对照组加入未添加TNF-α的F-12 培养基,37 ℃孵育6 h 使其表达E-选择素.收集对数生长期的人急性早幼粒白血病细胞HL-60(1×105个/孔),1 000 r/min 离心 5 min;加入 5 mL PBS 清洗,1 000 r/min 离心5 min,弃上清液;加入100 μL 1640培养基吹悬,加入20 μmol/L 钙黄绿素,避光,37 ℃孵育45 min;1 000 r/min 离心5 min,弃上清液;加入1 mL PBS 清洗,1 000 r/min 离心5 min,弃上清液;加入1640 培养基将沉淀吹悬到所需体积.以1×107个/孔的细胞密度接种于加有HUVEC 细胞的96 孔板中立即加入一定浓度的待测物,阳性对照组只加入缓冲液,37 ℃避光孵育30 min 后加入PBS 清洗3次,去除未与HUVEC 细胞结合的HL-60 细胞.每孔加入 100 μL 透膜液,检测荧光强度(激发波长485 nm,发射波长528 nm).黏附抑制作用与荧光强度成反比例关系,荧光值越低,说明化合物的黏附抑制效果越强.数据用GraphPad Prism 5.0 软件处理作图.数据采用SPSS 统计分析软件进行差异性分析,每个试样测3 次,数据以“平均值±标准差”表示,采用post-hocTukey 检验法进行显著性分析,*、***分别表示与空白组相比有显著差异P<0.05、P<0.001,###表示对照组与空白组相比有显著差异P<0.001.
1.4 体外细胞毒活性测试
MTT 法检测化合物13、14、15 和多肽配体1 对人白血病细胞K562 和人肝癌细胞HepG2 的生长抑制活性.细胞存活率按照式(1)计算[9-10].

2 结果与分析
2.1 合成的多肽序列及结构确认
通过设计反转序列、两端添加用于连接其他结构的半胱氨酸、使用非天然构型的D 型氨基酸这3 种策略,共获得了12 个多肽分子(表1),各个肽分子经HPLC 分析,纯度均达到95%以上,MALDI-Tof 质谱显示其相对分子质量均正确.以进一步应用的多肽分子1 为例,其HPLC 及MALDI-Tof 图谱如图2 和图3 所示.
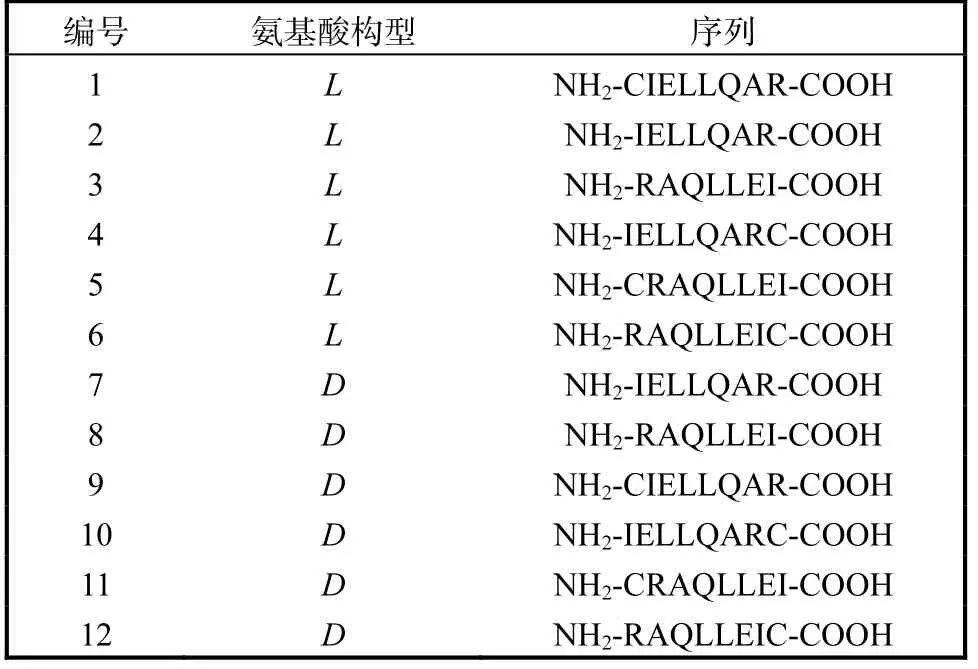
表1 多肽的氨基酸序列与构型 Tab. 1 Amino acid sequence and structure of peptides
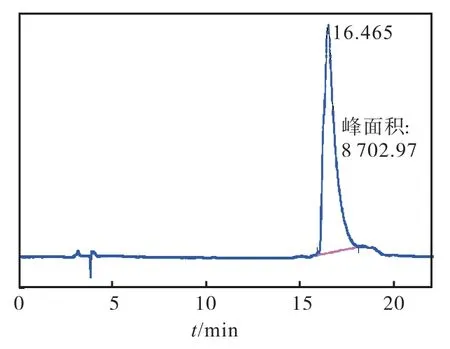
图2 化合物1的HPLC图谱 Fig. 2 HPLC of compoud 1
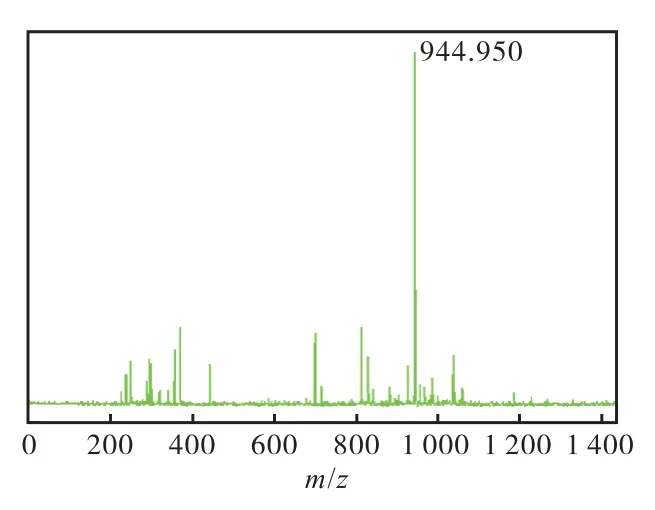
图3 化合物1的MALDI-TOF图谱 Fig. 3 MALDI-TOF spectrum of compound 1
2.2 多肽的体外抗黏附活性
E-选择素多肽配体可以竞争性地抑制肿瘤细胞表面的天然配体与肿瘤血管内皮细胞表面过度表达的E-选择素的黏附,从而抑制该黏附作用所导致的肿瘤细胞迁移.因此,在体外利用表达E-选择素配体的肿瘤细胞HL60 和血管内皮细胞HUVEC 建立了抗黏附活性测试体系,分别测试了L 型的6 条多肽(1—6)和D 型的6 条多肽(7—12)在体外抑制HL60 细胞与HUVEC 细胞黏附作用,其中空白组为未加入TNF-α,对照组为用TNF-α 刺激但没有加入任何待测化合物.多肽终浓度为1µmol/L,实验(图4)表明:L 型多肽中在氨基端增加了作为连接桥使用的半胱氨酸后,即CIELLQAR(1),具有显著的抗黏附效果;而该浓度下,已报道的七肽IELLQAR(2)[7]则没有明显作用.这也与文献[7]报道是相符合的,因为七肽2 被报道其作用强度较弱,IC50为0.2 mmol/L. 而D 型序列多肽(图5)中发现了更多的具有明显抗黏附活性的多肽分子(7、8、10、11 和12).
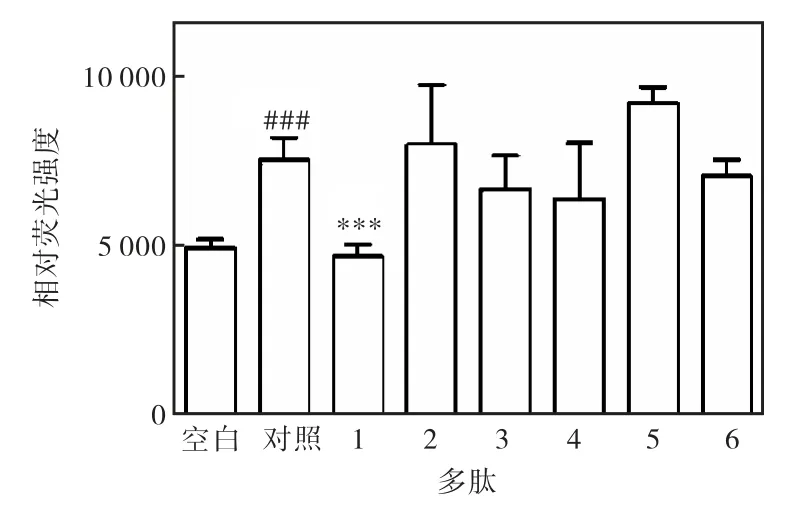
图4 L 型多肽(1—6)抗黏附活性 Fig. 4 Anti-adhesion activities of L-peptides(1-6)
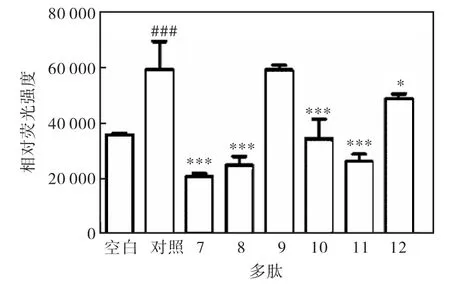
图5 D 型多肽(7—12)抗黏附活性 Fig. 5 Anti-adhesion activities of D-peptides(7-12)
2.3 多肽与化疗药物HCPT偶联物的抗肿瘤活性
由于E-选择素特异性地在肿瘤部位血管内皮高表达,因此其配体可用作靶标分子,将药物递送到肿瘤部位的靶点,同时鉴于E-选择素在肿瘤转移中的重要作用,其配体还理论上还可阻断或抑制肿瘤的转移.为了探索合成的肽配体在抗肿瘤方面的应用,选择原料价廉且活性较好的L 型多肽CIELLQAR(1)为靶标分子,将其通过3 种连接桥与抗肿瘤药物羟基喜树碱相连,得到了偶联物13—15 用于评价,结构如图6 所示.
对上述偶联物(13—15)及多肽分子CIELLQAR (1)进行体外细胞毒活性测试,结果见表2,偶联物13—15 均基本保持了与HCPT 相当的活性,而多肽分子本身不具有明显的细胞毒活性,一方面说明多肽分子的安全性,另一方面也说明偶联物在培养体系中可以释放出原药羟基喜树碱从而发挥抗肿瘤作用.
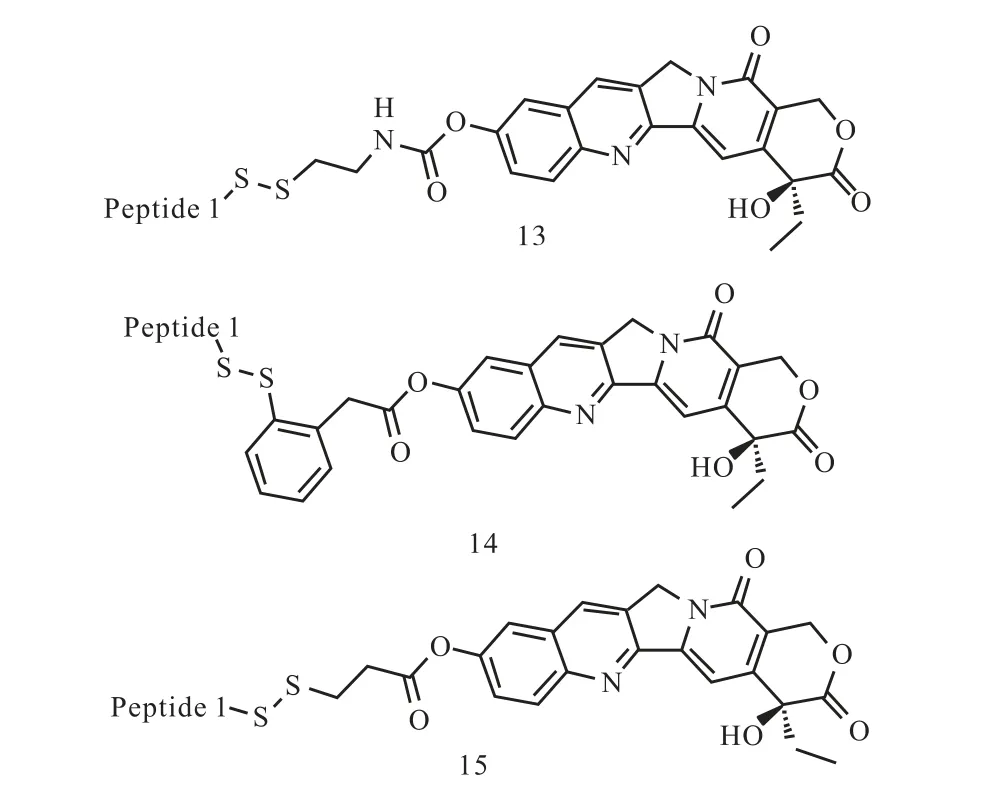
图6 肽-羟基喜树碱偶联物(13—15)的结构示意图Fig. 6 Structures of peptide-HCPT conjugates(13-15)
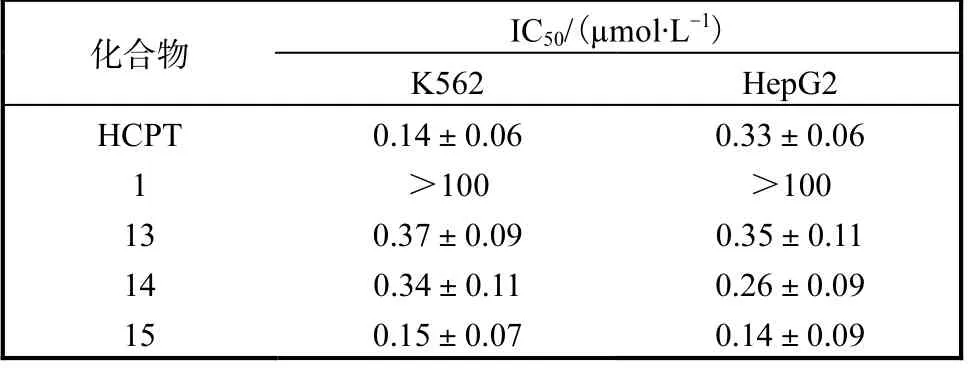
表2 化合物13—15对肿瘤细胞抑制活性结果 Tab. 2 Inhibition activity of compounds 13-15 on tumor cells
以活性最好的化合物15 为例,其MALDI-Tof 如图7 所示,1H NMR 数据如下.
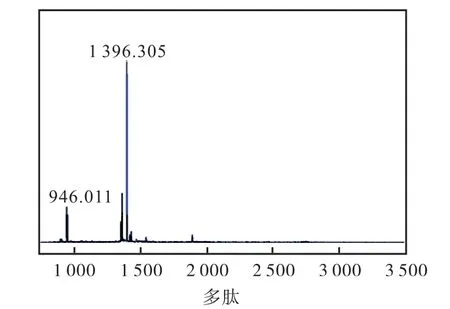
图7 化合物15的MALDI-Tof图谱 Fig. 7 MALDI-Tof spectrum of compound 15
1H NMR(400 MHz,DMSO-d6)δ 8.70(s,1H),8.23(d,J=8.8 Hz,2H),8.12(d,J=7.6 Hz,1H),8.00(d,J=7.2 Hz,2H),7.93(m,3H),7.68(d,J=6.8 Hz,1H),7.61(s,1H),7.35 ~6.56(m,7H),5.56(s,2H),5.44(s,2H),4.37 ~4.13(m,8H),3.50 ~2.95(m,11H),2.27 ~2.05(m,4H),1.92 ~1.39(m,16H),1.20(d,J=7.2 Hz,3H),1.08(m,1H),0.85(m,22H).
进一步的体外抗黏附活性表明,HCPT 本身并不具有抗黏附作用,而多肽分子偶联了药物羟基喜树碱后(偶联物13—15)在1µmol/L 浓度时仍保留了多肽分子的抗黏附活性(数据未列出).更令人兴奋的是,在更低的浓度下(0.3µmol/L),化合物13 和14 也显示出了明显的抗黏附效果(图8),说明在发挥药物抗肿瘤作用的浓度下,偶联物同样具有较好的抑制肿瘤细胞黏附的作用.
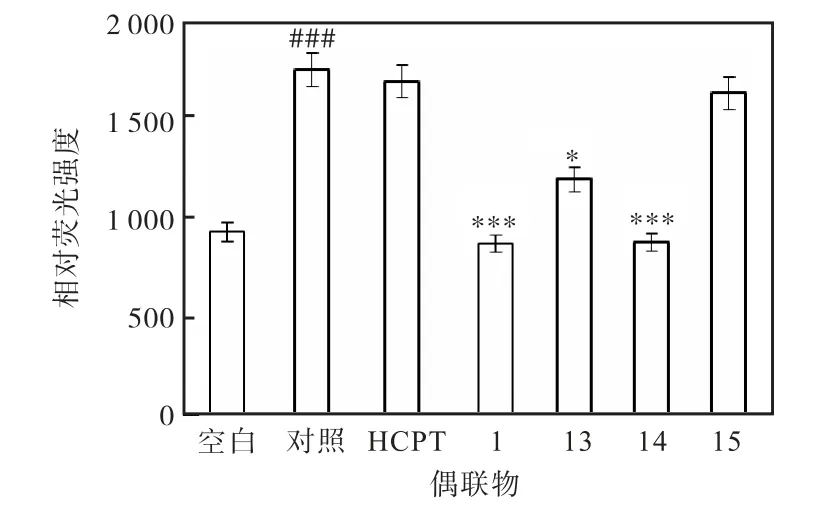
图8 偶联物(13—15)抗黏附活性 Fig. 8 Anti-adhesion activities of conjugates(13-15)
3 结 语
本文采用固相合成法成功制备了12 个不同序列的E-选择素肽配体,并发现了一系列活性增强的肽分子.在L 型多肽NH2-CIELLQAR-COOH 的基础上以不同的连接方式与HCPT 进行偶联,以研究该类配体在抗肿瘤方面的应用.其细胞毒活性和抗黏附活性测试结果表明,这些化合物同时具有较好的黏附抑制活性和对肿瘤细胞的细胞毒性.该研究为发现高效低毒的抗肿瘤靶向药物和抗肿瘤转移药物提供了新的基础数据和研究思路.

