血管内皮细胞源外泌体对动脉粥样硬化大鼠免疫因子的影响
罗雪挺 周 用 蒋满红 罗保平
1.湖北中医药大学第一临床学院,湖北武汉 430000;2.湖北中医药大学附属医院肿瘤科,湖北武汉 430000
动脉粥样硬化(atherosclerosis,AS)为心血管系统常见慢性炎症性疾病[1],其发病机制多源于动脉壁内皮细胞损伤。内皮细胞属分界细胞,参与炎症、抗凝、纤溶等作用[2],在AS 的发生、发展、迁延等各个病程中都发挥着作用,且介导炎症及氧化应激作用的发生[3],其功能障碍于AS 发病早期起关键性诱发作用[4]。
深入研究发现,反映血管内皮功能的相关因子可以反映AS 的严重程度[5],其病灶呈多量源于血管内皮细胞等不同细胞的外泌体集聚。排泌功能障碍或遭受损伤的内皮细胞会分泌多样的黏附分子,同时分泌肿瘤坏死因子(TNF-α)介导白细胞,尤其单核细胞直接黏附于内皮,排泌多种炎症因子如TNF-α、白细胞介素-1(IL-1)、白细胞介素-6(IL-6)等[6],促进粥样斑块形成,而AS 的探索也迎来新思路:对血管内皮相关外泌体功能的探讨及损伤修复机制的研究。
Exosomes 为膜性细胞外泌体,形态结构特殊稳定,可经由胞间信号转导来调控胞间基因表达[7],本研究试图探究血管内皮源性exosomes 与血管内皮细胞损伤的关系及在AS 产生机制中所起作用。
1 材料与方法
1.1 实验动物
8 周龄清洁级健康Wistar 大鼠购自湖北省实验动物研究中心,实验动物合格证号:42000600017350,生产许可证号:SCXK(鄂)2018-0018,室温常规饲养,湖北中医药大学伦理委员会审核批准动物实验。采用完全随机法进行分组,所有动物编1~30 号,从随机数字表抄录30 个数字,各数一律除以3,并以余数1、2、3 代表A、B、C,结果分别归入3 组,以随机数字表按斜角线抄录数字除尽,进行均数改组,得到3 组各10 只大鼠,A、B、C 三组分别为对照组、模型组及免疫组。
1.1 试剂
1640 去exosomes 完全培养基(2018-084-17)、PBS(2018-1073BD)购自GIBCO 公司;Recombinant Murine IL-4(2018-09-372)、Recombinant Murine GM-CSF(315-03-72)均购自Pepro Tech 公司;mouse CD54 magnetic microbeads(921-7-03)、PE anti-mouse CD86 antibody(725-09-27)、PE anti-mouse MHC Ⅰantibody(725-09-39)、FITC anti-mouse CD54 antibody(392-04-33)、FITC anti-mouse MHC Ⅱantibody(392-04-56)均购自eBioscience 公司;Exoquick-TC 抽提试剂盒(10A-7-S)、pNpp 底物(796-2018)、PBST:10×PBS 25 mL/Tween-20 125 μL/去离子水225 mL、封闭液:BSA 2.5 g/PBS 250 mL(H-GS-3329)均购自Sigma 公司;生化试剂NaBr/NaCl/EDTA/蔗糖等购自博士得生物科技有限公司。
1.3 主要仪器设备
流式细胞仪(型号:Attune NxT,ThermoFisher 公司);CO2恒温细胞培养箱(型号:DSPM-808,江南仪器);微量移液器及相应Tip:10、100、1000 μL(型号:Ripet-Lite XLS+,Rainin 公司);全自动生化检测仪(型号:AU2700,Olympus 公司);倒置显微镜(型号:GX71,Olympus 公司);台式水平高速离心机(型号:Centrifuge 5804R,Eppendorf 公司);超微量分光光度计(型号:Nanodrop ND-1000,Thermo Finnigan 公司);-80℃冰箱(型号:MDF-192,SANYO Electric Biomedical 公司)。
1.4 方法
1.4.1 血管内皮细胞培养及鉴定 以去内源性exosomes 培养基原代培养Wistar 大鼠血管内皮细胞,分选后接种入35 mm 培养皿(5×106),依次加20 ng/mL粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)、100 ng/mL IL-4,48 h 后加AGE-LDL 20 μg/mL 孵育,20 h 后倒置相差显微镜观察生长情况。流式细胞术鉴定细胞:收取培养后细胞离心10 min(1000 r/min,r=8 cm),弃上清后重悬分管,每管细胞(1×106)分别加入PE antimouse CD54、PE anti-mouse CD86、FITC anti-mouse MHC Ⅰ,FITC anti-mouse MHC Ⅱ,4℃下避光孵育35 min,3 mL PBS 洗涤2 次,350 μL PBS 重悬处理后的内皮细胞,上机检测。
1.4.2 Exosomes 的提取制备及鉴定 Ox-LDL 诱导内皮细胞释放exosomes 并集取,离心10 min(1000 r/min,r=8 cm)后弃上清,接种于35 mm 去内源性exosomes的1640+10%FBS 培养基中(5×106),24 h 后聚集培养液离心10 min(1000 r/min,r=8 cm),集上清转培养至15 mL 离心管离心15 min(3000 r/min,r=8 cm),再集上清至另一离心管,加Exoquick-TC(比例5∶1),混匀4℃孵育12 h,混悬液离心30 min(1500 g)至渐现白色沉淀,弃上清离心5 min(1500 r/min,r=8 cm),同步骤吸弃上清获管底沉淀,适量PBS 重悬抽提exosomes 鉴定,余冻存-80℃冰箱。
配制蛋白BCA 工作液形成定量标准曲线(30~500 μg/mL),取80 μL 加入10 μL exosomes 液,混匀后室温孵育30 min,nanodrop 测OD 值计算浓度;5 μg exosomes 移入1.5 mL 离心管,加10 μL Latex Beads混匀孵育15 min,适量PBS 配至1 mL,振荡2 h 加110 μL 1 mol/L 甘氨酸,离心混合液3 min(4000 r/min,r=8 cm),弃上清重悬,重复操作,400 μL PBS 重悬后移入4 个试管(每管100 μL),分别加入PE-anti CD86、FITC anti-mouse MHC Ⅰ、PE anti-CD54、FITC antimouse MHC Ⅱ流式抗体,4℃下避光孵育30 min,加PBS 1 mL 离心3 min(4000 r/min,r=8 cm),双次洗涤,200 μL PBS 重悬后上机检测。
1.4.3 动物造模 对照组大鼠常规饲养,模型组及免疫组按照固定配比[8](7%猪油、5%胆固醇、3%白砂糖、0.5%胆酸钠、0.2%丙硫氧嘧啶、84.3%基础饲料)配置高脂高糖饲料进行饲养,同时700 000 U/kg 维生素D3灌胃,免疫组于第5 周尾静脉注射exosomes,继续喂养至第8 周。
1.4.4 实验动物生化指标检测 三组大鼠均只供水12 h称重,2%戊巴比妥钠0.2 mL 腹腔注射麻醉,下腔静脉取血摇匀,离心机离心5 min(3200 r/min,r=8 cm),取上清入AU2700 全自动生化检测仪,检测血糖、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、总胆固醇(TC)、三酰甘油(TG)。
1.4.5 大鼠血管内皮细胞检测 1.5 mL 血管内皮细胞分离液入离心管,1 mL 肝素抗凝,离心15 min(1800 r/min,r=8 cm)弃上清,保留混悬环状内皮细胞层,加适量PBS 混匀后离心5 min(1300 r/min,r=8 cm),弃上清留次层细胞混悬,入血细胞计数池,光镜下九宫格计数血管内皮细胞,同一标本取5 次均值记录。另取次层细胞混悬100 μL 以500 μL 多聚甲醛固定(4℃),10 min 后分离50 μL 备测细胞混悬于专用EP 管内,加2 μL 抗Ⅷ因子-FITC 抗体混匀,避光孵育30 min(37℃),PBS 混匀离心5 min(1300 r/min,r=8 cm),弃上清,50 μL PBS 重悬,荧光显微镜下观察阳性细胞。
1.4.6 实时荧光定量PCR(qRT-PCR)测定大鼠免疫系统活化情况 检测IL-2、IL-4、IFN-γ mRNA 水平,引物序列设计及合成由武汉博士德生物科技有限公司完成,引物序列见表1。取大鼠新鲜心血管内皮组织,加RNAiso Plus,按规范操作进行匀浆、脱壁、清洗和孵育,4℃下离心5 min(12 000 r/min,r=8 cm),移入异丙醇及氯仿进行离心,获取得到总RNA,DEPC 水解沉淀RNA,分别取5 μL 共4 份电泳鉴定。于260~280 nm 波长处以紫外可见光分光光度计检测吸光度,进行定量换算。继于PCR 仪上行逆转录,反应1 h(42℃)转入95℃反应5 min,冰上冷却,继于95℃加热1 min,退火30 s,65℃1 min,共40 次循环操作,最后65℃延伸10 min。
1.4.7 免疫组化检测大鼠免疫系统活化后炎症因子的表达情况 采集各组大鼠胸主动脉血液,离心匀浆,450 nm 处测OD 值,拟合标准曲线及方程计算各因子浓度,ELISA 双抗体夹心法检测各组大鼠血清IL-1、TNF-α、ET-1 的含量,分别以T 细胞受体(TCR)和TLR2、TLR4(Toll 样受体)作为标记分子,检测血管壁VCAM-1 的含量。

表1 各指标引物序列及长度
1.5 统计学方法
采用SPSS 11.0 统计学软件进行数据分析,计量资料数据用均数±标准差()表示,多组间比较采用单因素方差分析,组间两两比较采用LSD 检验;以P <0.05 为差异有统计学意义。
2 结果
2.1 内皮细胞培养及鉴定
2.1.1 MTT 法绘制内皮细胞生长曲线 MTT 法1 周内持续检测获得内皮细胞生长曲线,呈现典型的“潜伏-对数生长-平台”倒S 曲线,传代至第6 代时可见,细胞进入对数增长期时间较原代略短。见图1。
2.1.2 倒置相差显微镜观察内皮细胞形态 倒置相差显微镜下观察可见,原代培养的内皮细胞24 h 后缓慢出现并逐渐稀疏、不规则贴壁,单个伸展或簇团均存在,形态、大小有较大差异性,贴壁后生长较缓,对数生长期滞后,72 h 后呈现约80%融合,贴壁渐增,形态渐趋饱满且规则一致,传至第6 代,细胞形态较前更为饱满圆润。见图2。

图1 内皮细胞生长曲线

图2 镜下内皮细胞生长情况(400×)
2.1.3 内皮细胞鉴定 经流式鉴定,所得细胞各组阳性率 分 别 为,CD54:93.26%,MHC-Ⅰ:82.57%,CD86:76.79%,MHC-Ⅱ:82.73%。见图3。
2.2 鉴定exosomes 的纯度及属源性
将抽提获取得到的exosomes 的血管内皮细胞表达的相关表面分子进行流式分析,CD54 和CD86 表达率分别为18.69%、25.32%,MHC-Ⅰ和MHC-Ⅱ的表达率分别为10.01%、6.98%。见图4。
2.3 三组大鼠各项生化指标检测
模型组及免疫组体重均超出正常范围,模型组与对照组比较,差异有高度统计学意义(P <0.01),相应的各项生化指标血糖、TG、TC、HDL-C、LDL-C 均显著高于对照组(P <0.01),表明造模成功。与模型组比较免疫组各项指标降低,但仅TG、TC 与LDL-C差异有统计学统计学意义(P <0.05 或P <0.01)。见表2。
2.4 三组大鼠血管内皮细胞免疫荧光计数
对照组大鼠外周血中所含血管内皮细胞数量极少,而模型组大鼠的血管内皮细胞数量明显增多,而免疫组虽较对照组计数略增,但血管内皮细胞数量少于模型组。见图5。

图3 内皮细胞染色情况

图4 exosomes 纯度及属源性的流式鉴定结果
表2 喂养8 周后三组大鼠各项生化指标比较()

表2 喂养8 周后三组大鼠各项生化指标比较()
注:与对照组比较,**P <0.01;与模型组比较,#P <0.05,##P <0.01。TG:三酰甘油;TC:总胆固醇;HDL-C:高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白固醇
2.5 三组大鼠细胞因子检测
与对照组大鼠比较,模型组大鼠血清细胞因子IL-2、IL-4、IFN-γ 的mRNA 表达均明显升高,差异有高度统计学意义(P <0.01);与模型组比较,免疫组各项指标均降低,差异有统计学意义(P <0.05 或P <0.01)。见表3。

图5 三组大鼠血管内皮细胞免疫荧光计数(荧光免疫,200×)
表3 三组大鼠细胞因子IL-2、IL-4、IFN-γ 的mRNA 表达水平比较()
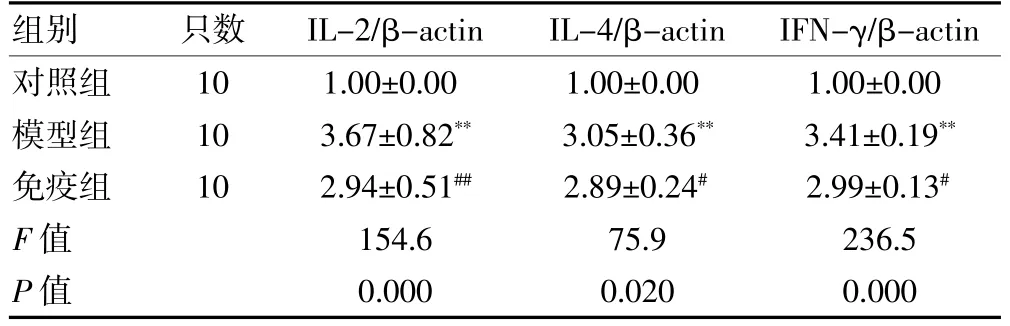
表3 三组大鼠细胞因子IL-2、IL-4、IFN-γ 的mRNA 表达水平比较()
注:与对照组比较,**P <0.01;与模型组比较,#P <0.05,##P <0.01。IL-2:白细胞介素-2;IL-4:白细胞介素-4
2.6 三组大鼠血清炎性因子TNF-α、IL-1、ET-1、NO表达
与对照组比较,模型组大鼠血清炎性因子TNF-α、IL-1、ET-1 水平均明显升高,血清NO 水平明显降低,差异均有高度统计学意义(P <0.01);与模型组比较,免疫组TNF-α、IL-1、ET-1 均明显降低,NO 明显升高,差异有统计学意义(P <0.01)。见表4。
表4 三组大鼠血清炎性因子表达水平比较()

表4 三组大鼠血清炎性因子表达水平比较()
注:与对照组比较,**P <0.01;与模型组比较,##P <0.01。TNF-α:肿瘤坏死因子-α;IL-1:白细胞介素-1;ET-1:人内皮素-1;NO:一氧化氮
3 讨论
动脉粥样硬化的诱因[9]为各种有害因素(血脂、血糖及血压超标等)导致的血管内皮损伤[10],舒缩力下降、通透过度及各种功能障碍,各种免疫黏附分子表达异常,导致持续性的内皮损伤[11],大量促炎因子如IFN-γ、IL-2、IL-4 等释放入血,内皮下炎症进行性加剧,脂质浸润持续增多,最终导致动脉粥样硬化斑块成形[12]。可见病程中,内皮细胞损伤与exosomes 分泌互为因果,是关键致病因素。
很早就有研究证实预防接种疫苗能有效降低高胆固醇血症兔的主动脉动脉粥样硬化斑块面积[13],其作用机制多为相应抗原被细胞摄取并加工提呈给周围淋巴组织,使得机体产生相应的免疫应答,进而消除该抗原的致病作用[14]。现阶段动脉粥样硬化疫苗抗原制备多源于蛋白或肽段,有较多局限性,如易降解、无法冻存、一级过敏反应等[15]。exosomes 依据其独特的生物学特性与功用在疫苗研究中崭露头角[16]。其磷脂双分子层结构性质稳定,可防止多样酶降解[17],且异质性低,有效避免了过敏及排斥反应[18]。因此,exosomes 疫苗具有可观的发展前景。
ET-1 是源于血管内皮细胞排泌的强力血管收缩肽,具有极强的缩血管和促细胞增殖作用,一旦发生血管内皮损伤,ET-1 的合成与释放会即时升高,NO亦是血管内皮细胞排泌的内皮保护因子,已证实能阻止动脉粥样硬化病程进展[19]。本实验中,模型组大鼠血清的ET-1 水平显著升高,NO 的水平明显下降,确定证实病程中的内皮细胞受损,而免疫组ET-1 升高不明显,差异无统计学意义(P >0.05),NO 未明显下降,提示exosomes 免疫后血管内皮细胞损伤减轻,动脉粥样硬化病程减缓。
动脉粥样硬化病程同时与炎性反应密切相关,促炎因子TNF-α、IL-1 则是炎性反应中重要的启动因子,可促进中性粒细胞对血管壁的黏附及平滑肌细胞增生,活化凝血因子,进而诱发动脉粥样硬化[20]。动脉粥样硬化病程中,损伤的血管内皮刺激并活化了免疫系统,细胞因子IL-2、IL-4 和IFN-γ 等相继释放。IL-2、IFN-γ 是公认的Th1 反应因子,可以促进单核细胞产生吞噬作用,诱导并加强损伤细胞的细胞毒作用,同时介导细胞渐次排泌TNF-α 与各级氧化因子,识别并杀灭特定靶细胞,IFN-γ 与TNF-α[21]共同导致血管内皮损伤加重。IL-4 源于Th2 细胞排泌,可活化细胞毒性T 细胞,抑制释放炎性细胞因子,本实验检测了各组大鼠外周血清中的IL-2、IL-4、INF-γ mRNA 表达,发现模型组的IL-2、IL-4、INF-γ mRNA 表达较对照组与免疫组都显著增高;免疫组各项指标的基因表达减弱,这一趋势在血清炎性因子TNF-α、IL-1 等的表达中亦出现同样表现,可见,exosomes 免疫后的动脉粥样硬化大鼠体内,炎性细胞因子排泌表达减少,内皮细胞损伤受到保护,动脉粥样硬化病程减缓。
综上所述,exosomes 的独特的生物学特性及典型的免疫调节作用,在对动脉粥样硬化病的预防及治疗中,将起到不可或缺的作用。

